文章信息
- 崇乐, 夏露花, 张荣, 贾志莺, 崔培, 冷晓玲
- Chong Le, Xia Luhua, Zhang Rong, Jia Zhiying, Cui Pei, Leng Xiaoling
- 乳腺癌超声造影与临床病理特征及肿瘤相关的树突状细胞分布的相关性研究
- Correlation between contrast-enhanced ultrasound features and clinicopathological indicators and tumor-associated dendritic cell distribution of breast cancer
- 实用肿瘤杂志, 2025, 40(1): 14-19
- Journal of Practical Oncology, 2025, 40(1): 14-19
基金项目
- 新疆维吾尔自治区自然科学基金(2023D01C134);国家自然科学基金(82360362)
-
通信作者
- 冷晓玲, Email: 58281431@qq.com
-
文章历史
- 收稿日期:2023-11-05
2. 新疆医科大学附属肿瘤医院核医学科, 新疆 乌鲁木齐 830011;
3. 巴楚县人民医院超声科, 新疆 巴楚 843800;
4. 南方医科大学第十附属医院(东莞市人民医院)超声科, 广东 东莞 523000
2. Department of Nuclear Medicine, Affiliated Tumor Hospital of Xinjiang Medical University, Wulumuqi 830011, China;
3. Department of Ultrasound, Bachu County People's Hospital, Bachu 843800, China;
4. Department of Ultrasound, the Tenth Affiliated Hospital of Southern Medical University (Dongguan People's Hospital), Dongguan 523000, China
乳腺癌是我国常见的恶性肿瘤,每年约有6万例新诊断病例[1]。中国乳腺癌年新发病例数逐年增长,而且与发达国家比较,我国新发病例分期更晚,疾病负担更重。这对我国乳腺癌早发现、早诊断和诊断准确度提出了更高的要求[2]。超声在乳腺癌诊断中起重要作用。超声在识别单纯囊肿与复杂囊肿、良性肿块与恶性肿块和正常淋巴结与异常淋巴结方面具有很高的准确度。超声造影是在二维超声的基础上通过静脉注射造影剂和利用不同组织之间的灌注时相的差异提高超声诊断准确度的新技术[3]。树突状细胞(dendritic cell, DC)是机体抗肿瘤免疫的中心环节,DC在多数组织中主要以未成熟状态出现,功能主要是抗原捕获和加工[4]。当这些未成熟的DC检测到损伤或病原体相关分子存在时,未成熟细胞开始进入成熟状态。肿瘤相关的树突状细胞(tumor-associated dendritic cell, TADC)与肿瘤的微环境有重要关系。TADC是反映肿瘤局部免疫反应的重要指标,而TADC与乳腺癌超声造影表现的关联性如何尚无相关研究[5-6]。因此本研究拟利用乳腺癌常见临床病理指标与超声造影指标和TADC的分布特点进行相关性分析,以探索乳腺癌超声造影特征与临床病理特征和TADC的关系。
1 资料与方法 1.1 一般资料选取2021年3月至2023年3月在新疆医科大学附属肿瘤医院进行检查的乳腺癌患者119例。纳入患者均为女性;年龄27~79岁,平均年龄44岁。纳入标准:高度怀疑为乳腺癌;在超声造影前未行乳腺肿块穿刺和手术治疗;无造影剂过敏史。本研究已通过新疆医科大学附属肿瘤医院医学伦理审查(审批号G-2023027),在造影前告知患者及其家属造影可能的并发症和不良反应,并获得患者及其家属的知情同意。
1.2 仪器与方法使用美国GE公司的LOGIQ E90彩色多普勒超声诊断仪,探头型号L2-9,频率5~12 MHz。超声造影剂采用意大利Bracco公司的SonoVue,用5.0 mL生理盐水稀释振荡后备用[7]。患者采取平卧位,充分暴露双乳和腋窝区,记录二维超声和彩色多普勒超声检查中关于肿块特征的描述(位置、大小、数目和回声特征)。行超声造影模式,留存动态图像5 min,动态回放观察造影的全过程5 min[8],乳腺癌超声造影的不同区域的界定方法如文献[7]所述。由2位副高职称以上的超声医师在未知患者诊断的前提下读取超声造影动图,通过微血管显像分析造影剂灌注的血流形态学特征[9]。
观察指标包括:增强形态(规则和不规则)、增强边界(清楚和不清楚)、病灶增强范围(=二维超声范围和 > 二维超声范围)、增强强度(非高增强和高增强)、造影剂分布(均匀分布、不均匀分布和周边增强)、增强顺序(整体增强或离心性增强和向心性)、造影模式(速升速降、速升缓降和缓升缓降或缓升速降)、灌注缺损(无和有)和穿支血流(无和有)。
1.3 免疫组织化学和流式细胞术检查取用HE染色,病理科医师在光学显微镜下阅片,每张切片分别随机选择5个低倍(×200)和高倍视野(×400),观测间质中DC的病理形态,为TADC免疫组织化学分析的研究区域进行定位。
免疫组织化学采用EnVision二步连续切片的方法分别进行白细胞分化抗原1a(cluster differentiation 1a, CD1a)和CD83的染色,以CD1a+/CD83-为未成熟DC。观察靶细胞的特征,选取100倍光学显微镜下肿瘤间质中所要观察细胞的5个高密度区,分别计算其400倍光学显微镜下阳性细胞数,取平均值作为肿瘤间质辅助细胞的浸润数量。
流式细胞术检测标本中的TADC,将CD1a+/CD83-判断为未成熟DC。每次试验前用质控荧光微球对仪器进行光路和流路检测,变异系数(variable coefficient, CV)值< 2,计数5 000个细胞,用Listmode软件程序进行数据分析,计数CD1a和CD83表达的阳性数量。
1.4 统计学分析采用SPSS 22.0软件分析数据。计数资料采用频数(百分比)表示,组间比较采用χ2检验。计量资料符合正态分布的,采用均数±标准差(x±s)表示,组间比较采用t检验和单因素方差分析;不符合正态分布的,采用中位数(四分位间距)[M(Q1,Q3)]表示,组间比较采用Wilcoxon秩和检验。相关性分析采用Kruskal-Wallis H检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 乳腺癌超声造影定性特征的分析及其与病理类型的关系对119例乳腺癌患者的超声造影作定性研究发现,不同病理类型的乳腺癌在病灶增强范围、灌注缺损、增强形态、增强边界、造影剂分布、造影模式和是否有穿支血流方面比较,差异均无统计学意义(均P > 0.05),而在增强程度和增强顺序方面比较,差异均具有统计学意义(均P < 0.01,表 1)。两两比较发现,原位癌较其他类型癌出现增强范围 > 二维超声范围、高增强和灌注缺损的比例更低(均P < 0.05)。
| 超声造影定性特征 | 例数(%) | 病理类型 | ||||
| 原位癌 | 浸润性癌 | 浸润性癌合并原位癌 | χ2值 | P值 | ||
| 病灶增强范围 | 3.286 | 0.222 | ||||
| > 二维超声范围 | 91(76.5) | 7(58.3) | 70(76.9) | 14(87.5) | ||
| =二维超声范围 | 28(23.5) | 5(41.7) | 21(23.1) | 2(12.5) | ||
| 灌注缺损 | 5.575 | 0.061 | ||||
| 无 | 82(68.9) | 11(91.7) | 63(69.2) | 8(50.0) | ||
| 有 | 37(31.1) | 1(8.3) | 28(30.8) | 8(50.0) | ||
| 增强形态 | 4.885 | 0.087 | ||||
| 不规则 | 112(94.0) | 10(83.3) | 88(96.7) | 14(87.5) | ||
| 规则 | 7(6.0) | 2(16.7) | 3(3.3) | 2(12.5) | ||
| 增强边界 | 1.903 | 0.410 | ||||
| 不清楚 | 90(75.6) | 10(83.3) | 70(76.9) | 10(62.5) | ||
| 清楚 | 29(24.4) | 2(16.7) | 21(23.1) | 6(37.5) | ||
| 增强程度 | 12.219 | 0.002 | ||||
| 非高增强 | 31(26.1) | 8(66.7) | 21(23.1) | 2(12.5) | ||
| 高增强 | 88(73.9) | 4(33.3) | 70(76.9) | 14(87.5) | ||
| 造影剂分布 | 3.473 | 0.490 | ||||
| 均匀分布 | 31(26.1) | 3(25.0) | 24(26.4) | 4(25.0) | ||
| 不均匀分布 | 70(58.8) | 9(75.0) | 53(58.2) | 8(50.0) | ||
| 周边增强 | 18(15.1) | 0(0.0) | 14(15.4) | 4(25.0) | ||
| 增强顺序 | 11.516 | 0.003 | ||||
| 整体增强或离心性增强 | 38(31.9) | 8(66.7) | 29(31.9) | 1(6.3) | ||
| 向心性 | 81(68.1) | 4(33.3) | 62(68.1) | 15(93.7) | ||
| 造影模式 | 2.535 | 0.638 | ||||
| 速升速降 | 68(57.1) | 7(58.3) | 50(54.9) | 11(68.8) | ||
| 速升缓降 | 27(22.7) | 3(25.0) | 20(22.0) | 4(25.0) | ||
| 缓升缓降或缓升速降 | 24(20.2) | 2(16.7) | 21(23.1) | 1(6.2) | ||
| 穿支血流 | 0.933 | 0.644 | ||||
| 无 | 42(35.3) | 4(33.3) | 34(37.4) | 4(25.0) | ||
| 有 | 77(64.7) | 8(66.7) | 57(62.6) | 12(75.0) | ||
将乳腺癌超声造影的边缘区域、中央区域和癌旁正常区域乳腺组织间质中的未成熟DC分别认定为TADC,用免疫组织化学法和流式细胞术进行鉴定。方差分析显示,免疫组织化学和流式细胞术检查中,TADC在边缘区域、中央区域和癌旁正常区域的浸润数量比较,差异均具有统计学意义(均P < 0.01,表 2)。TADC在边缘区域、中央区域和癌旁正常区域的浸润情况检测中,免疫组织化学和流式细胞术检查的结果具有很好的相关性和一致性(均P < 0.01)。TADC在边缘区域、中央区域和癌旁正常区域中的浸润数量呈递增趋势(图 1)。
| 检测方法 | 边缘区域 | 中央区域 | 癌旁正常区域 | F值 | P值 |
| 免疫组织化学 | 5.65±1.41*△ | 7.53±3.17* | 10.65±2.22 | 134.054 | < 0.01 |
| 流式细胞术 | 1.26±0.92*△ | 2.82±1.33* | 7.66±6.40 | 26.627 | < 0.01 |
| 注 *与相同检测方法的癌旁正常区域比较,P < 0.05;△与相同检测方法的中央区域比较,P < 0.05 | |||||
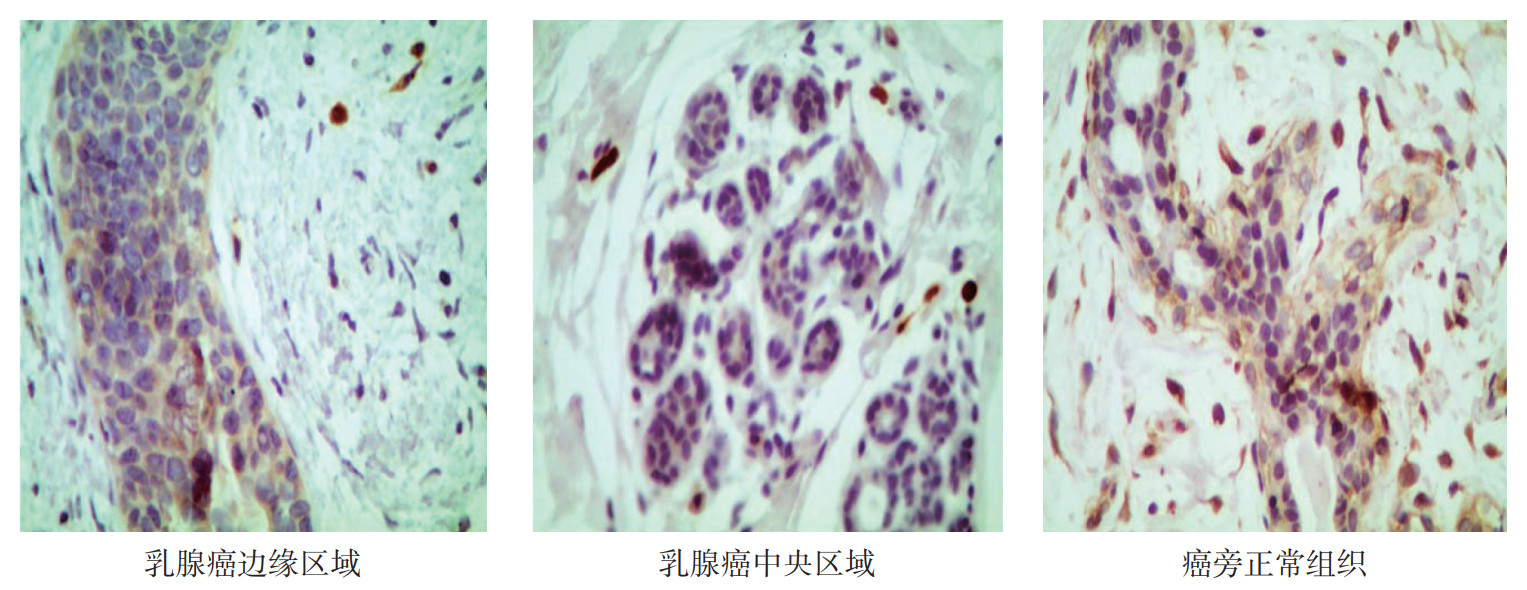
|
| 图 1 TADC在乳腺癌边缘区域、中央区域和癌旁正常区域中的分布差异(HE×400) Fig.1 Distribution of TADCs in the edge, central, and paracancerous normal areas of breast cancer (HE×400) |
乳腺癌造影后,与增强范围=二维超声范围者比较,> 二维超声范围者病灶边缘区域的TADC更少(P < 0.01),病灶中央区域的TADC更多(P < 0.05),癌旁正常区域的TADC差异无统计学意义(P > 0.05,表 3)。与无灌注缺损者比较,有灌注缺损者病灶边缘区域的TADC数量差异无统计学意义(P > 0.05),病灶中央区域和癌旁正常区域的TADC均减少(均P < 0.05)。与非高增强者比较,高增强者病灶边缘区域、中央区域和癌旁正常区域的TADC数量均更少(均P < 0.05)。
| 区域 | 增强范围 | 灌注缺损 | 增强强度 | |||||||||||
| > 二维超声范围 | =二维超声范围 | t值 | P值 | 有 | 无 | t值 | P值 | 高增强 | 非高增强 | t值 | P值 | |||
| 边缘区域 | 4.29±0.60 | 6.07±1.32 | -9.937 | < 0.01 | 5.35±1.06 | 5.78±1.52 | -1.767 | 0.080 | 5.32±1.18 | 6.58±1.61 | -4.008 | < 0.01 | ||
| 中央区域 | 8.61±3.54 | 7.20±2.99 | 2.085 | 0.039 | 5.97±1.95 | 8.23±3.37 | -4.600 | < 0.01 | 6.43±2.60 | 10.65±2.52 | -7.927 | < 0.01 | ||
| 癌旁正常区域 | 10.55±2.18 | 9.32±3.56 | -0.864 | 0.389 | 10.05±1.79 | 10.91±2.35 | -2.191 | 0.031 | 9.50±1.08 | 13.90±1.08 | -19.504 | < 0.01 | ||
乳腺癌边缘区域中TADC数量在肿瘤大小方面比较,差异无统计学意义(P > 0.05,表 4)。病灶较大时,中央区域和癌旁正常区域的TADC均较少(均P < 0.05)。乳腺癌临床分期越高,边缘区域、中央区域和癌旁正常区域TADC数量均越少(均P < 0.05)。乳腺癌边缘区域TADC数量在组织学分级方面比较,差异无统计学意义(P > 0.05)。组织学分级较高时,中央区域和癌旁正常区域TADC均较少(均P < 0.01)。
| 区域 | 肿瘤大小 | 临床分期 | 组织学分级 | ||||||||||||
| ≤2 cm | > 2 cm | t值 | P值 | 0~Ⅰ期 | Ⅱ~Ⅳ期 | t值 | P值 | 1级 | 2级 | 3级 | F值 | P值 | |||
| 边缘区域 | 5.81±1.55 | 5.54±1.31 | -1.008 | 0.316 | 6.28±1.65 | 5.41±1.24 | -2.704 | 0.010 | 6.13±1.46 | 5.66±1.52 | 5.39±1.09 | 1.435 | 0.242 | ||
| 中央区域 | 8.68±3.54 | 6.78±2.67 | -3.143 | 0.002 | 10.91±2.49 | 6.29±2.40 | -9.209 | < 0.01 | 10.47±2.50 | 7.59±3.37 | 6.06±1.82 | 11.807 | < 0.01 | ||
| 癌旁正常区域 | 11.30±2.33 | 10.22±2.05 | -2.579 | 0.012 | 12.06±2.20 | 10.13±1.99 | -4.560 | < 0.01 | 12.20±2.08 | 10.65±2.30 | 9.94±1.75 | 5.784 | 0.004 | ||
乳腺癌是多种致癌因子作用下乳腺的上皮细胞发生增殖失控的现象。其高发病率居女性恶性肿瘤首位,也是女性肿瘤相关死亡的主要原因[10]。近年来超声新技术的发展日新月异,尤其是超声造影在乳腺癌的诊断中起重要作用[11]。超声造影的特征与乳腺癌的病理特征有一定的关系,而乳腺癌的恶性程度不仅局限于肿瘤本身,也与肿瘤的微环境密切相关[12]。TADC是乳腺癌微环境的重要组成部分。目前关于乳腺癌超声造影与病理特征和TADC的关系的研究处于初步阶段[13]。因此,本研究入组119例乳腺癌患者,研究超声造影与病理特征的关系,分析TADC在乳腺癌不同区域中的分布特点,进一步探索超声造影、临床病理特征与TADC的相关性。
本研究表明,乳腺癌超声造影后,与增强范围=二维超声造影范围者比较,> 二维超声造影范围者病灶边缘区域的TADC更少,中央区域增多。这种现象反映TADC在乳腺癌肿块中有向局部聚拢的现象,聚拢的区域正是距肿瘤浸润带较远的中央区域[14]。研究证实,肿瘤区域未成熟DC数量相对癌旁正常区域有所减少,而DC的成熟度降低更加明显,在肿瘤组织局部存在未成熟DC堆积现象[15]。超声造影出现灌注缺损时,中央区域和癌旁正常区域的未成熟DC减少,提示预后不良[16]。研究发现,血管内皮生长因子(vascular endothelial growth factor, VEGF)可能通过抑制DC的成熟,使之不能有效呈递肿瘤抗原,最终导致乳腺癌细胞产生免疫逃逸[17]。本研究中超声造影呈高增强的乳腺癌的未成熟DC低表达反映了VEGF与未成熟DC的关系,提示微血管分布与未成熟DC的负相关关系。TADC与临床病理特征的关系显示,肿瘤直径与边缘区域的TADC表达无关,肿块较大时,超声造影的中央区域TADC较少,可能与大的病灶造影出现灌注缺损有关,灌注缺损伴随着TADC数量的减少。但是也有研究证实,TADC与肿瘤大小无关,但是此类研究把乳腺癌肿块作为一个整体进行研究,未区分边缘区域与中央区域的差异[18]。本研究将边缘区域与中央区域区分,并以癌旁正常区域组织为参照,发现在边缘区域和癌旁正常区域中TADC的数量在肿瘤大小方面比较无差异,当病灶较大时,中央区域的TADC均较少,反映出乳腺癌肿瘤微环境的复杂与多样。
本研究以乳腺癌的不同区域为着眼点,研究TADC的区域分布差异,发现在癌边缘区域TADC明显减少,造影后增强范围 > 二维超声范围的乳腺癌存在TADC向肿瘤局部组织堆积的现象,TADC则被乳腺癌肿瘤微血管抑制。TADC与预后因子的关联性研究表明,TADC与肿瘤大小的关联同样存在区域的不均衡性,TADC在中央区域与肿瘤大小存在负相关,TADC是乳腺癌的保护性因素[19]。本研究对于乳腺癌的分型仅局限于病理类型,未进一步进行分子分型。这是本研究的局限性之一,下一步将深入进行分子分型相关研究。
| [1] |
Zhao XJ, Yang X, Fu L, et al. Associations of estrogen receptor, progesterone receptor, human epidemic growth factor receptor-2 and Ki-67 with ultrasound signs and prognosis of breast cancer patients[J]. Cancer Manag Res, 2021, 13: 4579-4586. DOI:10.2147/CMAR.S276422 |
| [2] |
Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J, 2021, 134(7): 783-791. DOI:10.1097/CM9.0000000000001474 |
| [3] |
Gong XT, Li QF, Gu LS, et al. Conventional ultrasound and contrast-enhanced ultrasound radiomics in breast cancer and molecular subtype diagnosis[J]. Front Oncol, 2023, 13: 1158736. DOI:10.3389/fonc.2023.1158736 |
| [4] |
Dillman RO, Nistor GI, Keirstead HS. Autologous dendritic cells loaded with antigens from self-renewing autologous tumor cells as patient-specific therapeutic cancer vaccines[J]. Hum Vaccin Immunother, 2023, 19(1): 2198467. DOI:10.1080/21645515.2023.2198467 |
| [5] |
Qian D, Li JL, Huang MY, et al. Dendritic cell vaccines in breast cancer: immune modulation and immunotherapy[J]. Biomed Pharmacother, 2023, 162: 114685. DOI:10.1016/j.biopha.2023.114685 |
| [6] |
刘昕. Poly(I: C)对宫颈癌细胞与肿瘤浸润巨噬细胞相互作用的影响及对宫颈癌血管生成的作用[D]. 济南: 山东大学, 2020.
|
| [7] |
崇乐, 夏露花, 赵亮, 等. 乳腺癌超声造影指标与临床病理及肿瘤相关成纤维细胞数量的相关性[J]. 分子影像学杂志, 2021, 44(2): 264-269. |
| [8] |
冯景, 王洲, 刘芳欣, 等. 声触诊组织成像定量技术联合超声造影对BI-RADS 4类乳腺肿瘤的鉴别诊断价值[J]. 实用肿瘤杂志, 2021, 36(2): 145-148. |
| [9] |
刘芳欣, 王洲, 李健, 等. 超声O-RADS分类联合超声造影及血清CA125和HE4检测诊断绝经后卵巢肿物的应用价值[J]. 实用肿瘤杂志, 2023, 38(4): 392-397. |
| [10] |
Giaquinto AN, Sung H, Miller K, et al. Breast cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(6): 524-541. DOI:10.3322/caac.21754 |
| [11] |
苏荃利, 李玲玲, 邓芸霞, 等. 超声造影定性特征和VueBox定量参数评估乳腺癌分子分型的应用价值[J]. 中华超声影像学杂志, 2023, 32(5): 399-405. DOI:10.3760/cma.j.cn131148-20221107-00753 |
| [12] |
孙春晓, 黄香, 李薇, 等. 2023年CSCO指南更新解读: HER2阳性晚期乳腺癌[J]. 实用肿瘤杂志, 2023, 38(6): 505-508. |
| [13] |
Burgdorf S, Porubsky S, Marx A, et al. Cancer acidity and hypertonicity contribute to dysfunction of tumor-associated dendritic cells: potential impact on antigen cross-presentation machinery[J]. Cancers, 2020, 12(9): 2403. DOI:10.3390/cancers12092403 |
| [14] |
Korangath P, Barnett JD, Sharma A, et al. Nanoparticle interactions with immune cells dominate tumor retention and induce T cell-mediated tumor suppression in models of breast cancer[J]. Sci Adv, 2020, 6(13): eaay1601. DOI:10.1126/sciadv.aay1601 |
| [15] |
Ma JF, Chen K, Li SR, et al. MRI-based radiomic models to predict surgical margin status and infer tumor immune microenvironment in breast cancer patients with breast-conserving surgery: a multicenter validation study[J]. Eur Radiol, 2024, 34(3): 1774-1789. |
| [16] |
徐小艳, 王建君, 闫琛, 等. 乳腺浸润性导管癌中JMJD3、MMP-2和VEGF的表达及其与临床病理特征的关系[J]. 南方医科大学学报, 2020, 40(11): 1593-1600. DOI:10.12122/j.issn.1673-4254.2020.11.09 |
| [17] |
Al Kawas H, Saaid I, Jank P, et al. How VEGF-A and its splice variants affect breast cancer development-clinical implications[J]. Cell Oncol, 2022, 45(2): 227-239. DOI:10.1007/s13402-022-00665-w |
| [18] |
冷晓玲. 乳腺癌超声造影特征与恶性基质化、肿瘤血管异质性区域性特点的相关性[D]. 乌鲁木齐: 新疆医科大学, 2015.
|
| [19] |
吉丽银, 符策岗. 肿瘤微环境与乳腺癌发生发展[J]. 中国组织化学与细胞化学杂志, 2022, 31(4): 395-400. |
 2025, Vol. 40
2025, Vol. 40


