文章信息
- 苏欣宇, 王佳钰, 康东林, 邹征云
- Su Xinyu, Wang Jiayu, Kang Donglin, Zou Zhengyun
- 三级淋巴结构对黑色素瘤预后和肿瘤免疫微环境的影响
- Impact of tertiary lymphoid structures on prognosis and tumor immune microenvironment in melanoma
- 实用肿瘤杂志, 2024, 39(6): 531-535
- Journal of Practical Oncology, 2024, 39(6): 531-535
基金项目
- 国家自然科学基金项目(82073365, 81872484);江苏省社会发展面上项目(BE2019605)
-
通信作者
- 邹征云, E-mail: zouzhengyun@njglyy.com
-
文章历史
- 收稿日期:2024-01-11
2. 南京中医药大学鼓楼临床医学院肿瘤中心, 江苏 南京 210008;
3. 南京医科大学附属鼓楼临床医学院肿瘤中心, 江苏 南京 210008
2. Cancer Center, Nanjing Drum Tower Hospital Clinical College of Nanjing University of Chinese Medicine, Nanjing 210008, China;
3. Cancer Center, Nanjing Drum Tower Hospital Clinical College of Nanjing Medical University, Nanjing 210008, China
黑色素瘤是一种起源于皮肤或其他器官黑色素细胞的恶性肿瘤,具有侵袭性强、转移发生早和预后差等特点[1]。近年来,随着免疫检查点抑制剂在肿瘤治疗中不断取得突破性进展[2],针对肿瘤免疫微环境(tumor immune microenvironment, TIME)的研究也不断深入[3]。其中,TIME内的三级淋巴结构(tertiary lymphoid structure, TLS)是免疫细胞在非淋巴器官内异常聚集形成的淋巴样结构,已在多种实体肿瘤中被发现[4]。TLS可通过招募和活化T淋巴细胞和B淋巴细胞,促进抗原呈递和免疫记忆形成,增强抗肿瘤免疫应答反应。然而,关于TLS在中国黑色素瘤中的作用研究仍然较少。本研究旨在通过分析中国黑色素瘤患者中TLS等临床特征,探讨其与患者预后和肿瘤免疫细胞浸润的关系,以期为TLS预测患者生存预后和免疫治疗疗效提供依据。
1 资料与方法 1.1 一般资料收集南京大学医学院附属鼓楼医院2013年2月至2021年12月初诊初治、后行原发灶手术切除的黑色素瘤病例。所有入组病例均经病理确诊,术前未接受化疗或放疗,且临床资料与随访信息完整。所有患者术前均签署相关研究知情同意书。本研究已获得南京大学医学院附属鼓楼医院伦理审查委员会批准。
1.2 方法 1.2.1 HE染色肿瘤组织样本常温下经4%甲醛固定24 h后制成蜡块,使用微型切片机将其连续切成4 μm厚度切片,进行HE染色。所有HE染色载玻片均使用Olympus玻片扫描仪(Olympus VS2000;奥林巴斯,日本)扫描为数字化影像。2位具有中级职称以上的病理科医师在双盲条件下独立识别肿瘤内TLS。肿瘤内TLS判读标准(图 1):(1)判读区为肿瘤病灶内;(2)出现淋巴细胞聚集灶(淋巴细胞数≥100个);(3)TLS范围与间质区无交集[4]。
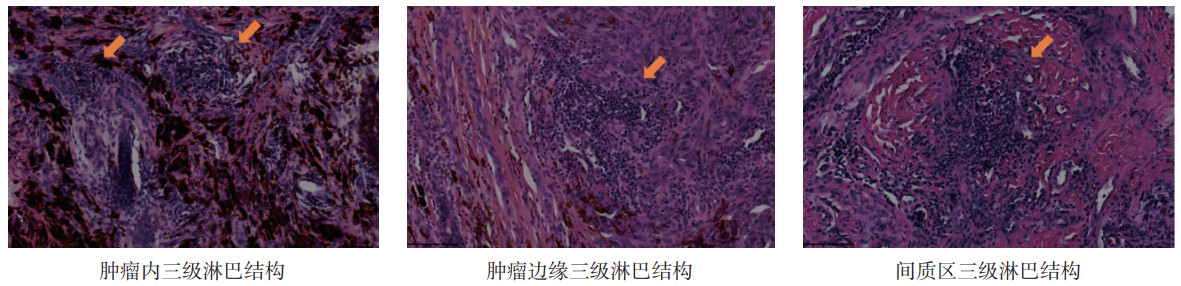
|
| 注 箭头示三级淋巴结构 图 1 黑色素瘤病理切片三级淋巴结构(HE×10) Fig.1 Tertiary lymphoid structures in melanoma tissues (HE×10) |
将蜡块根据入组病例病理结果制作为组织芯片,采用EnVision两步法行免疫组织化学染色。主要试剂为CD3兔单抗(ab11089,1∶200)、CD4兔单抗(ab133616,1∶500)、CD8兔单抗(ab237709,1∶2 000)和Foxp3兔单抗(ab215206,1∶100),均购自美国Abcam公司。采用已知的阳性或对照组织作为阳性对照,以PBS代替一抗作为阴性对照。
1.2.3 结果判读细胞内呈棕色颗粒者为阳性染色(图 2)。每例均随机在肿瘤中心区观察5个高倍视野(×400),计算每个视野中阳性细胞数后取均值。
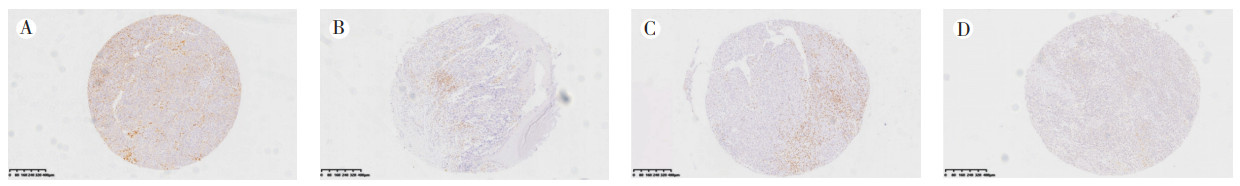
|
| 注 A:CD3+ T淋巴细胞;B:CD4+ T淋巴细胞;C:CD8+ T淋巴细胞;D:Foxp3+ Treg细胞 图 2 黑色素瘤组织芯片免疫组织化学检查结果(EnVision×5) Fig.2 Immunohistochemistry of melanoma tissue microarrays (EnVision×5) |
患者术后每2个月通过门诊复查或电话随访生存状态,随访截至2023年5月11日,随访时间7.7~124个月,中位随访时间32.85个月,无失访事件。总生存期(overall survival, OS)定义为从手术开始到因任何原因导致的死亡时间。
1.4 统计学分析采用SPSS 26.0软件与R软件(4.2.3)进行统计学分析。计数资料组间比较采用χ2检验或Fisher精确检验。符合正态分布的计量资料组间比较采用独立样本t检验,不符合正态分布的采用Wilcoxon秩和检验。生存曲线采用Kaplan-Meier法绘制,使用R软件中ggplot2包(3.3.6)进行数据可视化。生存分析中,单因素与多因素分析采用Cox比例风险回归模型。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床特征共入组78例患者,根据肿瘤病灶内是否存在TLS分为两组:存在肿瘤内TLS组38例,不存在肿瘤内TLS组40例(表 1)。存在肿瘤内TLS组中,患者年龄45~91岁,中位年龄67.5岁;男性17例,女性21例;肢端型24例,皮肤型7例,黏膜型7例;TNM分期,Ⅰ期6例,Ⅱ期16例,Ⅲ期9例,Ⅳ期2例,不明5例。不存在肿瘤内TLS组中,患者年龄40~86岁,中位年龄61岁;男性18例,女性22例;肢端型22例,皮肤型6例,黏膜型12例;TNM分期,Ⅰ期0例,Ⅱ期16例,Ⅲ期13例,Ⅳ期6例,不明5例。两组患者在TNM分期方面比较,差异具有统计学意义(χ2=11.091,P=0.026)。
| 临床病理特征 | 肿瘤内三级淋巴结构 | t/χ2值 | P值 | |
| 存在(n=38) | 不存在(n=40) | |||
| 年龄(x±s,岁) | 65.66±10.12 | 61.60±11.79 | 1.627 | 0.108 |
| 性别 | 0.001 | 0.981 | ||
| 男性 | 17(44.7) | 18(45.0) | ||
| 女性 | 21(55.3) | 22(55.0) | ||
| 病理类型 | 1.429 | 0.489 | ||
| 肢端 | 24(63.2) | 22(55.0) | ||
| 皮肤 | 7(18.4) | 6(15.0) | ||
| 黏膜 | 7(18.4) | 12(30.0) | ||
| TNM分期 | 11.091 | 0.026 | ||
| Ⅰ期 | 6(15.8) | 0(0.0) | ||
| Ⅱ期 | 16(42.1) | 16(40.0) | ||
| Ⅲ期 | 9(23.7) | 13(32.5) | ||
| Ⅳ期 | 2(5.3) | 6(15.0) | ||
| 未知 | 5(13.2) | 5(12.5) | ||
Kaplan-Meier生存曲线显示,存在和不存在肿瘤内TLS组患者平均OS分别为53.07个月和40.69个月,差异具有统计学意义(χ2=5.413,P=0.019;图 3)。单因素和多因素生存分析显示,患者年龄、肿瘤TNM分期和肿瘤内TLS状态为影响患者预后的独立危险因素(均P < 0.05,表 2)。
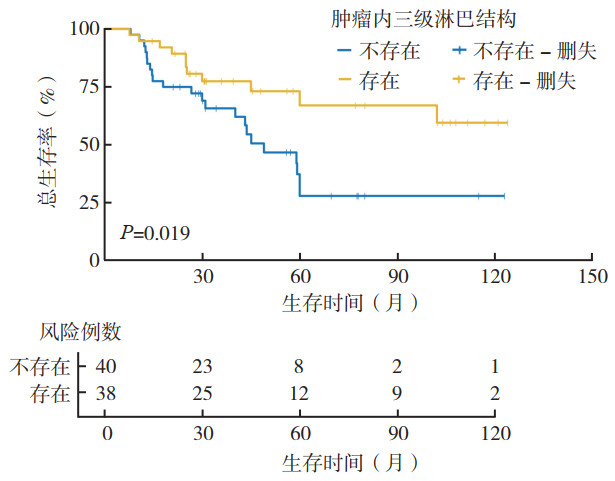
|
| 图 3 存在与不存在肿瘤内三级淋巴结构的黑色素瘤患者总生存曲线比较 Fig.3 Comparison of the overall survival curves between melanoma patients with and without intratumoral tertiary lymphoid structures |
| 临床病理特征 | 单因素Cox回归 | 多因素Cox回归 | |||||
| HR | 95% CI | P值 | HR | 95% CI | P值 | ||
| 年龄 | |||||||
| ≤65岁 | 1 | 1 | |||||
| > 65岁 | 2.142 | 1.063~4.317 | 0.033 | 2.409 | 1.187~4.889 | 0.015 | |
| 性别 | |||||||
| 男性 | 1 | ||||||
| 女性 | 1.067 | 0.756~1.506 | 0.713 | ||||
| 病理类型 | |||||||
| 肢端 | 1 | ||||||
| 皮肤 | 0.812 | 0.299~2.206 | 0.683 | ||||
| 黏膜 | 2.005 | 0.934~4.304 | 0.074 | ||||
| 肿瘤TNM分期 | |||||||
| Ⅰ~Ⅱ期 | 1 | 1 | |||||
| Ⅲ~Ⅳ期 | 2.635 | 1.251~5.550 | 0.011 | 2.684 | 1.255~5.742 | 0.011 | |
| 未知 | 1.476 | 0.475~4.586 | 0.504 | 1.369 | 0.436~4.302 | 0.590 | |
| 肿瘤内三级淋巴结构 | |||||||
| 存在 | 1 | 1 | |||||
| 不存在 | 1.524 | 1.058~2.197 | 0.024 | 2.644 | 1.254~5.574 | 0.011 | |
通过计算组织芯片中每平方毫米内CD3、CD4、CD8和Foxp3阳性细胞数评估TIME显示,存在肿瘤内TLS组肿瘤组织中CD3、CD4、CD8和Foxp3阳性细胞浸润数目增高(均P < 0.05,图 4)。
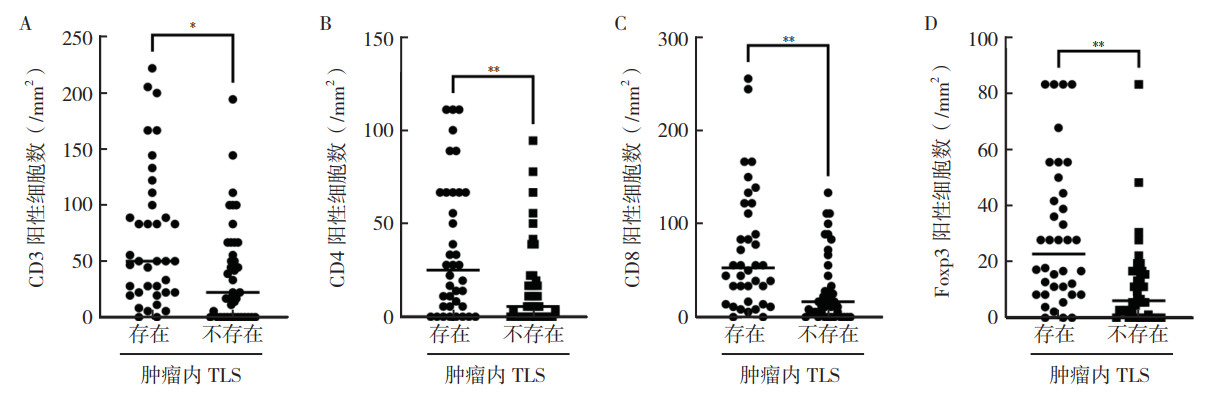
|
| 注A:存在和不存在肿瘤内TLS组CD3+ T淋巴细胞数比较;B:存在和不存在肿瘤内TLS组CD4+ T淋巴细胞数比较;C:存在和不存在肿瘤内TLS组CD8+ T淋巴细胞数比较;D:存在和不存在肿瘤内TLS组Foxp3+ Treg细胞数比较;*P < 0.05;**P < 0.01 图 4 黑色素瘤患者肿瘤内三级淋巴结构与肿瘤免疫微环境的关系 Fig.4 Relationship between the intratumoral tertiary lymphoid structures and the tumor immune microenvironment in melanoma patients |
TLS有别于二级淋巴器官(secondary lymphoid organ, SLO),在生理条件下不存在,而是在慢性炎性反应环境中形成,如自身免疫疾病、异体移植排斥、慢性炎性反应与肿瘤等。目前,TLS已在多种实体肿瘤中被发现,包括乳腺癌[5]、非小细胞肺癌[6]、结直肠癌[7]、胰腺癌[8]与黑色素瘤[9]等。经研究发现,TLS主要由B细胞、T细胞、树突状细胞和少量巨噬细胞组成。其中,CD20+ B细胞位于结构内部区域,CD3+ T细胞位于结构外周区域[10]。CD3+ T细胞主要包含CD4+ T滤泡辅助细胞、少量CD8+细胞毒性T细胞、CD4+ T辅助细胞与调节性T细胞。树突状细胞起源于间充质,后形成不同类型亚群,包括CD21+滤泡树突细胞。
为了更好地研究TLS与肿瘤预后间的关系,可根据其细胞组成定义成熟度,分为早期TLS、初级淋巴滤泡样TLS和次级淋巴滤泡样TLS。高成熟度TLS能有效激活和扩增肿瘤特异性T细胞,促进B细胞产生高亲和力抗体,诱导记忆性免疫。相比早期、初级淋巴滤泡样TLS,肝细胞癌与结直肠癌患者存在次级淋巴滤泡样TLS复发风险更低[7, 11]。进一步简化评估方案,可根据TLS所在肿瘤内空间位置,分为肿瘤内TLS、肿瘤边缘TLS与间质区TLS。肝细胞癌中,肿瘤边缘TLS与更高的肿瘤复发风险和更差的预后相关[11]。研究发现,转移性黑色素瘤组织样本中存在肿瘤内TLS与良好的预后相关[9]。本研究发现,中国黑色素瘤患者原发灶中肿瘤内TLS为判断患者预后的独立危险因素,证明肿瘤内TLS有较好的肿瘤预后判别能力。
越来越多的研究表明,TLS可以促进抗肿瘤适应性免疫反应的产生或增强[12-13]。TLS中B细胞可通过产生肿瘤相关抗体,发挥标记抗原表达细胞的吞噬、补体介导的裂解或抗体依赖的细胞毒性作用。同时,TLS在解剖上与SLO有相似性,但是周围缺乏包膜,可能促使TLS中免疫细胞暴露在肿瘤微环境中发挥作用。在黑色素瘤小鼠模型中,TLS可诱导肿瘤特异性T细胞反应,促进免疫细胞浸润,导致肿瘤退缩[14]。本研究也发现,黑色素瘤患者原发灶内TLS的存在提示CD4+ T细胞、CD8+ T细胞与调节性T细胞浸润增多。目前,靶向诱导或增强TLS功能的临床应用研究已逐步开展,有助于发掘TLS作为肿瘤治疗靶点的潜在价值。
总体而言,虽然TLS已在多个癌种中被证实与患者预后和免疫治疗反应相关,但我国黑色素瘤中此类研究仍较少,同时其形成机制及其在肿瘤微环境中的作用仍不明确。本研究证实,我国黑色素瘤患者肿瘤原发灶中TLS的存在提示较好的预后和TIME中更显著的免疫细胞浸润,但仍需进一步扩大样本并深入探索TLS在黑色素瘤中的作用与机制。
| [1] |
Schadendorf D, van Akkooi ACJ, Berking C, et al. Melanoma[J]. Lancet, 2018, 392(10151): 971-984. DOI:10.1016/S0140-6736(18)31559-9 |
| [2] |
田惠春, 张佳冉, 斯璐. 2023年CSCO黑色素瘤诊疗指南更新要点解读[J]. 实用肿瘤杂志, 2023, 38(6): 509-512. |
| [3] |
Carlino MS, Larkin J, Long GV. Immune checkpoint inhibitors in melanoma[J]. Lancet, 2021, 398(10304): 1002-1014. DOI:10.1016/S0140-6736(21)01206-X |
| [4] |
Schumacher TN, Thommen DS. Tertiary lymphoid structures in cancer[J]. Science, 2022, 375(6576): eabf9419. DOI:10.1126/science.abf9419 |
| [5] |
黄东东, 邬万新, 陈彩萍, 等. 乳腺导管原位癌三级淋巴结构的临床病理特征分析及其与肿瘤进展的关系[J]. 临床与实验病理学杂志, 2022, 38(6): 738-741, 745. |
| [6] |
翟今朝, 卯云烨, 李金凤, 等. 肺鳞癌三级淋巴结构特征及其对预后的影响[J]. 解放军医学院学报, 2023, 44(7): 725-732, 749. |
| [7] |
Wang Q, Zhong W, Shen X, et al. Tertiary lymphoid structures predict survival and response to neoadjuvant therapy in locally advanced rectal cancer[J]. NPJ Precis Oncol, 2024, 8(1): 61. DOI:10.1038/s41698-024-00533-w |
| [8] |
Zou X, Lin X, Cheng H, et al. Characterization of intratumoral tertiary lymphoid structures in pancreatic ductal adenocarcinoma: cellular properties and prognostic significance[J]. J Immunother Cancer, 2023, 11(6): e006698. DOI:10.1136/jitc-2023-006698 |
| [9] |
Cabrita R, Lauss M, Sanna A, et al. Tertiary lymphoid structures improve immunotherapy and survival in melanoma[J]. Nature, 2020, 577(7791): 561-565. DOI:10.1038/s41586-019-1914-8 |
| [10] |
Sautès-Fridman C, Lawand M, Giraldo NA, et al. Tertiary lymphoid structures in cancers: prognostic value, regulation, and manipulation for therapeutic intervention[J]. Front Immunol, 2016, 7: 407. |
| [11] |
Calderaro J, Petitprez F, Becht E, et al. Intra-tumoral tertiary lymphoid structures are associated with a low risk of early recurrence of hepatocellular carcinoma[J]. J Hepatol, 2019, 70(1): 58-65. DOI:10.1016/j.jhep.2018.09.003 |
| [12] |
崔雪, 翁一鸣, 王培伟, 等. 三级淋巴结构在肿瘤患者预后及免疫治疗中的价值[J]. 实用肿瘤杂志, 2023, 38(2): 190-195. |
| [13] |
Teillaud JL, Houel A, Panouillot M, et al. Tertiary lymphoid structures in anticancer immunity[J]. Nat Rev Cancer, 2024, 24(9): 629-646. |
| [14] |
Schrama D, Voigt H, Eggert AO, et al. Immunological tumor destruction in a murine melanoma model by targeted LTalpha independent of secondary lymphoid tissue[J]. Cancer Immunol Immunother, 2008, 57(1): 85-95. |
 2024, Vol. 39
2024, Vol. 39


