文章信息
- 左世凯, 王武亮, 王利君, 王璐, 郭依琳, 凡志祥, 刘琳洁
- Zuo Shikai, Wang Wuliang, Wang Lijun, Wang Lu, Guo Yilin, Fan Zhixiang, Liu Linjie
- 子宫内膜癌组织中stratifin表达与临床病理特征和预后的关系
- Expression of stratifin in endometrial cancer and its relationship with clinicopathological features and prognosis
- 实用肿瘤杂志, 2024, 39(4): 362-367
- Journal of Practical Oncology, 2024, 39(4): 362-367
基金项目
- 河南省科技攻关项目(222102310618)
-
通信作者
- 王武亮, E-mail: wangwuliang888@sina.com
-
文章历史
- 收稿日期:2022-11-13
子宫内膜癌在全球女性恶性肿瘤中发病率高居第6位,全球每年约有76 000例女性患者死于子宫内膜癌;我国2020年新发子宫内膜癌81 964例,死亡16 607例[1-3]。子宫内膜癌的死亡率和新诊断例数的增加使其成为影响妇女健康的一个重要因素。患者临床病理特征和预后情况是目前子宫内膜癌分类的基石,但传统分型难以满足临床要求,尤其在指导个体化精准治疗方面价值有限。近年来,癌症基因组图谱(The Cancer Genome Atlas, TCGA)多组学研究全面揭示子宫内膜癌的分子遗传图谱,提出新的分子分型策略:依据多组学特征和预后的关联性分为聚合酶-ε(polymerase epsilon, POLE)、微卫星不稳定(microsatellite instability, MSI)、高拷贝型(copy-number high, CNH)和低拷贝型(copy-number low, CHL)4个亚型用于患者预后和复发风险评估[4]。由于该方法对标本和平台要求高、操作困难且价格昂贵[5],到目前为止还没有在临床上得到广泛应用。
Stratifin(SFN,又称为14-3-3σ)蛋白是高度保守的可溶性酸性蛋白14-3-3蛋白家族成员之一,能够调控细胞多种重要的生命活动[6]。SFN主要在头颈肿瘤、肺癌、食管鳞癌和乳腺癌等领域研究较多[7-9],但在妇科恶性肿瘤方面研究较少。目前鲜有SFN在子宫内膜癌中的研究。本研究通过生信分析进行数据挖掘发现,SFN在子宫内膜癌组织中高表达,利用免疫组织化学法检测SFN在子宫内膜癌组织中的表达水平分析其与临床病理特征和预后的关系以探索其判断预后和指导治疗的潜在价值。
1 资料与方法 1.1 TCGA数据库获取SFN数据集通过TCGA数据库(https://cancergenome.nih.gov/)下载SFN表达数据集(采集数据截止时间为2022年3月4日),比较554例子宫内膜癌组织和23例正常子宫内膜组织中SFN的表达水平。554例子宫内膜癌患者年龄31~90岁,中位年龄60岁。分析子宫内膜癌患者不同SFN表达水平与临床病理特征和预后的关系。
1.2 一般资料收集2017年1月至2019年12月因子宫内膜癌就诊于郑州大学第二附属医院妇产科并行全面分期手术且符合纳入标准的患者96例。子宫内膜癌患者纳入标准:(1)临床资料完整;(2)术前无辅助治疗;(3)术后完成规范辅助治疗且随访资料完整。收集郑州大学第二附属医院同期因良性疾病行全子宫切除术且符合纳入标准的患者60例。良性疾病患者的纳入标准:(1)临床资料完整;(2)术后病理提示为良性病变;(3)术后病理提示子宫内膜为正常组织。60例正常子宫内膜组织来源的患者年龄38~67岁,中位年龄48岁。96例子宫内膜癌患者年龄34~77岁,中位年龄54岁。子宫内膜癌患者的临床病理特征包括组织学分级、手术病理学分期、年龄、脉管浸润、盆/腹腔淋巴结转移、术前糖类抗原125(carbohydrate antigen 125, CA125)水平和腹腔冲洗细胞学等。手术病理学分期和组织学分级采用2009年国际妇产科联盟(The International Federation of Gynecology and Obstetrics, FIGO)标准执行。本院对子宫内膜癌的主要手术方式为子宫内膜癌分期手术,包括全子宫切除术、输卵管卵巢切除术、盆腔和(或)腹主动脉旁淋巴结切除术以及腹腔冲洗细胞学检查。本研究已通过郑州大学第二附属医院医学伦理委员会伦理审查(伦审批件号:2022019)。
1.3 随访对所有子宫内膜癌患者进行随访。随访形式包括门诊复查和电话回访等。术后第1天为随访开始时间,每隔3个月进行1次随访。患者出现复发、死亡或随访时间截止则随访结束。最后1次随访时间为2021年12月。随访时间13~58个月,中位随访时间35个月。
1.4 免疫组织化学检测SFN抗体购自武汉三鹰生物公司,按1∶2 000稀释,采用SP法进行免疫组织化学染色。免疫组织化学结果判读:SFN阳性染色以细胞质中出现棕黄色或棕褐色均质颗粒物质为准。根据光学显微镜下阳性细胞所占百分比进行分类:阳性细胞表达数 > 50%为强阳性(+++),26%~50%为中度阳性(++),6%~25%为弱阳性(+),≤5%为阴性(-);中度阳性和强阳性定义为高表达,阴性和弱阳性为低表达。
1.5 统计学分析应用SPSS 26.0软件进行统计学分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制不同SFN表达水平的患者的无瘤生存(disease-free survival, DFS)曲线和总生存(overall survival, OS)曲线。采用log-rank检验进行子宫内膜癌患者DFS和OS的单因素分析。采用Cox比例风险模型进行影响子宫内膜癌患者DFS和OS的多因素分析。以P < 0.05为差异具有统计学意义。
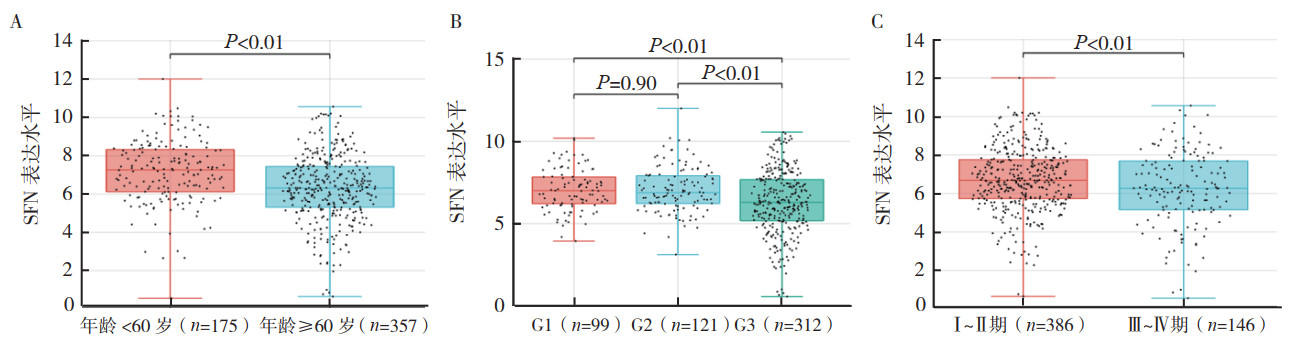
2 结果 2.1 TCGA数据库中子宫内膜癌组织的SFN表达水平TCGA数据库分析显示,554例子宫内膜癌组织中SFN表达水平高于23例正常子宫内膜组织(P < 0.01,图 1A)。根据最优阈值,将554例子宫内膜癌组织分为SFN高表达和低表达。采用Kaplan-Meier生存分析显示,子宫内膜癌组织中SFN低表达患者5年OS率低于高表达患者(P < 0.01,图 1B);5年DFS率比较,差异无统计学意义(P > 0.05,图 1C)。子宫内膜癌患者SFN表达水平在年龄、组织学分级和手术病理学分期方面比较,差异均具有统计学意义(均P < 0.01,图 2)。

|
| 注 A:子宫内膜癌组织中SFN表达水平高于正常子宫内膜组织;B:Kaplan-Meier法比较子宫内膜癌组织中SFN低表达和高表达患者的总生存曲线;C:Kaplan-Meier法比较子宫内膜癌组织中SFN低表达和高表达患者的无瘤生存曲线;SFN:stratifin 图 1 TCGA数据库中子宫内膜癌组织与正常子宫内膜组织中SFN表达水平比较及其与子宫内膜癌患者无瘤生存期和总生存期的关系 Fig.1 Comparison of SFN levels in endometrial cancer and normal endometrial tissues and the effect of SFN expression on the disease-free survival and overall survival of endometrial cancer patients based on TCGA database |
|
| 注 A:< 60岁和≥60岁子宫内膜癌患者SFN表达水平比较;B:组织学分级为G1、G2和G3的子宫内膜癌患者SFN表达水平比较;C:手术病理学分期为Ⅰ~Ⅱ期和Ⅲ~Ⅳ期的子宫内膜癌患者SFN表达水平比较;SFN:stratifin 图 2 TCGA数据库中子宫内膜癌组织中SFN表达水平与患者临床病理特征的关系 Fig.2 Relationship between the SFN expression and clinicopathological features of patients with endometrial cancer in TCGA database |
免疫组织化学检测显示,SFN在子宫内膜癌组织和正常子宫内膜组织中的表达位于细胞质中,呈棕褐色(图 3)。96例子宫内膜癌组织中SFN阳性表达率为93.8%(90/96),其中高表达率为81.3%(78/96)。60例正常子宫内膜组织中SFN阳性表达率为23.3%(14/60)。子宫内膜癌组织中SFN表达水平高于正常子宫内膜组织,差异具有统计学意义(χ2=82.380,P < 0.01)。

|
| 注 A:SFN在增殖期正常子宫内膜组织中弱表达(箭头示);B:SFN在子宫内膜癌组织中未表达;C:SFN在子宫内膜癌组织中强表达(箭头示),免疫反应阳性细胞位于癌细胞细胞质中 图 3 子宫内膜癌组织和正常子宫内膜组织中SFN表达的免疫组织化学检查结果(SP×400) Fig.3 Immunohistochemical results of SFN expression in endometrial cancer and normal endometrial tissues (SP×400) |
96例子宫内膜癌组织中,78例SFN高表达患者和18例低表达患者临床病理特征比较,仅在手术病理学分期方面差异具有统计学意义(P=0.002,表 1)。
| 临床病理特征 | 总例数 | SFN高表达 | SFN低表达 | χ2值 | P值 |
| 组织学分级 | 1.186 | 0.553 | |||
| 低分化 | 42 | 34(81.0) | 8(19.0) | ||
| 中分化 | 40 | 34(85.0) | 6(15.0) | ||
| 高分化 | 14 | 10(71.5) | 4(28.5) | ||
| 手术病理学分期 | 9.629 | 0.002 | |||
| Ⅰ~Ⅱ期 | 86 | 74(87.0) | 12(13.0) | ||
| Ⅲ~Ⅳ期 | 10 | 4(40.0) | 6(60.0) | ||
| 年龄 | 2.081 | 0.149 | |||
| ≤54岁 | 54 | 46(85.2) | 8(14.8) | ||
| > 54岁 | 42 | 32(76.2) | 10(23.8) | ||
| 脉管浸润 | 0.009 | 0.926 | |||
| 阳性 | 14 | 12(85.7) | 2(14.3) | ||
| 阴性 | 82 | 66(80.5) | 16(19.5) | ||
| 盆/腹腔淋巴结 | 1.164 | 0.685 | |||
| 阳性 | 6 | 4(66.7) | 2(33.3) | ||
| 阴性 | 90 | 74(82.2) | 16(17.8) | ||
| 术前CA125水平 | 1.270 | 0.260 | |||
| < 35 U/mL | 76 | 64(84.2) | 12(15.8) | ||
| ≥35 U/mL | 20 | 14(70.0) | 6(30.0) | ||
| 腹腔冲洗细胞学 | 0.977 | 0.323 | |||
| 阳性 | 12 | 8(66.7) | 4(33.3) | ||
| 阴性 | 84 | 70(83.3) | 14(16.7) | ||
| 注 SFN:stratifin;CA125:糖类抗原125(carbohydrate antigen 125) | |||||
96例子宫内膜癌患者中,随访期间复发14例,死亡10例。其中,复发的14例患者中6例(42.9%)SFN低表达,而同期随访的82例无瘤生存的患者中仅12例(14.6%)SFN低表达。死亡的10例患者中6例(60.0%)SFN低表达,而同期生存的86例患者中仅12例(14.0%)SFN低表达。SFN低表达患者术后平均DFS和平均OS均短于SFN高表达患者(均P < 0.05,图 4)。

|
| 注 A:96例子宫内膜癌患者SFN表达水平与无瘤生存期的关系;B:96例子宫内膜癌患者SFN表达水平与总生存期的关系;SFN:stratifin 图 4 96例子宫内膜癌患者SFN表达水平与无瘤生存期和总生存期的关系 Fig.4 Relationship between the SFN expression and the disease-free survival and overall survival of 96 endometrial cancer patients |
单因素分析显示,患者DFS在SFN表达水平、组织学分级、手术病理学分期和盆/腹腔淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05);OS在SFN表达水平、组织学分级和手术病理学分期方面比较,差异均具有统计学意义(均P < 0.05,表 2)。Cox比例风险模型多因素分析显示,组织学分级(HR=9.121,95% CI:2.028~41.020,P=0.004)与手术病理学分期(HR=25.206,95% CI:3.027~209.892,P=0.003)是影响患者DFS的危险因素(表 3);组织学分级(HR=16.265,95% CI:1.611~164.170,P=0.018)与SFN表达水平(HR=0.042,95% CI:0.001~1.164,P=0.041)是影响患者OS的危险因素。
| 临床病理特征 | 无瘤生存期 | 总生存期 | |||
| χ2值 | P值 | χ2值 | P值 | ||
| SFN表达水平 | 4.115 | 0.043 | 7.599 | 0.006 | |
| 组织学分级 | 15.823 | < 0.01 | 7.163 | 0.010 | |
| 手术病理学分期 | 24.511 | < 0.01 | 14.287 | 0.004 | |
| 年龄 | 0.598 | 0.439 | 0.016 | 0.900 | |
| 脉管浸润 | 1.550 | 0.213 | 2.528 | 0.112 | |
| 盆/腹腔淋巴结 | 7.203 | 0.007 | 1.597 | 0.206 | |
| 术前CA125水平 | 0.304 | 0.582 | 1.163 | 0.281 | |
| 腹腔冲洗细胞学 | 1.111 | 0.292 | 0.722 | 0.396 | |
| 注 SFN:stratifin;CA125:糖类抗原125(carbohydrate antigen 125) | |||||
| 临床病理特征 | 无瘤生存期 | 总生存期 | |||||||
| B | HR | 95% CI | P值 | B | HR | 95% CI | P值 | ||
| SFN表达水平 | -1.351 | 0.259 | 0.028~2.438 | 0.238 | -3.178 | 0.042 | 0.001~1.164 | 0.041 | |
| 组织学分级 | 2.211 | 9.121 | 2.028~41.020 | 0.004 | 2.789 | 16.265 | 1.611~164.170 | 0.018 | |
| 手术病理学分期 | 3.227 | 25.206 | 3.027~209.892 | 0.003 | 2.524 | 12.478 | 0.833~186.994 | 0.068 | |
| 注 SFN:stratifin | |||||||||
迄今为止,在人体组织中已经鉴定出7种不同的14-3-3亚型。SFN是该家族的成员之一。SFN在DNA损伤后维持上皮细胞的G2/M期方面发挥重要作用。作为对DNA损伤的反应,SFN以p53依赖的方式被诱导,并阻止cdc2/cyclin B1复合体进入细胞核。SFN表达缺失会导致体外恶性转化,并支持体内肿瘤的形成,表明SFN基因具有抑瘤作用[10]。SFN表达下调在鼻咽癌中可能导致癌细胞出现恶性程度加重的表型。SFN在食管鳞癌中是预后的独立影响因素之一[11]。SFN表达可能与子宫颈癌的恶性程度有关[12]。
随着生物信息学技术的不断发展,为深入了解子宫内膜癌发生和发展的分子机制以及筛选出可作为子宫内膜癌诊断的关键基因和药物治疗的靶点提供了方便。本研究对96例子宫内膜癌组织和60例正常子宫内膜组织进行免疫组织化学检测显示,SFN在子宫内膜癌组织中的表达水平高于正常子宫内膜组织,与TCGA数据库中的分析结果一致。但免疫组织化学检查结果显示,SFN在子宫内膜癌组织中的表达水平仅在手术病理学分期方面比较,差异具有统计学意义(P < 0.05),与组织学分级、年龄、脉管浸润、盆/腹腔淋巴结转移、术前CA125水平和腹腔冲洗细胞学等病理特征无关,与TCGA数据库中的分析结果不同,考虑可能与本研究所收集病例数较少有关。另外,Kaplan-Meier生存分析结果显示,SFN低表达患者平均DFS和OS均低于高表达患者,与TCGA数据库分析结果较为相符。多因素分析表明,组织学分级与SFN表达水平均是影响患者OS的危险因素(均P < 0.05),提示SFN在子宫内膜癌中的表达水平可能是影响患者预后的重要因素之一。
自2013年癌症TCGA数据库公布以来,临床医师在将分子检测纳入常规临床组织学诊断方面进行了深入研究[13]。尽管目前还没有就进行哪种检测达成共识,但错配修复和POLE等分子检测在靶向治疗方面有很大潜力。这些分子检测不仅推动个体化治疗,同时还将作为预后和开发早期检测方法的重要手段[14]。接下来几年里,对子宫内膜癌起源、复发和耐药的分子模式的全面了解可能会实现,分子分型将成为分子亚群定向辅助治疗和探索新的更个性化的靶向治疗的基础,这将带来基于分子分型的诊断和治疗方法的新纪元[15],未来也将会有新的分子和作用靶点补充其中。
综上所述,本研究中SFN在子宫内膜癌组织中的表达水平高于正常子宫内膜组织;免疫组织化学检查显示,SFN在子宫内膜癌组织中的表达水平仅与患者手术病理学分期有关,考虑受样本量的影响,需进一步大样本研究的验证。本研究中子宫内膜癌组织中SFN低表达的患者死亡风险增高,提示SFN的差异表达可能在指导子宫内膜癌患者术后辅助治疗和判断预后方面具有潜在价值。
| [1] |
Doherty MT, Sanni OB, Coleman HG, et al. Concurrent and future risk of endometrial cancer in women with endometrial hyperplasia: a systematic review and meta-analysis[J]. PLoS One, 2020, 15(4): e0232231. DOI:10.1371/journal.pone.0232231 |
| [2] |
Urick ME, Bell DW. Clinical actionability of molecular targets in endometrial cancer[J]. Nat Rev Cancer, 2019, 19(9): 510-521. DOI:10.1038/s41568-019-0177-x |
| [3] |
Sun PS, Shen Y, Wang T, et al. Distinct clinical and genetic mutation characteristics in sporadic and Lynch syndrome-associated endometrial cancer in a Chinese population[J]. Cancer Epidemiol, 2021, 73: 101934. DOI:10.1016/j.canep.2021.101934 |
| [4] |
Vermij L, Smit V, Nout R, et al. Incorporation of molecular characteristics into endometrial cancer management[J]. Histopathology, 2020, 76(1): 52-63. DOI:10.1111/his.14015 |
| [5] |
乐露露, 傅芬. MYBL2基因表达和拷贝数变异与子宫内膜癌患者预后的关系[J]. 实用肿瘤杂志, 2023, 38(3): 258-264. DOI:10.13267/j.cnki.syzlzz.2023.040 |
| [6] |
Huang Y, Yang MX, Huang WG. 14-3-3σ: a potential biomolecule for cancer therapy[J]. Clin Chim Acta, 2020, 511: 50-58. DOI:10.1016/j.cca.2020.09.009 |
| [7] |
程爱兰, 唐运莲, 黄卫国. 14-3-3σ蛋白表达下降在鼻咽癌发病中的意义[J]. 临床和实验医学杂志, 2011, 10(2): 90-92. |
| [8] |
Shiba-Ishii A, Kano J, Morishita Y, et al. High expression of stratifin is a universal abnormality during the course of malignant progression of early-stage lung adenocarcinoma[J]. Int J Cancer, 2011, 129(10): 2445-2453. DOI:10.1002/ijc.25907 |
| [9] |
王明. 14-3-3σ在癌前病变及食管鳞癌中表达的临床意义及与预后的相关性[D]. 开封: 河南大学, 2014.
|
| [10] |
Diallo K, Oppong AK, Lim GE. Can 14-3-3 proteins serve as therapeutic targets for the treatment of metabolic diseases?[J]. Pharmacol Res, 2019, 139: 199-206. DOI:10.1016/j.phrs.2018.11.021 |
| [11] |
魏华, 王明, 刘瑞敏, 等. 食管鳞癌中14-3-3σ表达的临床意义及与预后的相关性[J]. 基础医学与临床, 2014, 34(8): 1044-1048. |
| [12] |
牛珂, 鲁永鲜. 宫颈癌组织14-3-3σ蛋白表达及其临床意义[J]. 中华肿瘤防治杂志, 2009, 16(6): 434-435, 465. |
| [13] |
张喆琳, 廖予妹. 子宫内膜癌中MMR、p53、ER和PR表达与病理特征的关系及预后分析[J]. 实用肿瘤杂志, 2023, 38(6): 543-549. DOI:10.13267/j.cnki.syzlzz.2023.086 |
| [14] |
Yen TT, Wang TL, Fader AN, et al. Molecular classification and emerging targeted therapy in endometrial cancer[J]. Int J Gynecol Pathol, 2020, 39(1): 26-35. |
| [15] |
van den Heerik ASVM, Horeweg N, de Boer SM, et al. Adjuvant therapy for endometrial cancer in the era of molecular classification: radiotherapy, chemoradiation and novel targets for therapy[J]. Int J Gynecol Cancer, 2021, 31(4): 594-604. |
 2024, Vol. 39
2024, Vol. 39


