文章信息
- 夏添明, 李朝辉, 王云帅, 王皇建, 刘大威, 武会斌, 韩保卫
- Xia Tianming, Li Zhaohui, Wang Yunshuai, Wang Huangjian, Liu Dawei, Wu Huibin, Han Baowei
- miR-1273g-3p调控TGF-β/Smad4信号通路影响结直肠癌细胞的增殖、迁移和侵袭
- miR-1273g-3p affects proliferation, migration and invasion of colorectal cancer cells by regulating TGF-β/Smad4 signaling pathway
- 实用肿瘤杂志, 2024, 39(3): 219-227
- Journal of Practical Oncology, 2024, 39(3): 219-227
基金项目
- 河南省医学科技攻关计划(联合共建项目)(LHGJ20210866,2018020898)
-
通信作者
- 韩保卫,E-mail:ly_hbw123@126.com
-
文章历史
- 收稿日期:2022-07-15
结直肠癌是威胁人类生命健康的主要癌症之一,造成严重的社会负担。结直肠癌的发生、发展、转移和复发是多基因和多细胞分子途径参与的过程[1]。揭示其潜在的分子途径及机制可为临床提供新的治疗靶点,对改善结直肠癌患者的预后至关重要。越来越多的研究表明,miRNA的失调在结直肠癌的发生和发展中起作用[2-3]。研究显示,microRNA-490-3p通过靶向调控端锚聚合酶2(tankyrase 2,TNKS2)抑制结直肠癌细胞的迁移和抗药性[4]。microRNA-142-3p通过Ras相关的C3肉毒素底物1-细胞外信号调节蛋白激酶1/2(Ras-related C3 botulinum toxin substrate 1-extracellular regulated protein kinases 1/2,RAC1-ERK1/2)信号通路抑制结直肠癌中的细胞增殖、侵袭和上皮间充质转化[5]。miR-34a通过靶向自噬相关基因7(autophagy associated gene 7,ATG7)抑制结直肠癌细胞自噬和增殖[6]。已有研究表明,miR-1273g-3p在肺癌、卵巢癌和胰腺癌等肿瘤的发生和发展中发挥重要作用,在结直肠癌中的具体作用及机制有待进一步研究[7-8]。转化生长因子β(transforming growth factor-β,TGF-β)/mothers against decapentaplegic homolog(Smad)信号通路是结直肠癌发生和发展的重要信号分子通路[9]。TGF-β和Smad4基因可通过调节血浆纤溶酶原激活抑制剂-1(plasminogen activator inhibitor-1,PAI-1)和E-cadherin的表达抑制结直肠癌的转移。TGF-β1的表达随结直肠癌分化程度的降低、浸润深度的增加和淋巴结的转移而降低。联合检测Smad4和TGF-β1的表达对了解结直肠癌的浸润和转移具有重要意义。研究显示,miR-4666-3p和miR-329可靶向调控TGF-β/Smad信号通路抑制结直肠癌干细胞[10]。螺旋酶样转录因子(helicase-like transcription factor,HLTF)通过TGF-β/SMAD信号传导在体外抑制结直肠癌细胞的迁移和侵袭[11]。然而还有许多疑问尚待阐明,特别是miR-1273g-3p与TGF-β/Smad信号通路在结直肠癌发生和发展中的作用之间的相关性目前尚不清楚。本研究旨在探讨miR-1273g-3p与TGF-β/Smad信号通路对结直肠癌的作用之间的相关性,为结直肠癌的防治提供新的实验证据。
1 材料与方法 1.1 细胞及动物人结直肠癌细胞株HCT116和SW480以及人结肠上皮细胞株NCM460由中国科学院上海细胞生物学研究所提供。SPF级雌性BALB/c裸鼠8只(周龄4~5周,体质量18~20 g)购自浙江维通利华实验动物技术有限公司(嘉兴)[许可证号:SCXK(浙)2019-0001],并获得洛阳市中心医院动物伦理委员会批准。
1.2 试剂耗材RPMI-1640不完全培养液、L15不完全培养液和胎牛血清(fetal bovine serum,FBS)购自Sigma-Aldrich(上海)贸易有限公司。LipofectamineTM 2000转染试剂和Opti-MEMTM培养液购自北京赛默飞世尔科技(中国)有限公司。TRIzol总RNA提取试剂盒购自天根生化科技(北京)有限公司。miR-1273g-3p抑制剂及抑制剂对照剂购自上海吉玛制药技术有限公司。miR-1273g-3p引物、TGF-β引物、Smad4引物和U6内参引物购自天根生化科技(北京)有限公司。聚合酶链反应(polymerase chain reaction,PCR)相关试剂和反转录(reverse transcription,RT)试剂盒购自天根生化科技(北京)有限公司。细胞增殖和细胞毒性分析(Cell Counting Kit-8,CCK-8)试剂购自日本同仁化学研究所。TGF-β兔多克隆抗体、Smad4兔单克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG、Plus PAGE预制胶(Tris-Gly,10%,10孔)、BeyoECL Plus超敏增强化学发光(enhanced chemiluminescence,ECL)试剂盒、RIPA裂解缓冲液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×,无气味)、PVDF膜(进口分装,6.6 cm×8.5 cm,0.45 μm)和BeyoColorTM彩色预染蛋白相对分子质量标准(15 000~120 000)购自上海碧云天生物科技有限公司。质粒小量制备试剂盒购自爱思进生物技术(杭州)有限公司。双荧光素酶检测试剂盒购自普洛麦格(北京)生物技术有限公司。
1.3 实验分组对HCT116和SW480细胞,均根据LipofectamineTM 2000说明书,将miR-1273g-3p抑制剂和抑制剂对照剂分别瞬时转染细胞,在37℃、5%CO2且饱和湿度条件下继续培养,获得miR-1273g-3p低表达的结直肠癌细胞(miR-1273g-3p抑制剂组)及其对照(抑制剂对照组)。
1.4 qRT-PCR检测转染前后细胞中miR-1273g-3p、TGF-β和Smad4等的表达水平根据TRIzol试剂说明书提取细胞总RNA,根据miRcute增强型miRNA cDNA第一链合成试剂盒和FastKing一步法除基因组cDNA第一链合成预混试剂说明书分别反转录获得cDNA。根据miRcute增强型miRNA荧光定量检测试剂盒和SuperReal荧光定量预混试剂说明书进行PCR反应,检测HCT116和SW480细胞中miR-1273g-3p的转染效果,分别设置未作转染处理的HCT116和SW480细胞做空白对照(空白对照组),同时检测TGF-β和Smad4的表达。PCR反应均以U6为内参。引物序列见表 1。每个样品设3个复孔。实验结果采用2-ΔΔCt法分析。
| 基因 | 引物序列 | 片段长度(bp) |
| miR-1273g-3p | 5'-ACCACTGCACTCCAGCCTGAG-3' | 21 |
| TGF-β | F:5'-CTAATGGTGGAAACCCACAACG-3' | 22 |
| R:5'-TATCGCCAGGAATTGTTGCTG-3' | 21 | |
| Smad4 | F:5'-CTCATGTGATCTATGCCCGTC-3' | 21 |
| R:5'-AGGTGATACAACTCGTTCGTAGT-3' | 23 | |
| U6 | F:5'-GGTCGGGCAGGAAAGAGGGC-3' | 20 |
| R:5'-GCTAATCTTCTCTGTATCGTTCC -3 | 23 | |
| 注 TGF-β:转化生长因子β(transforming growth factor-β);F:上游引物(forward primer);R:下游引物(reversed primer);Smad4:mothers against decapentaplegic homolog 4 | ||
收集瞬时转染48 h后的结直肠癌细胞,用RIPA裂解缓冲液提取总蛋白。用BCA蛋白质测定试剂盒对各组蛋白质样品进行定量。每个样品蛋白(10 µg)通过SDS-PAGE分离,并转移到PVDF膜。5%脱脂牛奶封闭2 h,分别加入一抗TGF-β(1∶1 000)和Smad4(1∶1 000)在摇床上4℃过夜,用TBST洗涤3次(10 min/次),加入辣根过氧化物酶标记山羊抗兔IgG作为二抗在室温下孵育2 h,TBST洗涤3次后加入ECL显影,观察并记录免疫反应条带。通过ImageJ软件对免疫反应条带进行量化分析。
1.6 CCK8检测细胞增殖能力收集转染后处于对数期生长的各组细胞,调整细胞悬液浓度,铺板于96孔平底板使待测细胞密度为3×103个/孔,每组设置5个复孔,在37℃、5%CO2和饱和湿度条件下孵育,分别在0、24、48、72和96 h加入CCK8溶液10 μL,孵育3 h,用酶标仪在490 nm波长处测量并记录每孔的吸光度(absorbance,A)值,绘制增殖曲线。
1.7 划痕实验检测细胞迁移能力将HCT116和SW480细胞以每孔1.0×105个分别接种到含10%FBS的RPMI-1640(HCT116细胞)和L15不完全培养液(SW480细胞)的6孔板中,在37℃下培养24 h。根据Lipofectamine™ 2000说明书,用miR-1273g-3p抑制剂和抑制剂对照剂转染细胞。转染24 h后,用20 μL无菌移液器尖端小心地在细胞层上划出一条约0.4~0.5 mm宽的线状划痕,用PBS洗涤去除细胞碎片并分别用新鲜的无FBS的RPMI-1640(HCT116细胞)和L15不完全培养液(SW480细胞)继续培养。然后在划痕后0、24、48和72 h对划痕进行拍照。通过ImageJ软件分析划痕愈合率。
1.8 Transwell实验检测细胞侵袭能力将60 μL(1∶8)稀释好的Matrigel胶预铺于transwell小室上室内,37℃静置4 h成胶。将转染48 h后的HCT116和SW480细胞分别用新鲜的无FBS的RPMI-1640(HCT116细胞)和L15不完全培养液(SW480细胞)重悬以5×104个/孔接种到transwell上室,下室分别加入含15%FBS的RPMI-1640(HCT116细胞)和L15不完全培养液(SW480细胞),在37℃、5%CO2和饱和湿度条件下培养48 h。取出小室,PBS漂洗3次,甲醇固定,结晶紫染色,用棉签将上层小室内细胞轻轻擦拭干净,PBS漂洗3次后于显微镜下拍照计数。
1.9 双荧光素酶报告基因实验检测细胞中荧光素酶活性变化采用BiBiServ(https://bibiserv.cebitec.uni-bielefeld.de/index.html)及TargetScan(https://www.targetscan.org/vert_80/)网站预测miR-1273g-3p与TGF-β的相关性。根据质粒小量制备试剂盒说明书构建质粒载体,将TGF-β 3’-untranslated region(UTR)的miR-1273g-3p识别序列构建成野生型(wild type,WT)和突变型(mutant,MUT)片段,并克隆到质粒载体中,分别命名为TGF-β-WT质粒和TGF-β-MUT质粒。将SW480细胞按照细胞密度6×104个/孔接种到24孔板中,用含10%FBS的L15不完全培养液培养24 h后,通过LipofectamineTM 2000将SW480细胞分别与TGF-β-WT质粒和TGF-β-MUT质粒共转染。用未转染任何miRNA的质粒作为miRNA阴性对照(miRNA-negative control,miR-NC)。在37℃、5%CO2孵育箱中继续培养细胞24 h后,裂解细胞,根据双荧光素酶检测试剂盒说明书测量荧光素酶活性。将萤火虫荧光素酶活性标准化为海肾荧光素酶活性。
1.10 裸鼠皮下成瘤实验收集转染后处于对数期生长的HCT116细胞,重悬获得单细胞悬液(2×106个/mL)。裸鼠分为miR-1273g-3p抑制剂组(n=4)和抑制剂对照组(n=4),将对应各组单细胞悬液分别皮下注射至裸鼠体内。监测瘤体生长,体积=(长径×短径2)/2,每3天记录1次。24 d后,无菌剥离瘤体,称重,绘制生长曲线。
1.11 统计学分析采用SPSS 25.0统计学软件进行数据分析。采用GraphPad Prism 9.0.0软件作图。计量资料采用均数±标准差(x ± s)表示,组间比较采用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 miR-1273g-3p在HCT116和SW480细胞中高表达qRT-PCR结果显示,与人结肠上皮细胞NCM460比较,人结直肠癌细胞HCT116和SW480中miR-1273g-3p的表达水平均较高(均P < 0.01,图 1)。
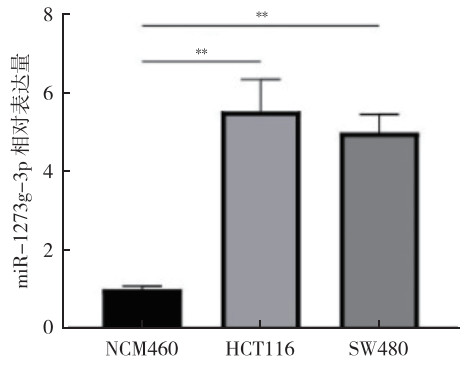
|
| **P < 0.01 图 1 人结直肠癌细胞HCT116和SW480及人结肠上皮细胞NCM460中miR-1273g-3p的表达水平 Fig.1 Expression of miR-1273g-3p in human colorectal cancer cells HCT116 and SW480 and human colon epithelial cells NCM460 |
Western blot实验显示,与人结肠上皮细胞NCM460比较,人结直肠癌细胞HCT116和SW480中TGF-β和Smad4蛋白均高表达(均P < 0.01,图 2)。
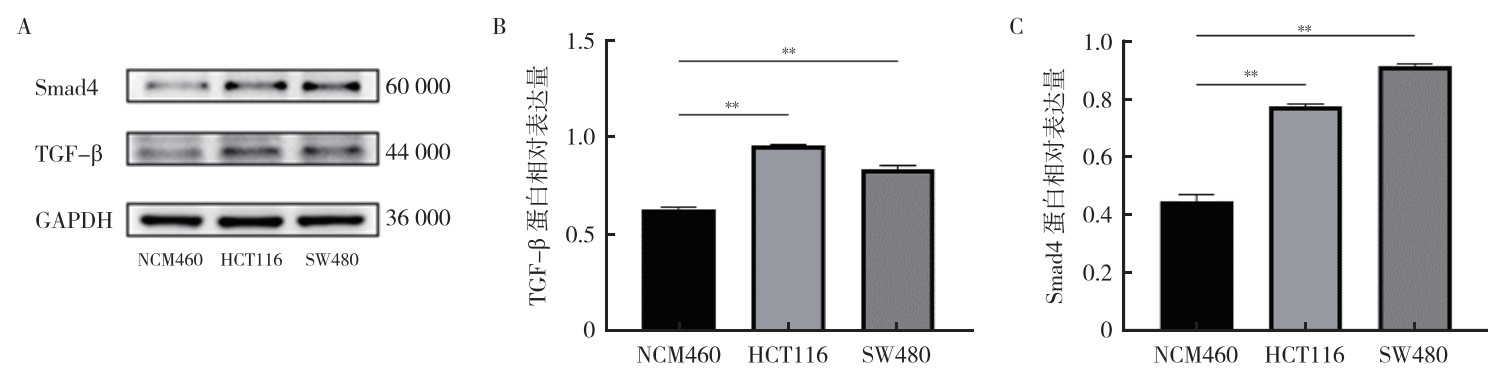
|
| 注 A:Western blot检测NCM460、HCT116和SW480细胞中TGF-β和Smad4蛋白表达;B:NCM460、HCT116和SW480细胞中TGF-β蛋白相对表达量;C:NCM460、HCT116和SW480细胞中Smad4蛋白相对表达量;Smad4:mothers against decapentaplegic homolog 4;TGF-β:转化生长因子β(transforming growth factor-β);GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);**P < 0.01 图 2 人结直肠癌细胞HCT116和SW480及人结肠上皮细胞NCM460中TGF-β和Smad4蛋白的表达情况 Fig.2 Expression of TGF-β and Smad4 proteins in human colorectal cancer cells HCT116 and SW480 and human colon epithelial cells NCM460 |
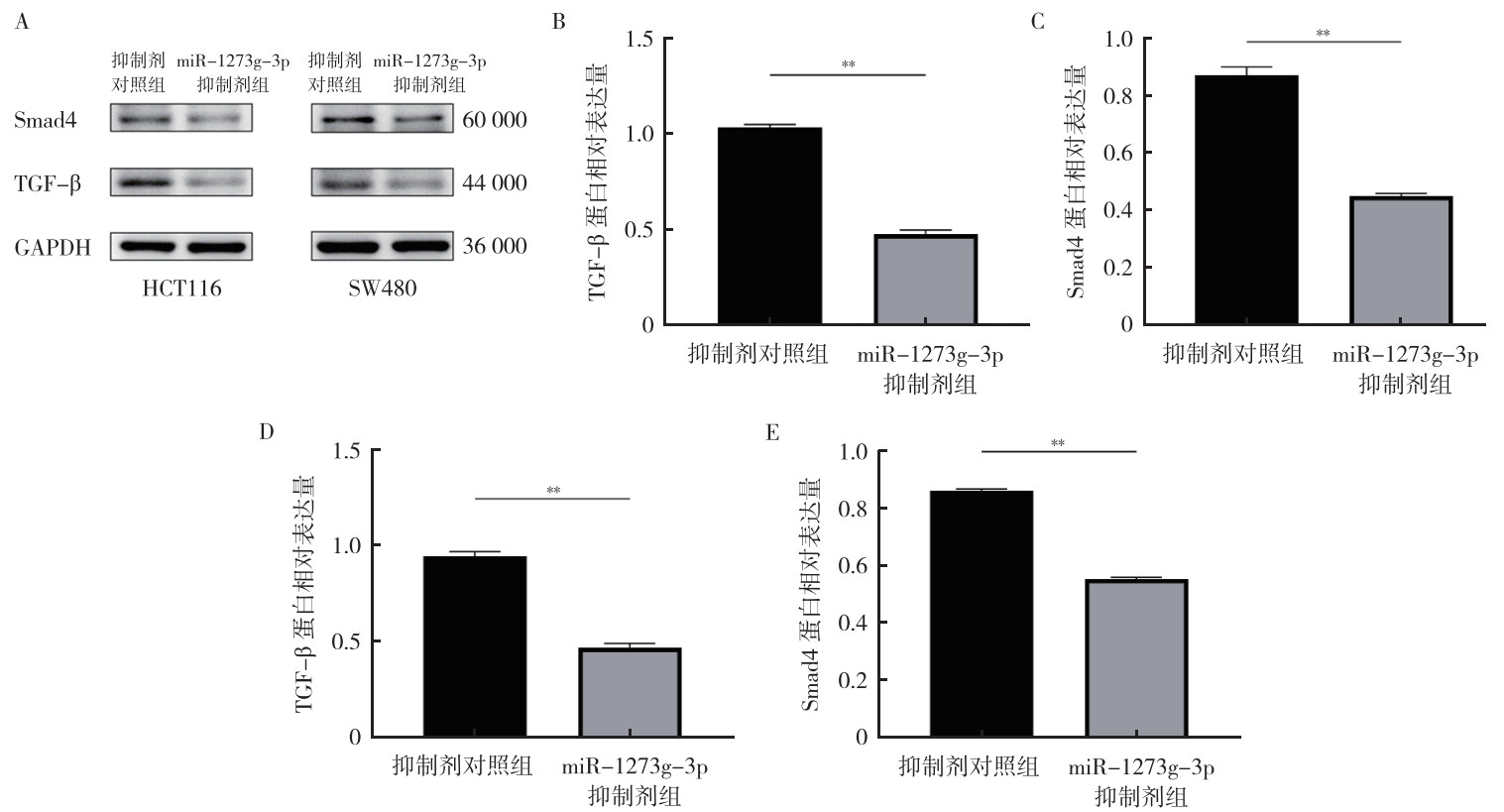
qRT-PCR验证了瞬时转染效果(均P < 0.01,图 3)。与抑制剂对照组比较,miR-1273g-3p抑制剂组中TGF-β和Smad4 mRNA表达均降低(均P < 0.01,图 4)。Western blot实验发现,与抑制剂对照组比较,miR-1273g-3p抑制剂转染过的HCT116和SW480细胞中TGF-β和Smad4蛋白表达均减少(均P < 0.01,图 5)。
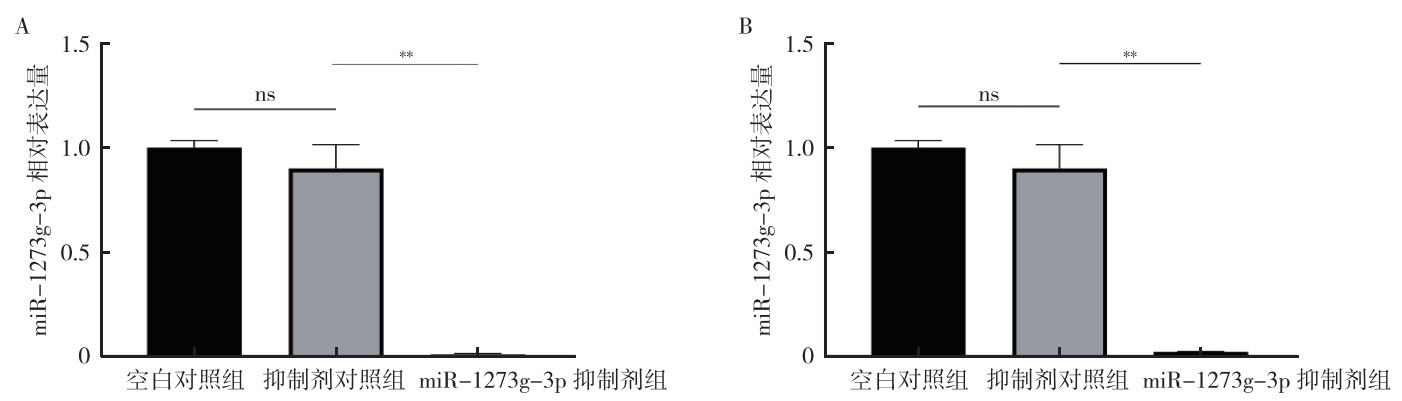
|
| 注 A:HCT116细胞转染后miR-1273g-3p相对表达量;B:SW480细胞转染后miR-1273g-3p相对表达量;ns:无统计学意义(not significant);**P < 0.01 图 3 人结直肠癌HCT116和SW480细胞瞬时转染miR-1273g-3p抑制剂48 h后miR-1273g-3p的表达效果验证 Fig.3 Verification of the expression of miR-1273g-3p in human colorectal cancer cells HCT116 and SW480 after transient transfection of miR-1273g-3p inhibitor for 48 hours |
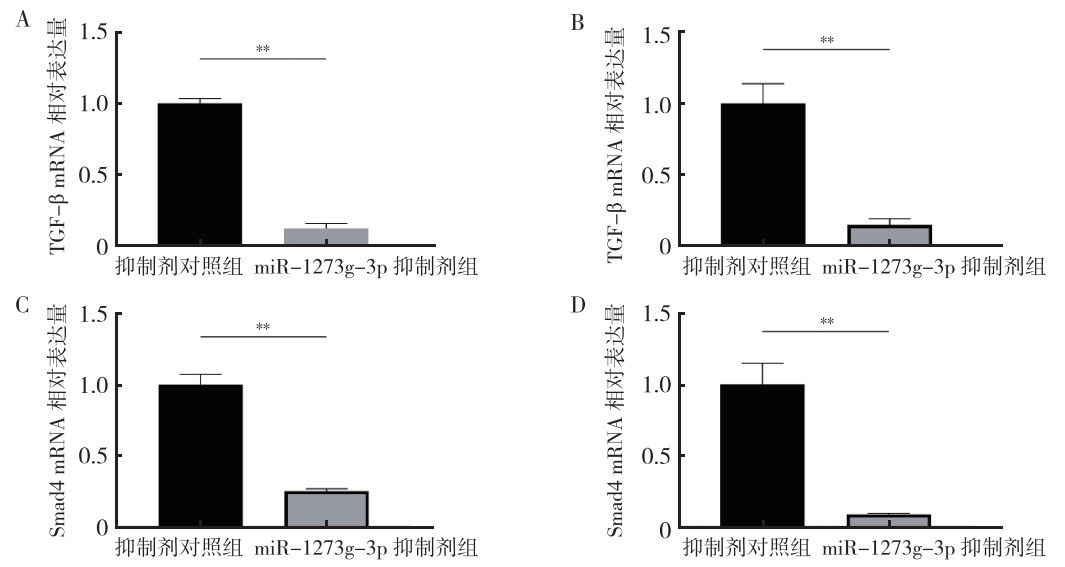
|
| 注 A:HCT116细胞转染后TGF-β mRNA相对表达量;B:SW480细胞转染后TGF-β mRNA相对表达量;C:HCT116细胞转染后Smad4 mRNA相对表达量;D:SW480细胞转染后Smad4 mRNA相对表达量;TGF-β:转化生长因子β(transforming growth factor-β);Smad4:mothers against decapentaplegic homolog 4;**P < 0.01 图 4 miR-1273g-3p抑制剂转染48 h后对人结直肠癌HCT116和SW480细胞TGF-β和Smad4 mRNA表达的影响 Fig.4 Effects of miR-1273g-3p inhibitor on the mRNA expression of TCF-β and Smad4 in human colorectal cancer HCT116 and SW480 cells after transfection for 48 h |
|
| 注 A:Western blot实验检测miR-1273g-3p抑制剂转染HCT116和SW480细胞后TGF-β和Smad4蛋白表达量;B:转染后HCT116细胞TGF-β蛋白表达量;C:转染后HCT116细胞Smad4蛋白表达量;D:转染后SW480细胞TGF-β蛋白表达量;E:转染后SW480细胞Smad4蛋白表达量;Smad4:mothers against decapentaplegic homolog 4;TGF-β:转化生长因子β(transforming growth factor-β);GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);**P < 0.01 图 5 miR-1273g-3p抑制剂转染48 h后对人结直肠癌HCT116和SW480细胞TGF-β和Smad4蛋白表达的影响 Fig.5 Effects of miR-1273g-3p inhibitor on the expression of TCF-β and Smad4 proteins in human colorectal cancer HCT116 and SW480 cells after transfection for 48 h |
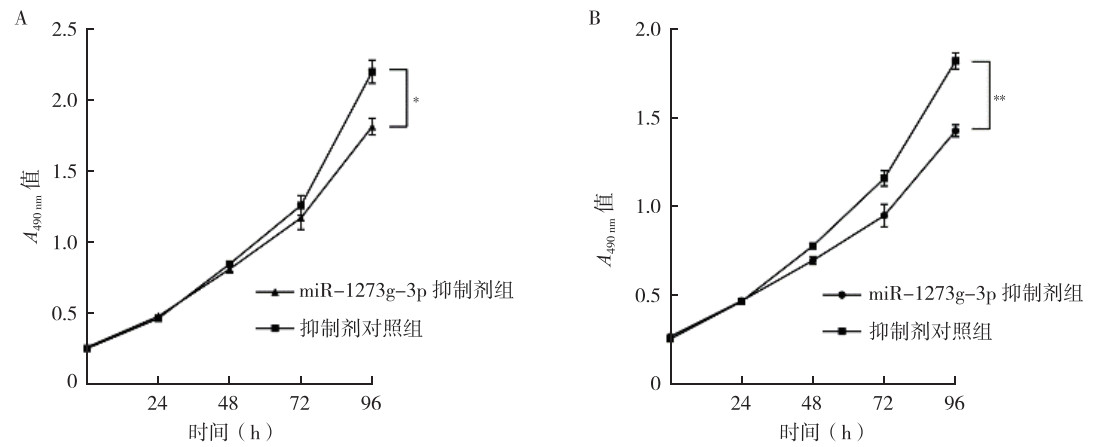
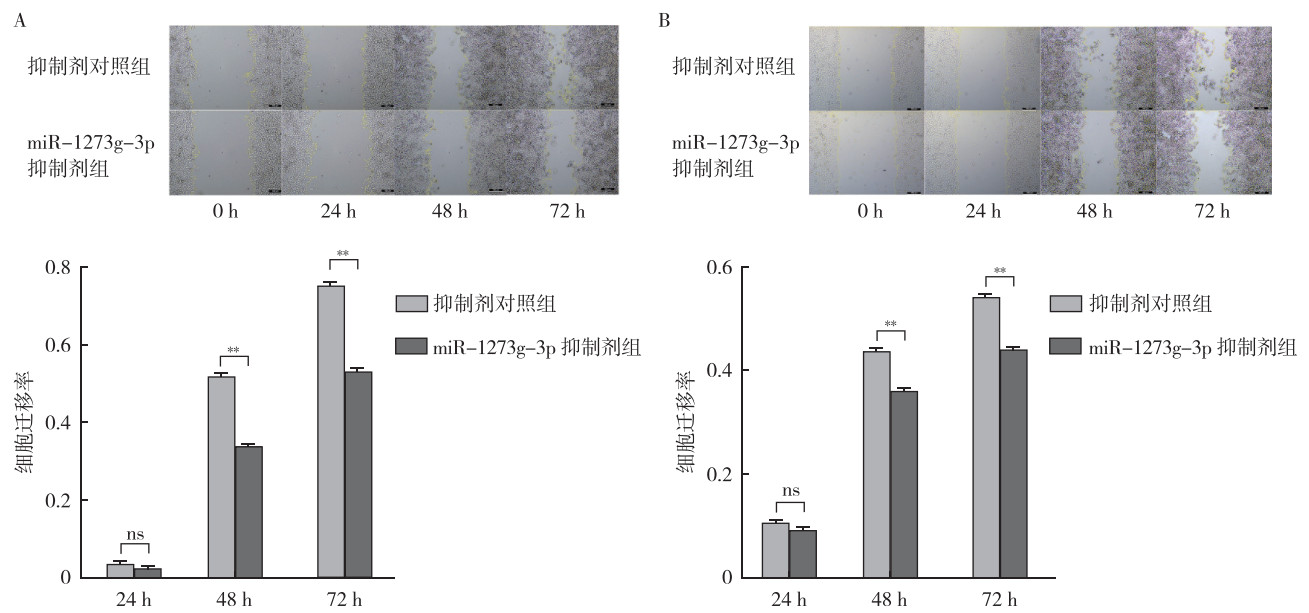
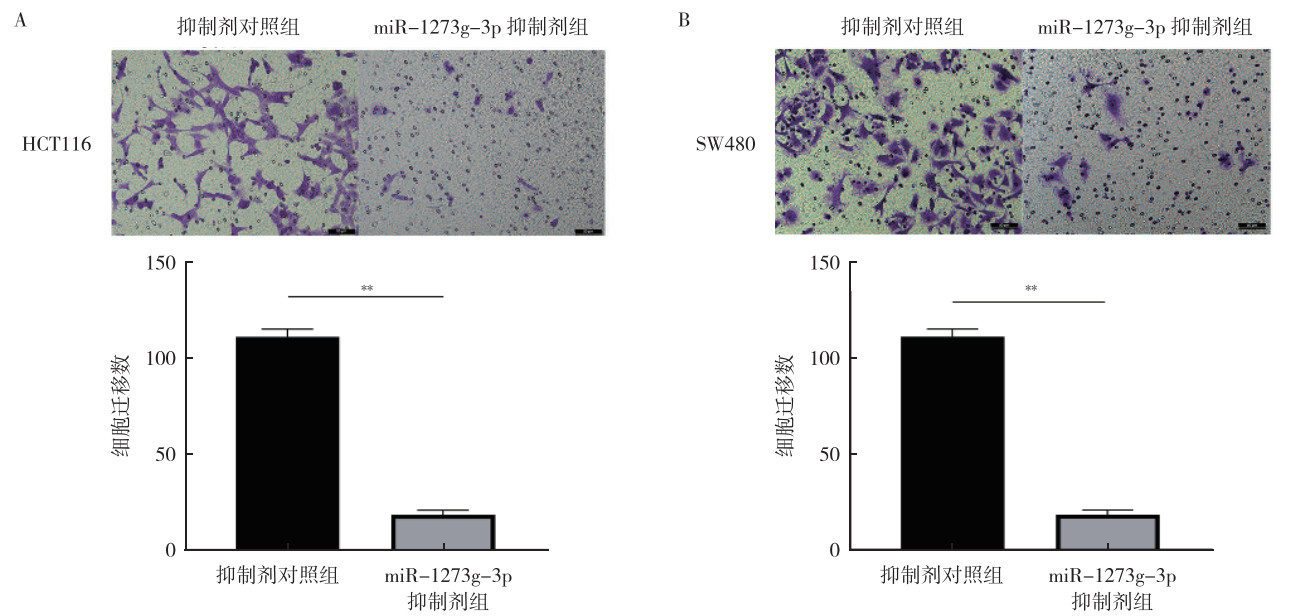
CCK8、划痕实验和transwell侵袭实验显示,瞬时转染48 h后,与抑制剂对照组比较,miR-1273g-3p抑制剂组HCT116和SW480细胞的增殖、迁移和侵袭能力均被抑制(均P < 0.05,图 6~8)。
|
| 注 A:CCK8实验检测miR-1273g-3p抑制剂转染HCT116细胞后的细胞增殖能力变化;B:CCK8实验检测miR-1273g-3p抑制剂转染SW480细胞后的细胞增殖能力变化;*转染后培养96 h两组比较,P < 0.05;**转染后培养96 h两组比较,P < 0.01 图 6 miR-1273g-3p抑制剂对人结直肠癌HCT116和SW480细胞增殖能力的影响 Fig.6 Effects of miR-1273g-3p inhibitor on the proliferation of human colorectal cancer HCT116 and SW480 cells |
|
| 注 A:划痕实验检测miR-1273g-3p抑制剂转染HCT116细胞后的细胞迁移能力变化;B:划痕实验检测miR-1273g-3p抑制剂转染SW480细胞后的细胞迁移能力变化;ns:无统计学意义(not significant);**P < 0.01 图 7 miR-1273g-3p抑制剂对人结直肠癌HCT116和SW480细胞迁移能力的影响 Fig.7 Effects of miR-1273g-3p inhibitor on the migration of human colorectal cancer HCT116 and SW480 cells |
|
| 注 A:Transwell实验检测miR-1273g-3p抑制剂转染HCT116细胞后的细胞侵袭能力变化;B:Transwell实验检测miR-1273g-3p抑制剂转染SW480细胞后的细胞侵袭能力变化;**P < 0.01 图 8 miR-1273g-3p抑制剂转染48 h后对人结直肠癌HCT116和SW480细胞侵袭能力的影响 Fig.8 Effects of miR-1273g-3p inhibitor on the invasive ability of human colorectal cancer HCT116 and SW480 cells after transfection for 48 h |
双荧光素酶报告基因实验显示,hsa-miR-1273g-3p与TGF-β的3’UTR有较明确的阳性结合关系,且hsa-miR-1273g-3p可降解TGF-β的3’UTR(P < 0.01,图 9)。
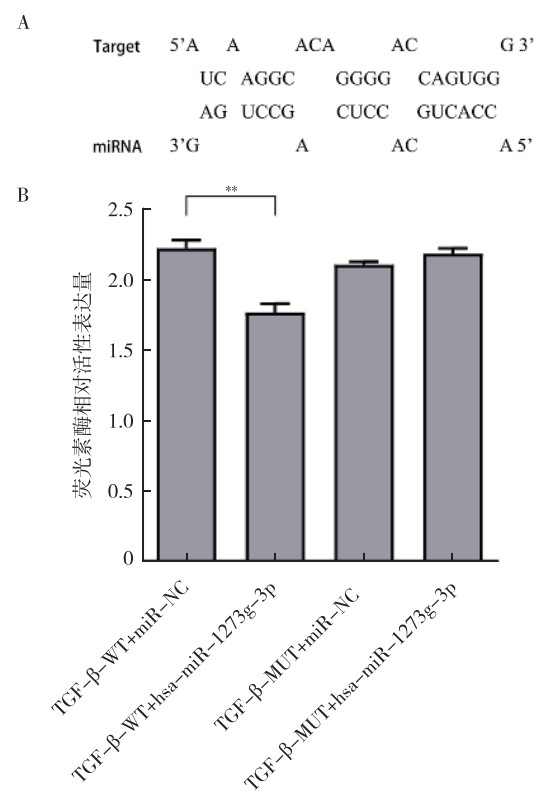
|
| 注 A: miR-1273g-3p和TGF-β结合位点;B:miR-1273g-3p和TGF-β靶向关系验证;TGF-β:转化生长因子β(transforming growth factor-β);WT:野生型(wild type);MUT:突变型(mutant);miR-NC:miRNA阴性对照(miRNA-negative control);**P < 0.01 图 9 双荧光素酶报告基因实验验证miR-1273g-3p和TGF-β的靶向关系 Fig.9 Dual luciferase reporter assay was used to verify the targeting relationship between miR-1273g-3p and TGF-β |
裸鼠皮下注射成瘤后观察至第24天,与抑制剂对照组比较,miR-1273g-3p抑制剂组小鼠体内瘤体生长速度及瘤体重量均减小(均P < 0.01,图 10)。
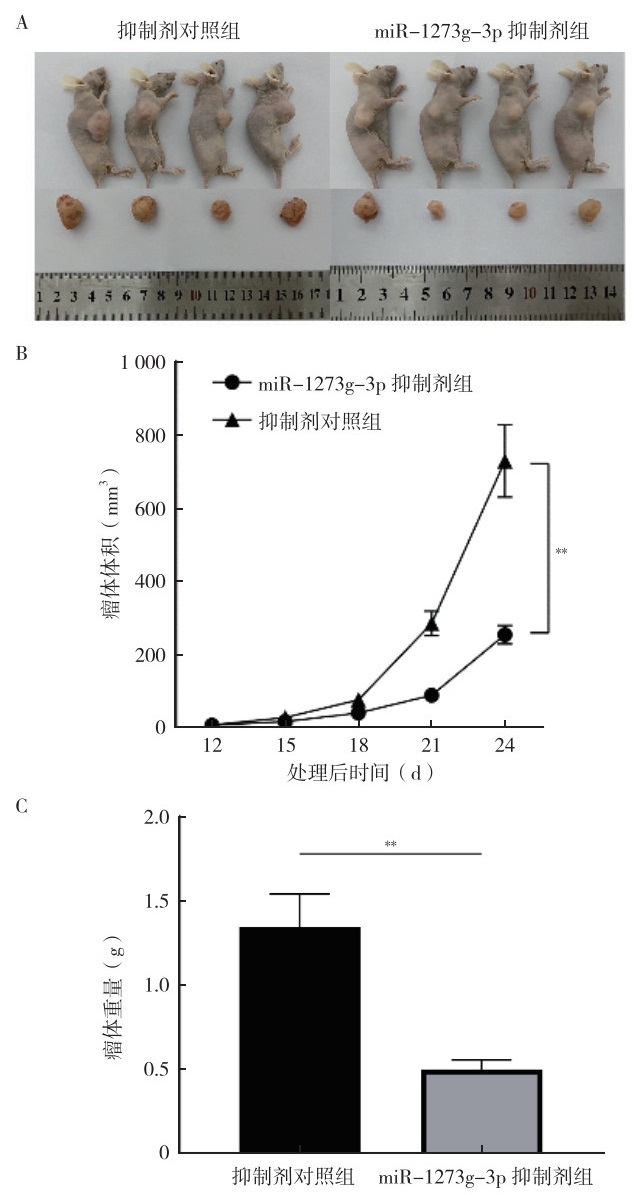
|
| 注 A:裸鼠皮下注射转染后的HCT116细胞后第24天miR-1273g-3p抑制剂组与抑制剂对照组皮下成瘤的比较;B:miR-1273g-3p抑制剂组与抑制剂对照组裸鼠皮下成瘤瘤体体积变化曲线;C:裸鼠皮下注射后第24天miR-1273g-3p抑制剂组与抑制剂对照组裸鼠皮下成瘤瘤体重量比较;**裸鼠皮下注射后第24天,P < 0.01 图 10 miR-1273g-3p抑制剂对人结直肠癌HCT116细胞体内肿瘤生长的影响 Fig.10 Effects of miR-1273g-3p inhibitor on the tumor growth of human colorectal cancer HCT116 cells in vivo |
miR-1273g-3p是长度为21 nt的非编码RNA分子,编码在甾醇载体蛋白2基因(sterol carrier protein 2 gene,SCP2)的一个内含子中。miR-1273g-3p在1 074个mRNA上具有1 330个结合位点[12]。本研究通过qRT-PCR实验发现,miR-1273g-3p在结直肠癌细胞HCT116和SW480中高表达;抑制miR-1273g-3p表达时,结直肠癌细胞HCT116和SW480的增殖、迁移和侵袭能力均受到抑制。其潜在机制尚不清楚。TGF-β/Smad信号通路是结直肠癌发生和发展中的重要信号分子通路,其中任一信号分子的失调均可影响通路的正常信号传导,从而引起细胞生长失控,诱发肿瘤。这已在人体多种肿瘤细胞株或实体瘤中得到证实[9]。结直肠癌中,TGF-β和Smad4通过调节PAI-1和E-cadherin的表达抑制肿瘤转移。研究显示,长链非编码RNA(long noncoding RNA,lncRNA)小核仁RNA宿主基6(small nucleolar RNA host gene 6,SNHG6)通过靶向上游移码蛋白1(up-frameshift protein 1,UPF1)激活TGF-β/Smad信号通路并通过调控锌指E盒结合同源盒蛋白1(zinc finger E-box binding homeobox 1,ZEB1)诱导上皮间充质转化来促进结直肠癌细胞的增殖、侵袭和迁移[13]。本研究发现,TGF-β和Smad4蛋白在结直肠癌细胞HCT116和SW480中高表达;抑制HCT116和SW480细胞中miR-1273g-3p的表达,TGF-β和Smad4的mRNA和蛋白表达同样受到抑制,同时HCT116和SW480细胞的增殖、迁移及侵袭也受到抑制。本研究进一步通过双荧光素酶报告基因实验证实,miR-1273g-3p可靶向结合TGF-β。这表明,miR-1273g-3p、TGF-β和Smad4参与结直肠癌细胞HCT116和SW480的恶性生物学行为,miR-1273g-3p的表达促进结直肠癌细胞HCT116和SW480的增殖、迁移及侵袭。其潜在的机制可能是miR-1273g-3p通过靶向TGF-β调控TGF-β/Smad4信号通路。而进一步探究miR-1273g-3p调控结直肠癌的其他分子机制及靶点是未来研究的方向。
总之,本研究表明,miR-1273g-3p、TGF-β和Smad4在结直肠癌细胞HCT116和SW480中高表达。miR-1273g-3p表达受到抑制的HCT116和SW480细胞的TGF-β和Smad4的表达减少,细胞的增殖、迁移及侵袭受到抑制。miR-1273g-3p可靶向结合TGF-β。TGF-β和Smad4作为TGF-β/Smad信号通路的主要组分,miR-1273g-3p促进结直肠癌细胞HCT116和SW480的增殖、迁移及侵袭的作用可能是通过靶向TGF-β调控TGF-β/Smad4信号通路实现的。miR-1273g-3p可能是治疗结直肠癌的新靶点。本研究组在进一步研究miR-1273g-3p过表达对HCT116和SW480细胞中TGF-β/Smad4信号通路相关蛋白的表达及细胞功能的影响,探究其分子机制。
| [1] |
Chen Y, Zhang B, Jin Y, et al. MiR-27b targets PI3K p110α to inhibit proliferation and migration in colorectal cancer stem cell[J]. Am J Transl Res, 2019, 11(9): 5988-5997. |
| [2] |
Wang H. MicroRNAs and apoptosis in colorectal cancer[J]. Int J Mol Sci, 2020, 21(15): 5353. DOI:10.3390/ijms21155353 |
| [3] |
Zhang N, Hu XY, Du YN, et al. The role of miRNAs in colorectal cancer progression and chemoradiotherapy[J]. Biomed Pharmacother, 2021, 134: 111099. DOI:10.1016/j.biopha.2020.111099 |
| [4] |
Li J, Mo RB, Zheng LM. MicroRNA-490-3p inhibits migration and chemoresistance of colorectal cancer cells via targeting TNKS2[J]. World J Surg Oncol, 2021, 19(1): 117. DOI:10.1186/s12957-021-02226-1 |
| [5] |
Xie N, Meng QP, Zhang YX, et al. MicroRNA-142-3p suppresses cell proliferation, invasion and epithelial-to-mesenchymal transition via RAC1-ERK1/2 signaling in colorectal cancer[J]. Mol Med Rep, 2021, 24(2): 568. DOI:10.3892/mmr.2021.12207 |
| [6] |
文彩艳, 李晓霞. MiR-34a通过靶向ATG7调节结直肠癌细胞自噬与增殖[J]. 实用肿瘤杂志, 2022, 37(4): 299-306. DOI:10.13267/j.cnki.syzlzz.2022.051 |
| [7] |
Guo H, Zeng X, Li H, et al. Plasma miR-1273g-3p acts as a potential biomarker for early breast ductal cancer diagnosis[J]. An Acad Bras Cienc, 2020, 92(1): e20181203. DOI:10.1590/0001-3765202020181203 |
| [8] |
Mazza T, Gioffreda D, Fontana A, et al. Clinical significance of circulating miR-1273g-3p and miR-122-5p in pancreatic cancer[J]. Front Oncol, 2020, 10: 44. DOI:10.3389/fonc.2020.00044 |
| [9] |
Malki A, ElRuz RA, Gupta I, et al. Molecular mechanisms of colon cancer progression and metastasis: recent insights and advancements[J]. Int J Mol Sci, 2020, 22(1): 130. DOI:10.3390/ijms22010130 |
| [10] |
Ye J, Lei JC, Fang QQ, et al. MiR-4666-3p and miR-329 synergistically suppress the stemness of colorectal cancer cells via targeting TGF-β/smad pathway[J]. Front Oncol, 2019, 9: 1251. DOI:10.3389/fonc.2019.01251 |
| [11] |
Liu L, Liu H, Zhou YY, et al. HLTF suppresses the migration and invasion of colorectal cancer cells via TGF-β/SMAD signaling in vitro[J]. Int J Oncol, 2018, 53(6): 2780-2788. |
| [12] |
Ivashchenko A, Berillo O, Pyrkova A, et al. Binding sites of miR-1273 family on the mRNA of target genes[J]. Biomed Res Int, 2014, 2014: 620530. |
| [13] |
Wang XK, Lai QH, He J, et al. LncRNA SNHG6 promotes proliferation, invasion and migration in colorectal cancer cells by activating TGF-β/Smad signaling pathway via targeting UPF1 and inducing EMT via regulation of ZEB1[J]. Int J Med Sci, 2019, 16(1): 51-59. DOI:10.7150/ijms.27359 |
 2024, Vol. 39
2024, Vol. 39


