文章信息
- 蓝艳丹, 胡跃
- Lan Yandan, Hu Yue
- 哌柏西利治疗激素受体阳性转移性乳腺癌的单中心真实世界研究
- Role of palbociclib for hormone receptor-positive metastatic breast cancer: A single-center real-world study
- 实用肿瘤杂志, 2022, 37(5): 397-402
- Journal of Practical Oncology, 2022, 37(5): 397-402
基金项目
- 浙江省自然科学基金项目(LY14H160030)
-
通信作者
- 胡跃, E-mail: huyuezju@zju.edu.cn
-
文章历史
- 收稿日期:2021-10-26
2. 南通大学附属妇幼保健院(南通市妇幼保健院)乳腺科, 江苏 南通 226018
2. Department of Breast Surgery, Affi liated Maternity and Child Health Care Hospital of Nantong University (Nantong Maternal and Child Health Care Hospital), Nantong 226018, China
乳腺癌是女性最常见恶性肿瘤,每年新发乳腺癌病例中,3%~10%在确诊时即有远处转移;早期乳腺癌中约30%在疾病进程中会出现远处转移;晚期乳腺癌患者5年生存率仅为20%[1-2]。约60%的转移性乳腺癌雌激素受体(estrogen receptor,ER)和(或)孕激素受体(progesterone receptor,PR)阳性,对内分泌治疗较敏感。对于这部分患者来说,化疗和内分泌治疗疗效相仿,而通常内分泌治疗的不良反应更易耐受,所以内分泌治疗是这部分患者的首选治疗[3-4]。
哌柏西利(palbociclib)是全球首个细胞周期蛋白依赖激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂,由辉瑞(Pfizer)公司研发,商品名为Ibrance。2015年美国食品药品管理局(Food and Drug Administration,FDA)批准哌柏西利联合来曲唑作为绝经后ER/PR阳性且人表皮生长因子受体2(human epithelial growth factor receptor 2,HER2)阴性晚期乳腺癌的初始治疗[5]。2016年FDA批准其联合氟维司群用于ER/PR阳性HER2阴性晚期乳腺癌的二线治疗[6]。因在我国上市较晚(2018年),目前国内关于哌柏西利的临床研究较少。作为一项非干预性回顾性研究,本研究旨在观察和分析哌柏西利治疗激素受体阳性晚期乳腺癌的单中心真实世界数据,探寻其疗效相关因素、获益人群和安全性,为其后续临床应用提供参考和借鉴。
1 资料与方法 1.1 研究设计与入排标准收集2019年1月至2021年6月浙江大学医学院附属第二医院接受哌柏西利治疗的激素受体阳性晚期乳腺癌患者数据,包括人口学特征、诊治病史、临床病理学特征、哌柏西利治疗模式、疗效及安全性数据等。纳入标准:(1)ER/PR阳性HER2阴性的新发晚期或复发转移性乳腺癌;(2)接受≥1个月哌柏西利治疗;(3)能提供可分析的随访数据;(4)知情同意。排除标准:(1)无法评估疗效;(2)无法提供生存随访数据;(3)合并其他恶性肿瘤。研究方案经浙江大学医学院附属第二医院伦理委员会批准。
共筛选患者98例,其中符合入排标准的65例纳入分析。年龄31~91岁,中位年龄56岁。哌柏西利用药时间1~22个月,中位用药时间5个月。其他人口学、临床病理特征及相关治疗信息见表 1。
| 临床特征 | 例数(%) | 临床特征 | 例数(%) | |
| 性别 | 转移灶数目 | |||
| 男性 | 2 (3.1) | 1处 | 26 (40) | |
| 女性 | 63 (96.9) | 2处 | 14 (21.5) | |
| 年龄 | ≥3处 | 25 (38.5) | ||
| 18~50岁 | 20 (30.8) | 内脏转移 | ||
| ≥51岁 | 45 (69.2) | 有 | 50 (76.9) | |
| 月经状态 | 无 | 15 (23.1) | ||
| 绝经前 | 18 (28.6) | 转移灶Ki-67 | ||
| 绝经后 | 45 (71.4) | < 15% | 12 (18.5) | |
| BMI | ≥15% | 29 (44.6) | ||
| < 18.5 kg/m2 | 9 (13.8) | 未获得资料 | 24 (36.9) | |
| ≥18.5 kg/m2且 < 24 kg/m2 | 30 (46.2) | 哌柏西利治疗线数 | ||
| ≥24 kg/m2 | 26 (40.0) | 一线 | 28 (43.1) | |
| ECOG评分 | 二线及以上 | 37 (56.9) | ||
| 0分 | 8 (12.3) | 前续解救内分泌治疗 | ||
| 1分 | 42 (64.6) | 无 | 33 (50.8) | |
| ≥2分 | 15 (23.1) | 一线 | 17 (26.2) | |
| 并发症 | 二线及以上 | 15 (16.9) | ||
| 有 | 27 (41.5) | 前续解救化疗 | ||
| 无 | 38 (58.5) | 无 | 46 (70.8) | |
| 首次诊断分期 | 一线 | 9 (13.8) | ||
| Ⅰ或Ⅱ期 | 20 (30.8) | 二线及以上 | 10 (6.2) | |
| Ⅲ期 | 19 (29.2) | 联合治疗方案 | ||
| Ⅳ期 | 14 (21.5) | 联合氟维司群 | 35 (53.8) | |
| 未获得资料 | 12 (18.5) | 联合芳香化酶抑制剂 | 29 (44.6) | |
| 原发灶Ki-67 | 联合他莫昔芬 | 1 (1.5) | ||
| < 15% | 17 (26.2) | 哌柏西利起始剂量 | ||
| ≥15% | 37 (56.9) | 125 mg/d | 59 (90.8) | |
| 未获得资料 | 11 (16.9) | 100 mg/d | 3 (4.6) | |
| 初诊至复发转移时间 | 75 mg/d | 3 (4.6) | ||
| ≤1年 | 2 (3.1) | 剂量调整 | ||
| > 1~5年 | 21 (32.3) | 无 | 62 (95.4) | |
| > 5年 | 28 (43.1) | 1次 | 3 (4.6) | |
| 未获得资料 | 14 (21.5) | |||
| 注 BMI:体质量指数(body mass index);ECOG:东部肿瘤协作组(Eastern Cooperative Oncology Group) | ||||
门诊与电话相结合开展随访,每2个月随访1次,收集患者生存信息、药物使用信息、实验室检查、影像学资料和不良反应等资料。疗效评价标准参照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[7],分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。早期肿瘤退缩(early tumor shrinkage,ETS)定义为治疗后8周内CT/MRI评估靶病灶最大径和垂直径之和减少 > 10%。客观缓解率(objective response rate,ORR)为CR+PR。至缓解时间(time to response,TTR)为治疗开始到首次记录的CR或PR的时间。无进展生存时间(progression-free survival,PFS)为治疗开始到疾病进展或死亡的时间;总生存时间(overall survival,OS)指治疗开始至因任何原因引起死亡的时间。
1.3 统计学分析采用IBM SPSS 26.0软件进行统计学分析。计数资料以频数(百分比)表示,组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法描绘生存曲线,log-rank检验进行单因素生存分析。Cox风险回归模型Forward LR向前选择法进行多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 治疗效果至观察截止时间2021年8月31日,34例(52.3%)患者仍在接受哌柏西利治疗,31例(47.7%)已经停止该药治疗。65例患者中,CR 1例,PR 21例,SD 10例,PD 25例,疗效待评价8例,ORR为38.6%(22/57),中位TTR 3.0个月(范围:1~16个月)。一线治疗ORR为60.0%(15/25);二线及以上治疗ORR为21.9%(7/32)。一线治疗中,联合氟维司群者ORR为57.1%(8/14),联合芳香化酶抑制剂者ORR为54.5%(6/11);两组比较,差异无统计学意义(P > 0.05)。
2.2 生存分析全组中位随访时间10个月(95%CI:3~29个月),中位PFS 19个月(95%CI:14.2~23.8个月,图 1A)。单因素生存分析显示,原发灶Ki-67≥15%(P=0.01)、多发转移灶(P < 0.05)、哌柏西利治疗前经二线及以上解救内分泌治疗(P=0.01)和化疗(P=0.03)提示预后不良;哌柏西利为二线及以上治疗(中位PFS:一线未达到vs二线及以上8个月,P=0.06)、ECOG评分高、合并内脏转移和转移灶Ki-67≥15%提示预后不良的趋势;ETS有提示预后较好的趋势;但差异均无统计学意义(均P > 0.05,表 2)。一线治疗中联合氟维斯群与联合芳香化酶抑制剂的疗效相当(分层HR=1.29,95%CI:0.28~5.98,P=0.74,图 1B)。多因素Cox风险回归模型提示,内脏转移是PFS的危险因素(HR=5.75,95%CI:1.71~19.37,P=0.005),ETS是PFS的保护因素(HR=0.31,95%CI:0.16~0.63,P=0.001;表 3,图 1C~1D)。全组预计OS为26.6个月。由于随访时间较短,仅5例发生OS事件,尚无法评估各变量与OS之间的关系。
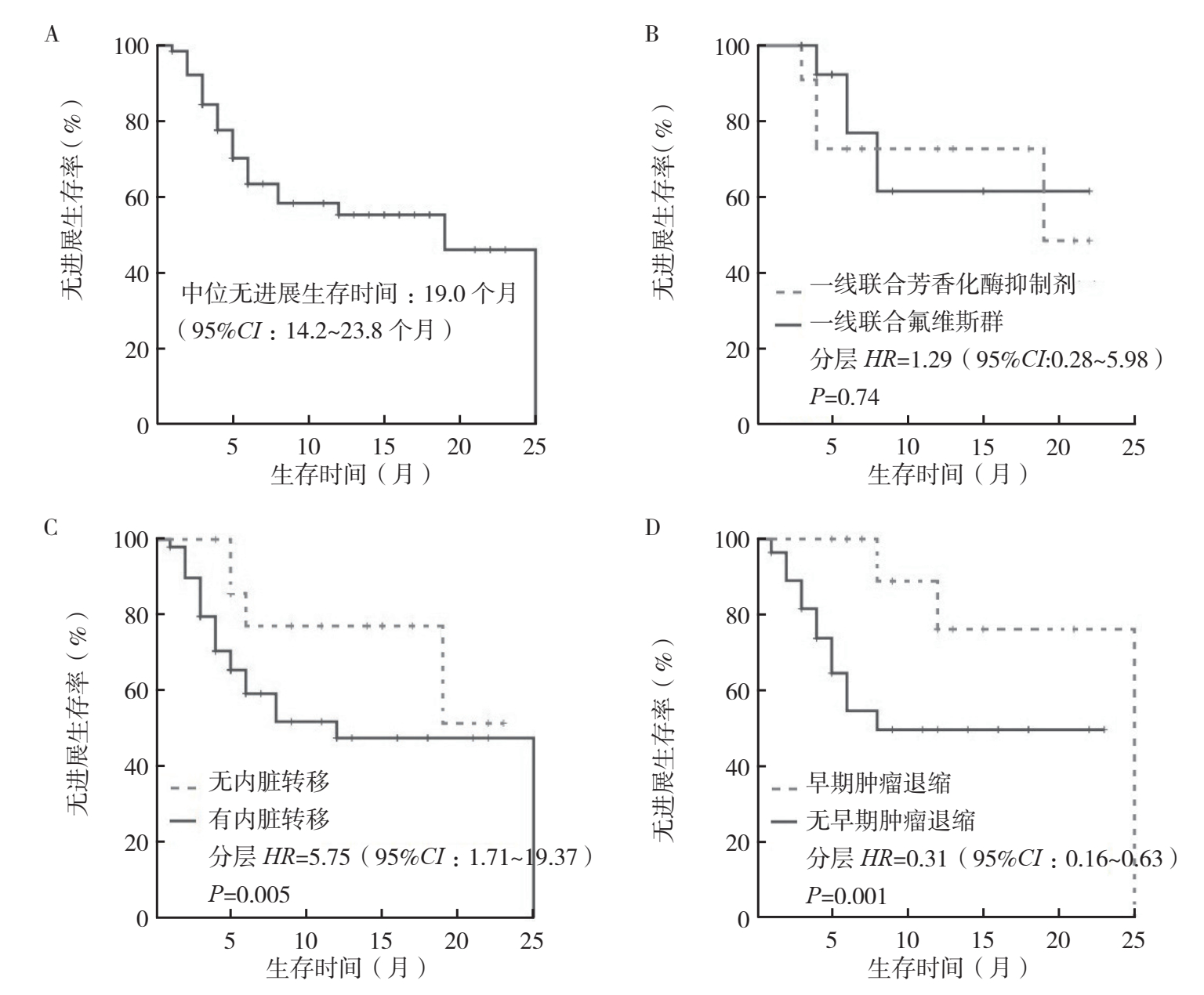
|
| 注 A:全组患者无进展生存曲线;B:一线治疗中哌柏西利联合芳香化酶抑制剂和联合氟维斯群的患者无进展生存曲线比较(联合他莫昔芬1例未计入);C:有和无内脏转移患者的无进展生存曲线比较;D:早期肿瘤退缩和无早期肿瘤退缩患者的无进展生存曲线比较 图 1 哌柏西利治疗激素受体阳性转移性乳腺癌全组和分组患者的无进展生存曲线 Fig.1 Progression-free survival curves of the entire group and the stratified analyses of palbociclib treatment in patients with hormone receptor-positive metastatic breast cancer |
| 变量 | HR | 95%CI | P值 |
| 年龄 | |||
| ≤50岁 | 1.00 | ||
| > 50岁 | 0.71 | 0.31~1.61 | 0.41 |
| 月经状态 | |||
| 绝经前 | 1.00 | ||
| 绝经后 | 1.02 | 0.42~2.44 | 0.97 |
| BMI | |||
| < 18.5 kg/m2 | 1.00 | ||
| ≥18.5 kg/m2且 < 24 kg/m2 | 1.89 | 0.55~6.56 | 0.31 |
| ≥24 kg/m2 | 0.67 | 0.17~2.58 | 0.56 |
| ECOG评分 | |||
| 0分 | 1.00 | ||
| 1分 | 5.13 | 0.67~39.33 | 0.12 |
| ≥2分 | 7.59 | 0.92~62.57 | 0.06 |
| 并发症 | |||
| 无 | 1.00 | ||
| 有 | 1.65 | 0.74~3.69 | 0.22 |
| 首次诊断分期 | |||
| Ⅰ或Ⅱ期 | 1.00 | ||
| Ⅲ期 | 1.72 | 0.68~4.32 | 0.25 |
| Ⅳ期 | 0.55 | 0.16~1.82 | 0.32 |
| 未获得资料 | 0.33 | 0.07~1.60 | 0.17 |
| 原发灶Ki-67 | |||
| < 15% | 1.00 | ||
| ≥15% | 4.61 | 1.36~15.61 | 0.01 |
| 未获得资料 | 0.44 | 0.05~4.30 | 0.48 |
| 是否初诊晚期 | |||
| 初诊晚期 | 1.00 | ||
| 复发转移 | 1.84 | 0.63~5.39 | 0.27 |
| 初诊至复发转移时间 | |||
| ≤5年 | 1.00 | ||
| > 5年 | 0.80 | 0.34~1.92 | 0.62 |
| 未获得资料 | 0.48 | 0.15~1.56 | 0.22 |
| 转移灶数目 | |||
| 1处 | 1.00 | ||
| 2处 | 4.90 | 1.55~15.47 | 0.01 |
| ≥3处 | 3.17 | 1.10~9.16 | 0.03 |
| 内脏转移 | |||
| 无 | 1.00 | ||
| 有 | 2.30 | 0.78~6.73 | 0.13 |
| 转移灶Ki-67 | |||
| < 15% | 1.00 | ||
| ≥15% | 3.19 | 0.72~14.04 | 0.13 |
| 未获得资料 | 1.97 | 0.43~9.13 | 0.39 |
| 哌柏西利治疗线数 | |||
| 一线 | 1.00 | ||
| 二线及以上 | 2.36 | 0.98~5.66 | 0.06 |
| 前续解救内分泌治疗 | |||
| 无 | 1.00 | ||
| 一线 | 1.98 | 0.72~5.47 | 0.19 |
| 二线及以上 | 3.25 | 1.28~8.24 | 0.01 |
| 前续解救化疗 | |||
| 无 | 1.00 | ||
| 一线 | 1.24 | 0.36~4.33 | 0.73 |
| 二线及以上 | 2.84 | 1.14~7.07 | 0.03 |
| 联合治疗方案 | |||
| 联合氟维司群 | 1.00 | ||
| 联合芳香化酶抑制剂 | 0.88 | 0.40~1.94 | 0.75 |
| 早期肿瘤退缩 | |||
| 无 | 1.00 | ||
| 有 | 0.24 | 0.05~1.08 | 0.06 |
| 注 BMI:体质量指数(body mass index);ECOG:东部肿瘤协作组(Eastern Cooperative Oncology Group) | |||
| 变量 | 调整后HR | 95%CI | P值 |
| 内脏转移 | |||
| 无 | 1.00 | ||
| 有 | 5.75 | 1.71~19.37 | 0.005 |
| 早期肿瘤退缩 | |||
| 无 | 1.00 | ||
| 有 | 0.31 | 0.16~0.63 | 0.001 |
最常见不良反应为血液学毒性(78.5%,51/65),其中3/4度41.5%(27/65),以中性粒细胞减少(38.5%,25/65)及白细胞减少(13.9%,9/65)为主,后续经粒细胞集落刺激因子等药物及对症支持治疗,均逐渐恢复至1/2度,其中3例因此调整剂量1次,1例中断治疗1次,无因此终止治疗者。其他不良反应包括:口腔溃疡5例,胃肠道反应5例,皮肤毒性3例,乏力1例。4例因经济原因终止治疗,2例因难以耐受的不良反应终止治疗(胃肠道反应和难愈性口腔溃疡各1例)。
3 讨论CDK4/6抑制剂通过抑制CDK4/6和细胞周期蛋白D的结合,进而抑制视网膜母细胞瘤蛋白(retinoblastoma protein,RB)磷酸化,阻止细胞由G1期进入S期,从而抑制肿瘤细胞增殖[8]。哌柏西利是一种口服高选择性CDK4/6抑制剂,PALOMA-1[9]与PALOMA-2研究[10]表明,在激素受体阳性晚期乳腺癌一线治疗中,哌柏西利联合来曲唑较来曲唑单药可改善PFS。PALOMA-3研究最新结果显示,在晚期后线治疗中,哌柏西利联合氟维司群治疗的PFS和OS均优于氟维斯群单药治疗[11]。因此,各主流指南均已将其列为激素受体阳性晚期乳腺癌的优选治疗方案[12]。
PALOMA-2研究中,哌柏西利联合来曲唑一线治疗激素受体阳性晚期乳腺癌的ORR为55.3%,中位PFS为27.6个月[10]。PALOMA-3研究中,哌柏西利联合氟维斯群多线治疗激素受体阳性晚期乳腺癌的ORR为25%,中位PFS为11.2个月[11]。基于欧美人群的IRIS[13]、Flatiron[14]、OPEN[15]和POLARIS[16]等真实世界研究提示,哌柏西利一线或多线治疗激素受体阳性晚期乳腺癌的ORR为60%~80%,中位PFS > 20个月。一般认为真实世界研究结果优于随机对照研究的主要原因是真实世界中能够使用哌柏西利等较昂贵药物的人群通常具有经济和卫生资源上的优势。本研究中一线治疗ORR为60.0%,中位PFS未达到;二线及以上治疗ORR为21.9%,中位PFS为8个月,总体与上述2个随机对照研究相当,但劣于欧美人群真实世界研究结果,可能原因包括:(1)经济等因素造成的治疗不规范甚至中断;(2)本研究中内脏转移患者占比较高(76.9%,而IRIS研究仅为46.4%);(3)人种差异等。
在激素受体阳性晚期乳腺癌的一线治疗中,哌柏西利治疗时应联合氟维斯群还是芳香化酶抑制剂,一直存在争论。为此,美国临床肿瘤学会2020年会报告的PARSIFAL研究对哌柏西利联合氟维斯群和联合来曲唑进行头对头的比较,结果两组PFS和OS均相当[17]。本研究一线治疗患者中,联合氟维斯群与联合芳香化酶者在ORR和PFS上均相当,虽病例数有限但也证实了PARSIFAL研究的结果。
ETS意味着抗肿瘤治疗开始后首次影像学评估时肿瘤负荷即出现下降。de Roock等[18]首先报道ETS在转移性结直肠癌药物治疗中可提示较好预后。此后针对多个瘤种的多项大型研究均提示,ETS在晚期肿瘤系统治疗中具有预测预后的价值[19-21],但在CDK4/6抑制剂治疗乳腺癌领域尚无报道。本研究多因素分析显示,ETS是独立的保护性预后因素(P=0.001),有ETS者PFS优于无ETS者(中位PFS 25个月vs 8个月)。此外多因素分析提示,内脏转移也是独立预后因素(P=0.005),有内脏转移灶预后不良(中位PFS 12个月vs 19个月)。这一结果与哌柏西利注册研究结果相仿:一线PALOMA-2研究中,内脏转移和无内脏转移患者中位PFS分别为19.3个月和35.9个月[9];后线PALOMA-3研究中,内脏转移和无内脏转移患者中位PFS分别为9.2个月和16.6个月[10]。本研究入组患者中内脏转移者 > 75%,因此生存数据也更接近PALOMA-3研究。需要说明的是,尽管有内脏转移是独立的不良预后因素,但上述随机对照研究已充分证实,无论患者有无内脏转移,在内分泌治疗基础上加用哌柏西利均可提高疗效,降低进展风险40%~50%;但由于该药物价格不菲,在用药之前根据患者有无内脏转移向患方说明治疗预期,甚为必要。此外,存在内脏危象和需要快速减轻肿瘤负荷的患者,应用CDK4/6抑制剂联合内分泌治疗的数据有限,仍应优先给予化疗等起效更快的治疗[12]。
综上所述,真实世界数据证实了哌柏西利在转移性乳腺癌中的确切疗效,一线治疗中其联合氟维斯群或芳香化酶抑制剂的疗效相当,内脏转移和ETS分别是发生PFS事件的危险和保护因素。作为一项回顾性研究,本研究存在样本量较小、非随机、单中心、影像学评估不够规范和随访时间较短等不足,因此结果也只适合作为临床实践的参考。后续随访及更大样本的前瞻性真实世界研究正在进行中。
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
Fahad Ullah M. Breast cancer: current perspectives on the disease status[J]. Adv Exp Med Biol, 2019, 1152: 51-64. |
| [3] |
El Sayed R, El Jamal L, El Iskandarani S, et al. Endocrine and targeted therapy for hormone-receptor-positive, HER2-negative advanced breast cancer: insights to sequencing treatment and overcoming resistance based on clinical trials[J]. Front Oncol, 2019, 9: 510. DOI:10.3389/fonc.2019.00510 |
| [4] |
黄佳欢, 雷蕾, 王晓稼. 白蛋白结合型紫杉醇治疗晚期乳腺癌的研究进展[J]. 实用肿瘤杂志, 2021, 36(6): 496-501. |
| [5] |
Beaver JA, Amiri-Kordestani L, Charlab R, et al. FDA approval: palbociclib for the treatment of postmenopausal patients with estrogen receptor-positive, HER2-negative metastatic breast cancer[J]. Clin Cancer Res, 2015, 21(21): 4760-4766. DOI:10.1158/1078-0432.CCR-15-1185 |
| [6] |
Walker AJ, Wedam S, Amiri-Kordestani L, et al. FDA approval of palbociclib in combination with fulvestrant for the treatment of hormone receptor-positive, HER2-negative metastatic breast cancer[J]. Clin Cancer Res, 2016, 22(20): 4968-4972. DOI:10.1158/1078-0432.CCR-16-0493 |
| [7] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [8] |
赵雅鑫, 江一舟, 谢韶, 等. ER+乳腺癌中CDK4/6抑制剂疗效预测生物标志物的研究进展[J]. 实用肿瘤杂志, 2017, 32(6): 507-510. |
| [9] |
Finn RS, Boer K, Bondarenko I, et al. Overall survival results from the randomized phase 2 study of palbociclib in combination with letrozole versus letrozole alone for first-line treatment of ER+/HER2- advanced breast cancer (PALOMA-1, TRIO-18)[J]. Breast Cancer Res Treat, 2020, 183(2): 419-428. DOI:10.1007/s10549-020-05755-7 |
| [10] |
Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozole as first-line therapy in estrogen receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer with extended follow-up[J]. Breast Cancer Res Treat, 2019, 174(3): 719-729. DOI:10.1007/s10549-018-05125-4 |
| [11] |
Rugo HS, Cristofanilli M, Loibl S, et al. Prognostic factors for overall survival in patients with hormone receptor-positive advanced breast cancer: analyses from PALOMA-3[J]. Oncologist, 2021, 26(8): e1339-1346. DOI:10.1002/onco.13833 |
| [12] |
National Comprehensive Cancer Network. NCCN Clinical practice guidelines in oncology (NCCN Guidelines): Breast Cancer (version 8. 2021) [EB/OL]. (2021-09-13)[2021-10-20]. http://www.nccn.org.
|
| [13] |
Taylor-Stokes G, Mitra D, Waller J, et al. Treatment patterns and clinical outcomes among patients receiving palbociclib in combination with an aromatase inhibitor or fulvestrant for HR+/HER2-negative advanced/metastatic breast cancer in real-world settings in the US: results from the IRIS study[J]. Breast, 2019, 43: 22-27. DOI:10.1016/j.breast.2018.10.009 |
| [14] |
DeMichele A, Cristofanilli M, Brufsky A, et al. Comparative effectiveness of first-line palbociclib plus letrozole versus letrozole alone for HR+/HER2- metastatic breast cancer in US real-world clinical practice[J]. Breast Cancer Res, 2021, 23(1): 37. DOI:10.1186/s13058-021-01409-8 |
| [15] |
Jeffrey T, Junji L, Maxine D, et al. Real-world treatment patterns and clinical outcomes with palbociclib combination therapy received in US community oncology practices[J]. Cancer Res, 2019, 79(4_suppl): 6-18, 29. |
| [16] |
Tripathy D, Blum JL, Rocque GB, et al. POLARIS: a prospective, multicenter, noninterventional study assessing palbociclib in hormone receptor-positive advanced breast cancer[J]. Future Oncol, 2020, 16(31): 2475-2485. DOI:10.2217/fon-2020-0573 |
| [17] |
Llombart-Cussac A, Pérez-García JM, Bellet M, et al. PARSIFAL: a randomized, multicenter, open-label, phase Ⅱ trial to evaluate palbociclib in combination with fulvestrant or letrozole in endocrine-sensitive patients with estrogen receptor ER+/HER2- metastatic breast cancer[J]. J Clin Oncol, 2020, 38(15_suppl): 1007. DOI:10.1200/JCO.2020.38.15_suppl.1007 |
| [18] |
de Roock W, Piessevaux H, de Schutter J, et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab[J]. Ann Oncol, 2008, 19(3): 508-515. DOI:10.1093/annonc/mdm496 |
| [19] |
Piessevaux H, Buyse M, Schlichting M, et al. Use of early tumor shrinkage to predict long-term outcome in metastatic colorectal cancer treated with cetuximab[J]. J Clin Oncol, 2013, 31(30): 3764-3775. |
| [20] |
Grünwald V, Lin X, Kalanovic D, et al. Early tumour shrinkage: a tool for the detection of early clinical activity in metastatic renal cell carcinoma[J]. Eur Urol, 2016, 70(6): 1006-1015. |
| [21] |
Wei M, Ye QQ, Wang X, et al. Early tumor shrinkage served as a prognostic factor for patients with stage Ⅲ non-small cell lung cancer treated with concurrent chemoradiotherapy[J]. Medicine (Baltimore), 2018, 97(19): e0632. |
 2022, Vol. 37
2022, Vol. 37


