文章信息
- 刘长健, 王健, 刘绍严
- Liu Changjian, Wang Jian, Liu Shaoyan
- 基于TCGA数据库分析FTH1在头颈部鳞状细胞癌中的表达和临床意义
- Analysis of expression and clinical significance of FTH1 in head and neck squamous cell carcinoma based on TCGA database
- 实用肿瘤杂志, 2023, 38(1): 33-37
- Journal of Practical Oncology, 2023, 38(1): 33-37
基金项目
- 中国医学科学院创新工程胸部肿瘤标记物的研究(2017-I2M-1-005)
-
通信作者
- 刘绍严, E-mail: shaoyan_liu@sina.com
-
文章历史
- 收稿日期:2021-08-25
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是世界上最常见的恶性肿瘤之一,可发生于鼻腔、口腔、舌、嘴唇、涎腺和喉部等多个解剖部位[1-2]。尽管在过去的几十年里,临床治疗有了显著的改善,但HNSCC患者的预后仍然很差。因此,研究HNSCC的预后标志物,可能有助于通过分子靶向来治疗HNSCC。
铁蛋白由重链和轻链多肽亚基组成,是原核生物和真核生物细胞内主要的储铁蛋白。其中,重链多肽亚基由铁蛋白重链多肽1(ferritin heavy chain polypeptide 1,FTH1)基因编码[3]。目前发现,FTH1在多种恶性肿瘤组织中发挥着重要作用,包括肾细胞癌和前列腺癌等[4-5]。
然而,FTH1在HNSCC中的表达尚不清楚。本研究基于癌症基因图谱(The Cancer Genome Atlas,TCGA)公共数据库旨在分析HNSCC与癌旁组织中FTH1基因差异表达情况,探讨FTH1基因表达与HNSCC临床分期及预后的关系。以期为HNSCC的诊治提供新的见解。
1 资料与方法 1.1 收集数据本研究所采用的数据均来源于TCGA数据库(http://tcgadata.nci.nih.gov/)。数据收集截至2021年6月的HNSCC组织样本(包括mRNA表达数据、临床资料数据和预后数据)。主要排除标准:存在临床资料和预后数据缺失的患者。最终纳入研究的HNSCC组织样本共417例。417例患者年龄19~90岁,中位年龄61岁,平均年龄60.9岁;其中男性302例,女性115例。
1.2 FTH1的表达与HNSCC患者的肿瘤分期相关性及对总生存的影响本研究通过TCGA在线分析工具GEPIA分析FTH1在HNSCC和癌旁组织中是否存在表达差异,并对其肿瘤分期和总生存进行相关分析。利用单因素及多因素Cox分析FTH1表达及HNSCC患者临床资料对患者预后的影响。
1.3 基因富集分析2021年6月使用GSEA(版本:4.0.0)软件进行富集分析,首先根据FTH1表达量的中位值将其分成高表达组和低表达组。选用GSEA中的c2.cp.kegg.v7.0.symbols.gmt和h.all.v7.0.symbols.gmt [Hallmarks]数据集作为内参照[6],运用缺省加权富集统计方法进行富集分析并设置1 000次随机组合。2021年6月使用String数据库进行FTH1的蛋白互作网络分析。
1.4 统计学分析采用SPSS 20.0统计学软件和Graphpad Prism 7.0绘图软件进行数据分析。生存分析使用Kaplan-Meier和Log-rank检验。使用Wilcox秩和检验比较FTH1表达量与肿瘤分期的关系。使用单因素及多因素Cox比例风险模型评价FTH1表达及HNSCC患者临床资料与预后的关系。以P < 0.05为差异具有统计学意义。在GSEA富集分析中错误发现率(falsed discovery rate,FDR) < 0.05作为显著富集基因集的判别标准。
2 结果 2.1 FTH1在HNSCC中高表达并与肿瘤分期和总生存有关GEPIA分析显示,在TCGA数据库中,FTH1在HNSCC中的表达水平高于癌旁组织(P < 0.05,图 1A)。不同肿瘤分期HNSCC中FTH1表达水平比较,差异具有统计学意义(P=0.027,图 1B);随肿瘤分期的增加,FTH1表达水平上调。FTH1高表达组总生存率低于低表达组(P=0.007 1;HR=1.4,PHR=0.007 5;图 1C)。
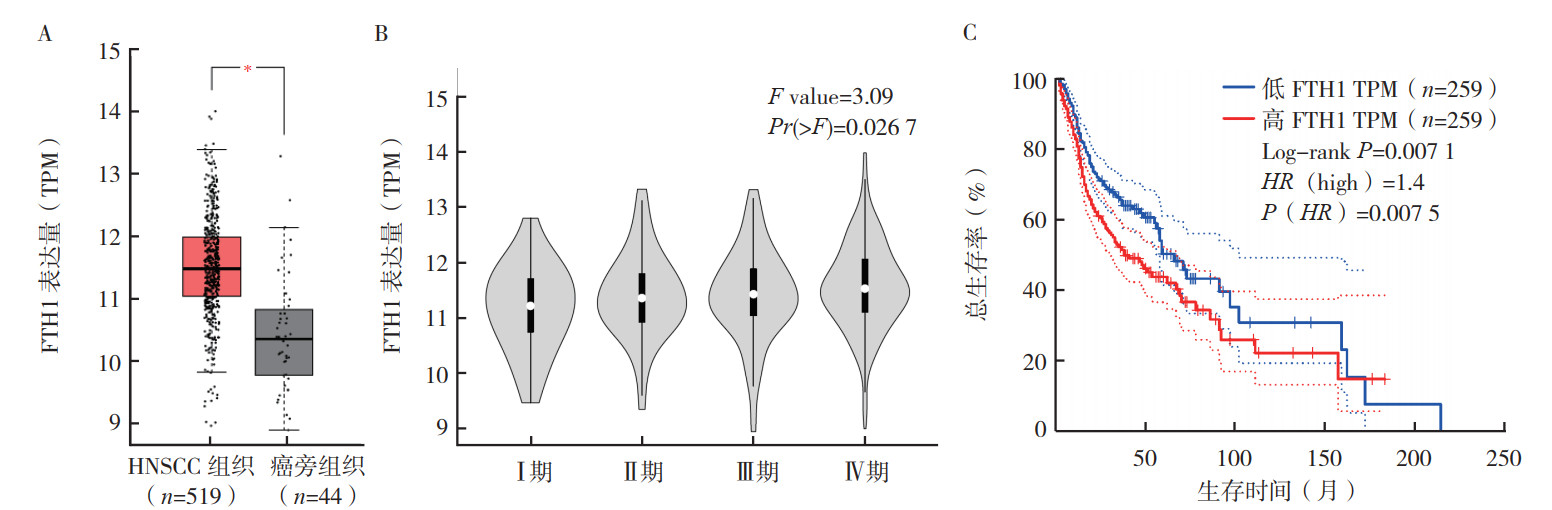
|
| 注 A:FTH1在HNSCC组织和癌旁组织中的表达情况;B:FTH1在HNSCC组织不同肿瘤分期中的表达情况;C:FTH1表达与HNSCC患者总生存的关系;TPM:每千个碱基的转录每百万映射读取的转录本(transcripts per kilobase per million mapped reads);*P < 0.05 图 1 TCGA数据库中FTH1在HNSCC中的表达情况及其与肿瘤分期和总生存的关系 Fig.1 FTH1 expression in HNSCC and its correlation with tumor stage and overall survival in TCGA database |
利用单因素及多因素Cox分析TCGA数据库中FTH1表达及HNSCC患者临床资料(包括年龄、性别、种族及肿瘤分期)对患者预后的影响。单因素Cox比例风险模型结果显示,肿瘤分期(HR=1.403,95%CI: 1.167~1.687,P < 0.01)和FTH1表达水平(HR=1.219,95%CI:1.010~1.471,P=0.039)与总生存率相关(图 2)。多因素Cox比例风险模型结果显示,肿瘤分期(HR=1.411,95%CI:1.171~1.700,P=0.01)和性别(HR=0.675,95%CI:0.490~0.930,P=0.016)可作为HNSCC的独立预后影响因素。
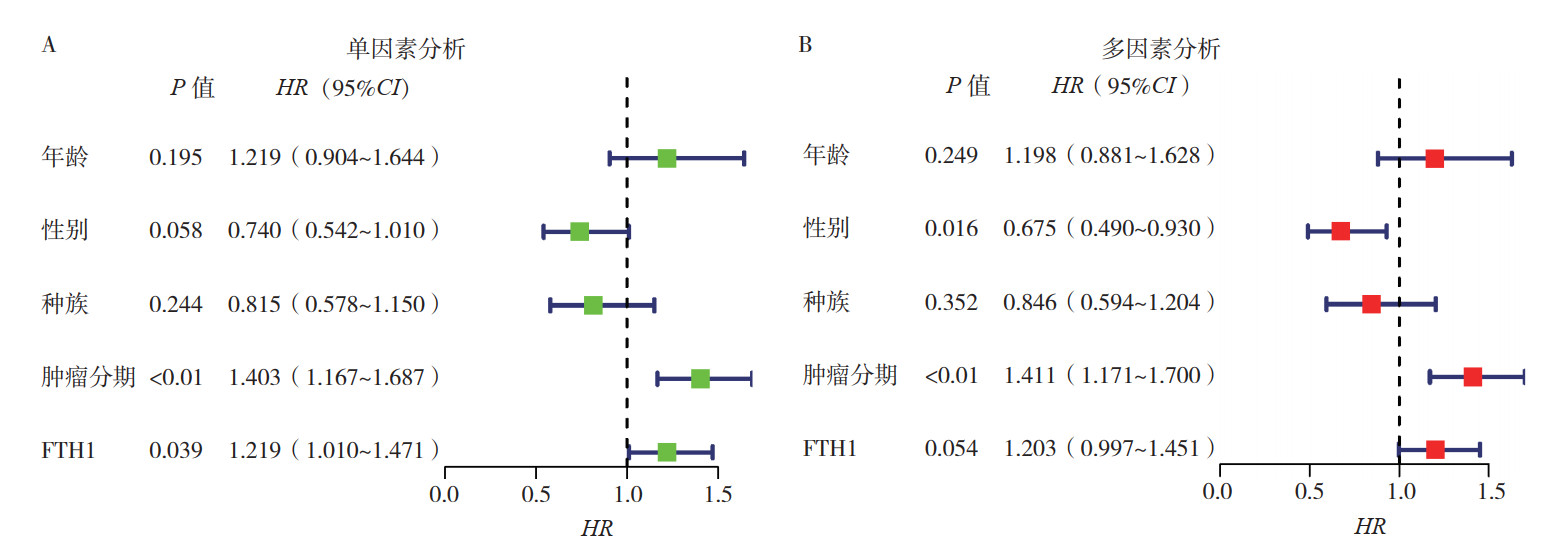
|
| 注 A:单因素Cox回归分析;B:多因素Cox回归分析 图 2 TCGA数据库中HNSCC患者临床病理特征及FTH1表达对总生存影响的单因素及多因素Cox回归分析 Fig.2 Univariate and multivariate Cox regression analysis of clinicopathological characteristics and FTH1 expression level associated with overall survival of HNSCC patients in TCGA database |
利用String数据库分析FTH1蛋白的互作网络显示,FTH1可以与铁蛋白轻链(ferritin light chain,FTL)、触珠蛋白(haptoglobin,HP)、热休克蛋白家族A成员8(heat shock protein family A member 8,HSPA8)、乳运铁蛋白(lactotransferrin,LTF)、核受体辅激活因子4(nuclear receptor coactivator 4,NCOA4)、清道夫受体A成员5(scavenger receptor class A member 5,SCARA5)、转铁蛋白受体蛋白(transferrin receptor protein,TFRC)、醛缩酶A(aldolase A,ALDOA)、醛缩酶C(aldolase C,ALDOC)和组织蛋白酶D(cathepsin D,CTSD)发生蛋白相互作用(图 3)。利用GSEA软件进行FTH1基因的KEGG通路富集分析显示,FTH1高表达样本富集到溶酶体(FDR < 0.001,P < 0.01)、谷胱甘肽代谢(FDR < 0.001,P < 0.01)、磷酸戊糖途径(FDR=0.027,P < 0.01)及癌症通路(FDR=0.020,P < 0.01)等基因集(图 4)。以hallmarks基因集为基础,利用GSEA软件探究FTH1对HNSCC的生物学行为产生影响的作用方式显示,FTH1高表达样本富集到Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)信号通路(FDR=0.018,P=0.004)和WNT/β-catenin信号通路(FDR=0.028,P=0.004;图 5)。
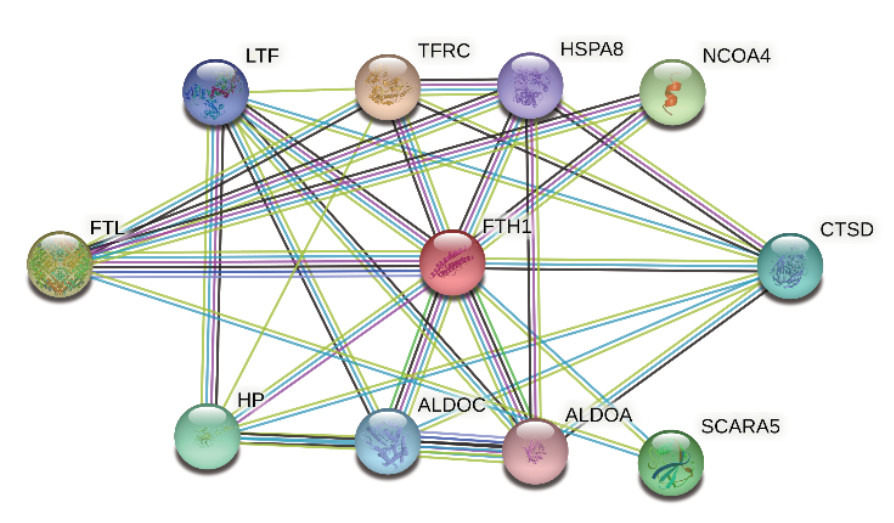
|
| 图 3 String数据库分析FTH1蛋白的互作网络 Fig.3 Interaction network of FTH1 protein analyzed by String database |
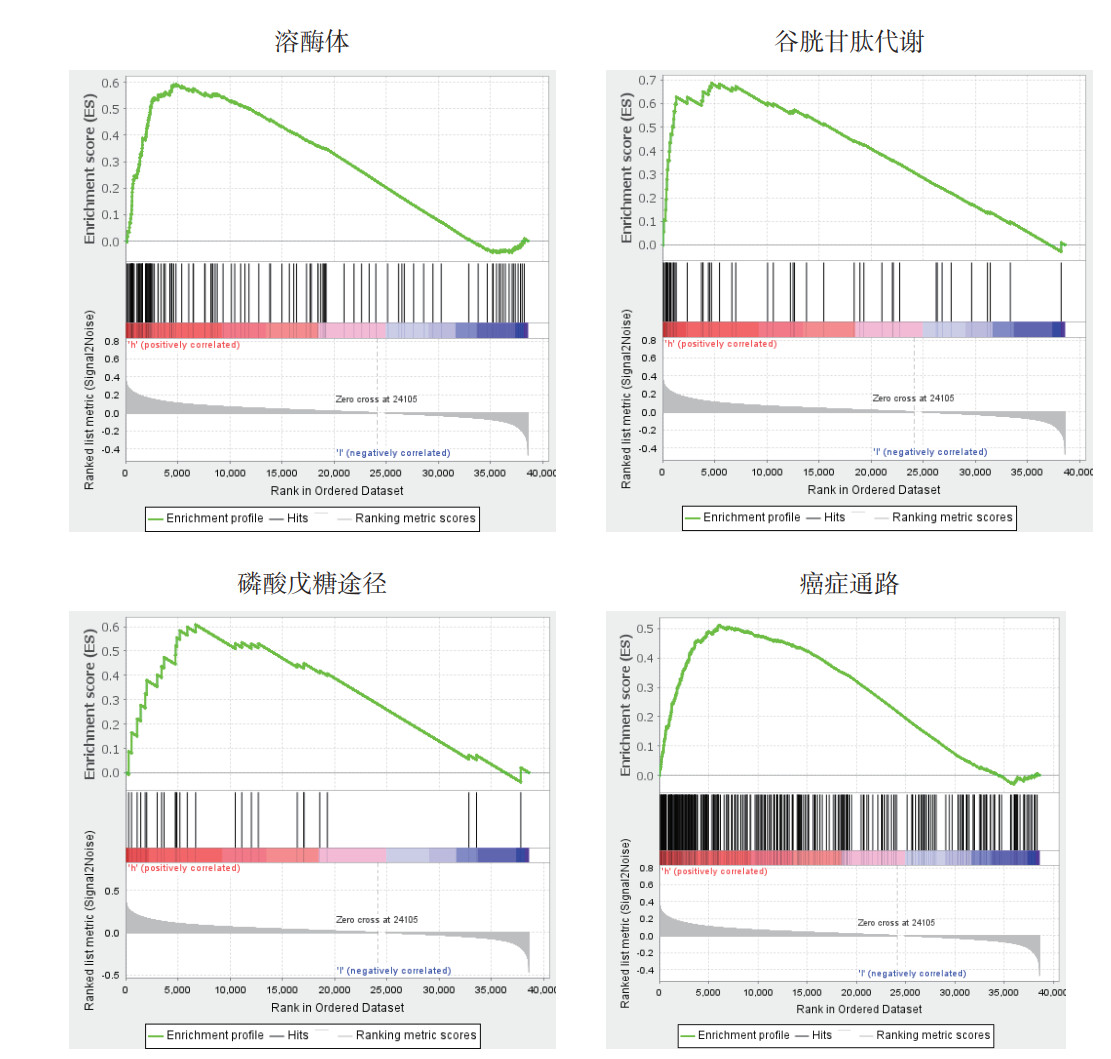
|
| 图 4 FTH1的KEGG功能富集 Fig.4 KEGG functional enrichment of FTH1 |
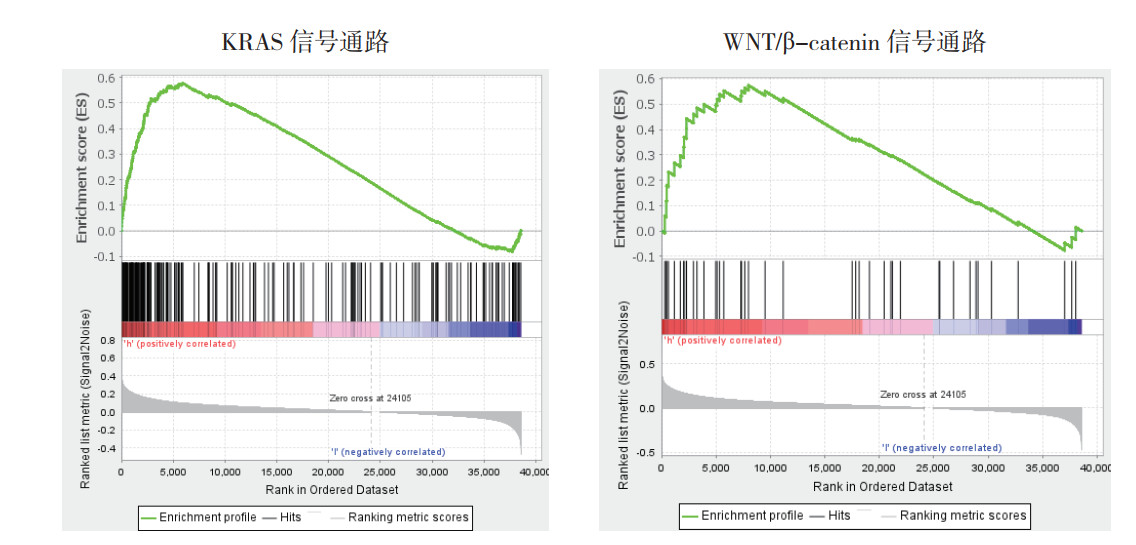
|
| 图 5 FTH1的Hallmark功能富集 Fig.5 Hallmarks functional enrichment of FTH1 |
铁蛋白是一种广泛存在于身体所有组织且高度保守的蛋白质,由铁蛋白重链和FTL这2种多肽链组成。其中,铁蛋白重链能够催化Fe2+氧化反应,而FTL主要作用是存储Fe3+。这2种链在维持体内铁平衡和防止铁超载发挥着重要作用[7-8]。FTH1基因主要负责合成铁蛋白的重链亚基,参与多种疾病信号通路。在前列腺癌和肾细胞癌中高表达的FTH1能够促进肿瘤的发生和进展[4-5]。但FTH1表达研究在HNSCC中尚未报道。探究FTH1基因在HNSCC的作用及其可能的作用机制对于HNSCC的诊治具有重要的作用。
本研究基于TCGA数据库,通过生物信息学分析首次报道FTH1在HNSCC中的表达和对预后的影响。结果显示,与癌旁组织比较,HNSCC组织中FTH1的表达水平升高,且高表达FTH1的HNSCC患者预后较差。此外,随着肿瘤分期的增加FTH1的表达水平呈现上升趋势。单因素Cox分析结果进一步显示,肿瘤分期和FTH1表达均是HNSCC的预后因素(均P < 0.05)。为了进一步探究FTH1在HNSCC中可能的作用机制,使用GSEA软件进行通路富集显示,FTH1高表达样本可能通过KRAS信号通路和WNT/β-catenin信号通路参与溶酶体、谷胱甘肽代谢、磷酸戊糖途径及癌症通路等重要代谢通路。这与之前报道的FTH1的作用相一致[3],推测高表达的FTH1可能通过调控代谢来影响HNSCC的发生和发展。目前研究暂未发现与FTH1发生蛋白互作的10个蛋白能够参与谷胱甘肽代谢和磷酸戊糖途径,因此,需要在接下来的研究中进一步探索。
综上所述,本研究基于TCGA数据库,初步探究了FTH1在HNSCC患者中的表达以及与肿瘤分期和预后的关系。初步结果表明,FTH1在HNSCC中高表达;肿瘤分期越高,FTH1表达越高;高表达FTH1的HNSCC患者总生存较低。但是目前FTH1在肿瘤中的研究几乎都是局限于对转录组数据的分析,在基础实验等方面的研究依旧甚少。接下来笔者将进一步研究FTH1对肿瘤细胞增殖、迁移、侵袭和凋亡等的影响,以便为HNSCC患者预后提供新的标志物,进而指导HNSCC的临床诊治。
| [1] |
Johnson DE, Burtness B, Leemans CR, et al. Head and neck squamous cell carcinoma[J]. Nat Rev Dis Primers, 2020, 6: 92. DOI:10.1038/s41572-020-00224-3 |
| [2] |
王佳峰, 葛明华. 头颈部黏膜鳞状细胞癌全球诊治新进展[J]. 实用肿瘤杂志, 2020, 35(1): 16-18. |
| [3] |
di Sanzo M, Quaresima B, Biamonte F, et al. FTH1 Pseudogenes in cancer and cell metabolism[J]. Cells, 2020, 9(12): 2554. DOI:10.3390/cells9122554 |
| [4] |
Huang HM, Qiu YY, Huang GL, et al. Value of ferritin heavy chain (FTH1) expression in diagnosis and prognosis of renal cell carcinoma[J]. Med Sci Monit, 2019, 25: 3700-3715. DOI:10.12659/MSM.914162 |
| [5] |
Su Q, Lei T, Zhang M. Association of ferritin with prostate cancer[J]. J BUON, 2017, 22(3): 766-770. |
| [6] |
喻唯, 刘小平, 李胜, 等. 基于TCGA数据库分析CD6表达与子宫颈癌预后的相关性[J]. 实用肿瘤杂志, 2021, 36(1): 52-56. |
| [7] |
Sammarco MC, Ditch S, Banerjee A, et al. Ferritin L and H subunits are differentially regulated on a post-transcriptional level[J]. J Biol Chem, 2008, 283(8): 4578-4587. |
| [8] |
Torti FM, Torti SV. Regulation of ferritin genes and protein[J]. Blood, 2002, 99(10): 3505-3516. |
 2023, Vol. 38
2023, Vol. 38


