文章信息
- 邓维博, 李耀岐, 刘露, 杨文宝, 许昊, 达明绪
- PD-1单抗联合仑伐替尼治疗胆囊癌一例
- 实用肿瘤杂志, 2021, 36(3): 267-269
基金项目
- 国家自然科学基金(81560391)
-
通信作者
- 达明绪, E-mail: hxdamingxu@hotmail.com
-
文章历史
- 收稿日期:2019-12-24
2. 甘肃省人民医院肿瘤外科, 甘肃 兰州 730000;
3. 甘肃中医药大学临床医学院, 甘肃 兰州 730000
患者女性,59岁,于2018年3月因胆囊结石伴急性胆囊炎于解放军联勤保障部队第940医院行腹腔镜下胆囊切除术。术中切除胆囊后,剖开胆囊见胆囊体黏膜层大小约3 cm×4 cm占位,术中快速病理结果:(胆囊)黏液腺癌。术中见胆囊床周围肝脏组织炎性反应病变,考虑胆囊癌肝脏转移?向患者家属告知需行开腹胆囊癌根治术,家属考虑患者心房颤动病史、年龄大和手术创伤大,拒绝行开腹胆囊癌根治术,遂术中行胆囊床及周围1 cm和肝脏炎性反应病变射频消融治疗后,结束手术。术后病理结果显示,(胆囊)黏液腺癌(图 1)。术后建议患者行化疗,但家属表示化疗不良反应大,难以接受,病情好转后即出院,遂未行其他特殊治疗。
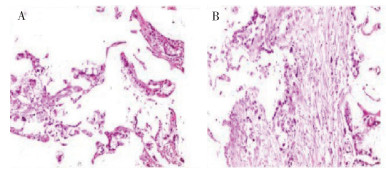
|
| 注 A:癌组织呈不规则腺样排列,细胞核大、深染,异型性明显,大部分漂浮在黏液湖中;B:间质内纤维组织增生,伴有多量淋巴细胞浸润 图 1 胆囊癌患者2018年4月2日病理检查结果(HE×100) |
2019年3月18日患者收治甘肃省人民医院前,发现左腹壁包块进行性增大1个月,周围有轻压痛,伴间断性右上腹胀痛。查体示,生命体征平稳。全身浅表淋巴结未触及异常,心肺未见明显阳性体征。左腹壁可见一突出皮肤肿块,呈圆球形,无红肿、破溃,触之大小约6 cm×6 cm,轻压痛,质地硬,不可推动。余腹未触及包块,无压痛及反跳痛。肝脾肋下未触及,移动性浊音阴性,肠鸣音3~4次/min。
2019年3月19日实验室检查示,肿瘤标志物糖类抗原199(carbohydrate antigen 199,CA199) > 1 200 U/mL,癌胚抗原(carcinoembryonic antigen,CEA)135.58 ng/mL。腹部CT检查示(图 2A),胆囊肿瘤术后改变,肝内多发异常强化灶,多考虑受侵及转移;十二指肠球部及幽门部壁增厚,周围淋巴结肿大;左侧腹壁软组织肿块,多考虑转移瘤。2019年3月20日腹部MRI检查示,胆囊肿瘤切除术后,术区软组织肿块,肝脏多发异常信号灶,考虑复发并肝内转移;肝门区多发淋巴结增大;盆壁偏左软组织肿块,考虑转移。
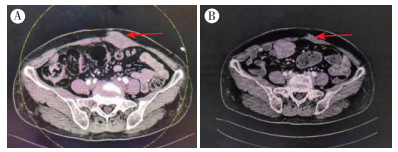
|
| 注 A:治疗前左侧腹壁32 mm×21 mm大小包块(箭头示包块);B:治疗后左侧腹壁包块消失(箭头示原包块位置) 图 2 胆囊癌患者治疗前后腹部CT表现 |
结合患者病史、临床表现、体征及实验室检查,诊断为:(1)腹壁继发恶性肿瘤;(2)肝脏转移瘤;(3)腹腔淋巴结继发恶性肿瘤;(4)胆囊恶性肿瘤病史;(5)心房纤颤。患者于2019年3月22日接受特瑞普利单抗240 mg+仑伐替尼8 mg治疗,3周/次。每次治疗前复查CA199和CEA(图 3)。6个周期治疗后于2019年6月10日查腹部CT平扫+增强示(图 2B),胆囊肿瘤术后改变,肝左叶转移灶;胰头周围多发淋巴结,较2019年3月19日减少;与2019年3月19日比较左侧腹壁未见明显肿块。
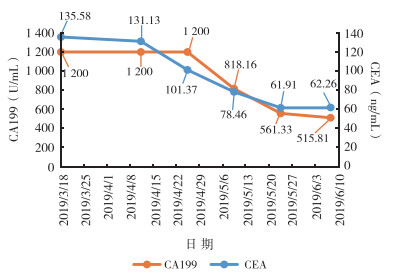
|
| 注 CEA:癌胚抗原(carcinoembryonic antigen);CA199:糖类抗原199(carbohydrate antigen 199);CEA和CA199水平检查日期为2019年3月18日、4月11日、4月25日、5月9日、5月23日和6月7日 图 3 胆囊癌患者治疗过程中CEA和CA199水平变化趋势图 |
胆囊癌是常见的胆管系统恶性肿瘤,其恶性程度高,预后极差。2018年全球癌症统计数据显示,胆囊癌新发219 420例,死亡165 087例[1]。早期胆囊癌行胆囊癌根治性切除常能获得较好的疗效。然而,由于胆囊癌早期症状与胆囊炎和胆囊息肉等疾病临床症状相似,因此早期胆囊癌易被忽略,发现时多已处于中晚期,失去根治性手术切除的机会。经过近年来的临床实践发现现有的顺铂、吉西他滨和5-氟尿嘧啶等针对胆囊癌的化疗药物的效果并不理想[2]。截止目前,仍未发现有针对胆囊癌的特异性化疗药物,晚期胆囊癌患者仍没有良好的治疗方法。因此,需要制定多模式治疗策略,以改善胆囊癌患者的预后。本例Ⅳ期胆囊癌患者使用序性死亡受体1(programmed cell death protein-1,PD-1)单抗联合仑伐替尼治疗,患者症状缓解,血清CA199和CEA持续下降,左腹壁转移瘤消失。
近年来,有关PD-1单抗的免疫抑制治疗成为肿瘤治疗的热点[3-4]。PD-1单抗主要是通过克服患者体内的免疫抑制,重新激活患者自身的免疫细胞来杀伤肿瘤细胞,是一种全新的抗肿瘤治疗理念。其可通过封闭T淋巴细胞的PD-1,阻断其与肿瘤细胞表面细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)结合,解除肿瘤细胞对免疫细胞的免疫抑制,使免疫细胞重新发挥抗肿瘤细胞免疫作用而杀伤肿瘤细胞[5]。PD-1单抗已用于多种肿瘤的治疗,如非小细胞肺癌[6]、头颈部鳞状细胞癌[7]、结直肠癌[8]和黑色素瘤[9]等。特瑞普利单抗于2018年12月17日在我国获得第1个全球条件批准,用于治疗先前系统治疗失败后的不可切除或转移性黑色素瘤[10]。
仑伐替尼是一种多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI),靶向作用于血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)、VEGFR2和VEGFR3, 抑制肿瘤组织血管的生成,已被FDA批准用于晚期放射性-碘难治性分化型甲状腺癌的治疗[11]。研究表明,仑伐替尼可用于多种实体肿瘤的治疗[12]。其在肝癌[13]和肾癌[14]中已显现出良好的效果。
近年来研究表明,PD-1单抗可通过改变免疫系统来增强仑伐替尼的疗效[15]。仑伐替尼通过减少肿瘤相关巨噬细胞数量从而影响抗肿瘤免疫反应,仑伐替尼与PD-1单抗联合使用时,增强干扰素(interferon,IFN)信号通路的激活,因而增强抗肿瘤效应[3]。本例使用PD-1单抗联合仑伐替尼治疗胆囊癌,患者血清学及影像学检查均提示治疗有明显疗效,病情得到部分缓解。PD-1单抗联合仑伐替尼可能是胆囊癌患者治疗的一种新选择。需要进一步研究PD-1单抗联合酪氨酸激酶抑制剂的协同机制,并且需要更多的临床数据为此提供证据。未来胆囊癌治疗的研究应多关注此领域。
综上所述,PD-1单抗联合仑伐替尼对失去手术治疗机会的晚期胆囊癌患者有明显的疗效,有望成为晚期胆囊癌患者治疗的新方案。
| [1] |
魏志力, 张毅. 术前血清CA19-9和CEA联合升高与胆囊癌术后生存期的相关性研究[J]. 实用肿瘤杂志, 2019, 34(2): 151-154. |
| [2] |
别平, 陈志宇. 胆囊癌诊治的困惑及未来突破方向[J]. 中国实用外科杂志, 2016, 36(10): 1021-1024. |
| [3] |
Kato Y, Tabata K, Kimura T, et al. Lenvatinib plus anti-PD-1 antibody combination treatment activates CD8+ T cells through reduction of tumor-associated macrophage and activation of the interferon pathway[J]. PLoS One, 2019, 14(2): e0212513. DOI:10.1371/journal.pone.0212513 |
| [4] |
Wu X, Gu Z, Chen Y, et al. Application of PD-1 blockade in cancer immunotherapy[J]. Comput Struct Biotechnol J, 2019, 17: 661-674. DOI:10.1016/j.csbj.2019.03.006 |
| [5] |
Salmaninejad A, Valilou SF, Shabgah AG, et al. PD-1/PD-L1 pathway: Basic biology and role in cancer immunotherapy[J]. Cell Physiol, 2019, 234(10): 16824-16837. DOI:10.1002/jcp.28358 |
| [6] |
Garon EB, Rizvi NA, Hui R, et al. Embrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028. DOI:10.1056/NEJMoa1501824 |
| [7] |
Taberna M, Oliva MR. Cetuximab-containing combinations in locally advanced and recurrent or metastatic head and neck squamous cell carcinoma[J]. Front Oncol, 2019, 9: 383. DOI:10.3389/fonc.2019.00383 |
| [8] |
Neda Y, Arash S, Kiarash G, et al. PD-1/PD-L1 blockade as a novel treatment for colorectal cancer[J]. Biomed Pharmacother, 2019, 110: 312-318. DOI:10.1016/j.biopha.2018.11.105 |
| [9] |
Schvartsman G, Taranto P, Glitza IC, et al. Management of metastatic cutaneous melanoma: updates in clinical practice[J]. Ther Adv Med Oncol, 2019, 11: 1758835919851663. |
| [10] |
National Medical Products Administration. The first domestic PD-1 antibody drug, treipril monoclonal antibody injection, was approved for marketing[EB/OL]. (2018-12-17)[2019-08-20]. http://www.junshipharma.com/upload/201901/14/201901141646166877.pdf.
|
| [11] |
Scott LJ. Lenvatinib: first global approval[J]. Drugs, 2015, 75(5): 553-560. DOI:10.1007/s40265-015-0383-0 |
| [12] |
Suyama K, Iwase H. Lenvatinib: A promising molecular targeted agent for multiple cancers[J]. Cancer Control, 2018, 25(1): 1073274818789361. |
| [13] |
Spallanzani A, Orsi G, Andrikou K, et al. Lenvatinib as a therapy for unresectable hepatocellular carcinoma[J]. Expert Rev Anticancer Ther, 2018, 18(11): 1069-1076. DOI:10.1080/14737140.2018.1524297 |
| [14] |
Študentová H, Vitásková D, Melichar B. Lenvatinib for the treatment of kidney cancer[J]. Expert Rev Anticancer Ther, 2018, 18(6): 511-518. DOI:10.1080/14737140.2018.1470506 |
| [15] |
Gunda V, Gigliotti B, Ashry T, et al. Anti-PD-1/PD-L1 therapy augments lenvatinib's efficacy by favorably altering the immune microenvironment of murine anaplastic thyroid cancer[J]. Int J Cancer, 2019, 144(9): 2266-2278. DOI:10.1002/ijc.32041 |
 2021, Vol. 36
2021, Vol. 36


