文章信息
- 文彩艳, 李晓霞
- Wen Caiyan, Li Xiaoxia
- miR-34a通过靶向ATG7调节结直肠癌细胞自噬与增殖
- miR-34a regulates autophagy and proliferation of colorectal cancer cells by targeting ATG7
- 实用肿瘤杂志, 2022, 37(4): 299-306
- Journal of Practical Oncology, 2022, 37(4): 299-306
基金项目
- 辽宁省自然科学基金(LFWK201712)
-
通信作者
- 李晓霞,E-mail:1435676616@qq.com
-
文章历史
- 收稿日期:2021-07-30
结直肠癌是世界第三大常见癌症,每年约有140万例发病,60万例死亡[1]。早期诊断率低、复发转移率高和缺乏有效治疗是导致结直肠癌相关死亡率高的原因[2]。因此,明确结直肠癌发生和发展的分子机制有助于为肿瘤检测、预防和治疗提供靶点,最终改善患者的预后。
microRNA(miRNA)是一类短的非编码RNA,由于其调控约60%的蛋白质编码基因,目前已成为抗癌治疗的潜在靶点[3]。通过结合靶mRNA分子,miRNA通常下调基因表达,并能影响肿瘤迁移、侵袭和耐药等[4-5]。先前的研究已经证明,miRNA表达失调是人类癌症的共同特征[6],在结直肠癌中有些miRNA是失调的并且与其进展相关[7]。miRNA的异常表达越来越被证实与细胞程序的不当刺激有关,例如自噬[8]。研究表明,miR-34a在抑制结直肠癌细胞增殖中起着关键作用[9],此外,miR-34a可以减弱结肠癌细胞的迁移和侵袭能力[10]。但是miR-34a在结直肠细胞自噬中的研究尚无报道。
自噬是自噬体依赖的溶酶体包裹并降解内含物的一种维持细胞内稳态的过程,肿瘤细胞通过自噬分解代谢作用产生营养物质和能量来维持肿瘤细胞的增殖,并缓解外界环境对肿瘤细胞的应激压力[11]。微管相关蛋白1轻链3(microtubular associated protein 1 light chain 3,LC3)为自噬相关基因8(autophagy associated gene 8,ATG8),LC3-Ⅰ被ATG7/APG7L激活,转移至ATG3并偶联脂酰乙醇胺(phosphatidyl ethanolamine,PE)以形成膜结合形式LC3-Ⅱ附着到自噬体(autophagosome)膜上,是自噬体的结构蛋白,因此可作为自噬的一个标志物[12]。
自噬在肿瘤细胞迁移和侵袭及肿瘤干细胞的维持和治疗抵抗中也发挥重要作用[13]。越来越多的研究表明,自噬参与结直肠癌的发生和发展[14]。而抑制自噬抑制结直肠癌细胞的增殖并促进其发生凋亡[15]。然而,自噬与肿瘤的关系仍然存在争议,需要进一步的探究。本研究探讨miR-34a对结直肠癌细胞自噬和增殖的影响,为结直肠癌细胞的靶向治疗提供一定的策略。
1 材料与方法 1.1 主要材料结直肠癌细胞株RKO、LoVo、SW480和SW620以及人正常结肠上皮细胞FHC购自中国科学院上海生命科学研究院细胞资源中心,胎牛血清(fetal bovine serum,FBS)、RPMI-1640培养液和胰蛋白酶购自美国Gibco公司。Trizol试剂购自美国Invitrogen公司。实时荧光定量PCR试剂盒GoTaq®qPCR Master购自美国Promega公司。pcDNA3.1-miRNA-34a和pcDNA3.1-ATG7重组过表达质粒购自上海吉凯基因公司。ATG7和兔抗人β-actin单克隆抗体(内参)购自英国Abcam公司, 辣根过氧化物酶标记的羊抗兔IgG(二抗)购自美国Proteintech公司。CCK-8试剂盒购自北京索莱宝生物技术有限公司。
1.2 标本收集收集2019年5月至2020年5月中国医科大学附属第四医院结直肠癌手术切除的30例结直肠癌及相应癌旁组织(癌周1 cm)标本,置液氮冷却后送-80℃冰箱保存。患者年龄45~68岁,中位年龄61.5岁;其中男性16例,女性14例。所有组织经2名病理学医师评估,并确诊为结直肠癌组织且复查无误。本研究在中国医科大学附属第四医院伦理委员会批准和患者签署知情同意书后进行。对所取得的组织标本进行后续实时定量反转录PCR(quantitative reverse transcription PCR, RT-qPCR)实验。
1.3 细胞培养结直肠癌细胞株(SW480、SW620、RKO和LoVo)和人正常结肠上皮细胞株FHC均购于上海细胞研究所。在RPMI-1640培养液中培养,添加10%FBS、100 U/mL青霉素和链霉素100 mg/mL,置于37℃含5%的CO2恒温培养箱中进行常规培养。每天更换新鲜培养液,当细胞融合度达到80%~90%时进行传代培养。
1.4 RNA提取与RT-qPCR使用Trizol试剂从培养的肿瘤细胞中提取总RNA,加入1/5体积的氯仿进行萃取和离心以获得上部的澄清液,然后加入相同体积的异丙醇并储存在-20℃过夜。在Promega-GoScript反转录系统(A5000)中,采用PrimeScriptTM-Reagent Kit体系反转录获得cDNA。RT-qPCR采用Promega GoTaq® qPCR Master Mix体系在ABI 7500 Fast Real-Time PCR System进行分析。每次实验独立进行重复3次。miRNA用2-△△Ct法定量,并用β-actin进行标准化,RT-qPCR采用引物如下:miR-34a上游引物为5'-ATACCGCTCGAGCCTCCTGCATCCTTTCTTT-3',下游引物为5'-ATACCGCTCGAGCCTGTGCCTTTTTCCTTCC-3';β-actin上游引物为5'-CATGTACGTTGCTATCCAGGC-3',下游引物为5'-CTCCTTAATGTCACGCACGAT-3';ATG3上游引物为5'-ATGCTAGCTAGCTAGCGTAGCA-3',下游引物为5'CGCTAGCTAAGCTAGCTAGTAA-3';ATG5上游引物为5'-GCAAGCCAGACAGGAAAAAG-3',下游引物为5'-GACCTTCAGTTGGTCCGGTAA-3';ATG7上游引物为5'-TGGGAGAAGAACCAGAAAGG-3',下游引物为5'-CAGGCACTTGACAGACACGA-3';LC3上游引物为5'-GATACAAGGGTGAGAAGCAG-3',下游引物为5'-AGATACCATCAATTCCACGG-3';ATG9上游引物为5'-CTGCTCCGAGTGATTCTTGC-3',下游引物为5'-CGTAAAGTTGCGGAAGAAGTC-3';ATG10上游引物为5'-AGACCATCAAAGGACTGTTCTG-3',下游引物为5'-GGGTAGATGCTCCTAGATGTGA-3'。
1.5 质粒的构建及细胞转染由上海吉凯基因公司构建pcDNA3.1-miR-34a、pcDNA3.1-ATG7及相应的阴性对照物pcDNA3.1,为成熟的重组构建质粒。序列如下:pcDNA3.1-miR-34a正向:5'-GCCAGCTGTGAGTGTTTCTT-3',反向:5'-AACGTGCAGCACTTCTAGGG-3';pcDNA3.1-ATG7正向:5'-GGACTAGTAGTAGCCAGTCCAAGTT-3',反向:5'-CCCAAGCTTCTGTGCGTAAAGAATGTA-3';pcDNA3.1正向:5'-CTCGCTTCGGCAGCACA-3',反向:5'-CTCGCTTCGGCAGCACA-3’。将SW480细胞接种于6孔板中,密度为3×105/孔,使用Lipofectamine® 3000将pcDNA3.1-miR-34a、pcDNA3.1-ATG7及pcDNA3.1质粒转染细胞。转染后24 h,进行RT-qPCR检测转染效果,48 h后收取细胞进行后续Western blot检测。
1.6 CCK-8测定细胞增殖SW480细胞分别转染pcDNA3.1-miR-34a质粒、pcDNA3.1质粒和共转染pcDNA3.1-miR-34a和pcDNA3.1-ATG7质粒12 h后,转移到96孔板上,37℃和5% CO2培养72 h,分别于0、24、48和72 h进行CCK-8测定,每一时间点更换培养液,每孔加入10 μL CCK-8(5 mg/mL),在490 nm处测量吸光度值。
1.7 免疫荧光检测LC3将爬片放入12孔板中,分别将SW480细胞接种于12孔中,每隔1~2 d换液1次,待细胞贴壁且生长到65%左右,将pcDNA3.1-miR-34a质粒转染细胞并置于培养箱中培养18 h,PBS清洗3次,每次5 min。随后用多聚甲醛固定20 min,然后用PBS清洗3次,5 min/次。使用Triton透膜后牛血清白蛋白封闭,之后分别孵育一抗和二抗,DAPI染核。以转染pcDNA3.1的SW480细胞为对照组,在荧光显微镜下检测各组结直肠癌细胞内LC3荧光斑点的数量与分布。
1.8 Western blotSW480细胞转染pcDNA3.1-miR-34a、pcDNA3.1-ATG7及pcDNA3.1质粒48 h后收集细胞,使用RIPA裂解物从细胞中提取蛋白质。然后使用BCA蛋白质分析试剂盒对蛋白质浓度进行量化。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,然后转移到聚二氟乙烯膜。在室温下用低脂牛奶(5%)封闭膜1 h,然后在4℃下用抗LC3(1∶1 000)抗体和抗β-actin(1∶1 000)抗体进行孵育。随后,用TBST清洗膜3次,并用辣根过氧化物酶结合的山羊抗兔二级抗体(1∶1 000)室温孵育1 h。用TBST清洗3次后,用ECL发光系统检测结果。蛋白表达用ImageJ软件定量。
1.9 荧光素酶报告实验检测细胞中荧光素酶活性变化采用pmirGLO双荧光素酶miRNA靶向表达载体构建质粒(Promega Corporation,美国),将ATG7 3’-UTR的miR-34a识别序列构建成野生型(WT)和突变型(MUT)片段,并克隆到pmirGLO双荧光素酶miRNA靶表达质粒中,分别命名为ATG7 WT和ATG7 MUT。将1×105个SW480细胞接种于DMEM的24孔培养板中,培养板中含有10%的无抗生素FBS。24 h后,通过Lipofectamine® 3000将SW480细胞与重组荧光素酶报告质粒(ATG7 WT或ATG7 MUT质粒)和miRNA(pcDNA3.1或pcDNA3.1-miR-34a)共转染。在37℃孵育箱下培养细胞24 h,然后制备细胞裂解物,并使用双荧光素酶报告检测试剂盒(Promega Corporation,美国)测量荧光素酶活性,萤火虫荧光素酶活性被标准化为海肾荧光素酶活性。
1.10 克隆形成实验检测细胞增殖水平取对数生长期的SW480细胞,0.25%胰酶消化离心后重悬吹打成单细胞悬液。接种到6孔板中,细胞密度为1×103/孔。细胞24 h贴壁后分别转染pcDNA3.1、pcDNA3.1-miR-34a和pcDNA3.1-miR-34a+pcDNA3.1-ATG7,转染72 h后,继续培养至10~14 d,抽去培养液,PBS清洗1遍后用4%多聚甲醛固定20 min,然后弃去固定液,用0.1%结晶紫水溶液染色30 min,之后PBS溶液冲洗。显微镜计数 > 10个细胞的克隆数,按照公式计算并得出克隆形成率:克隆形成比率=克隆形成数/接种细胞数。
1.11 统计学分析采用SPSS 22.0软件进行统计学分析。定量资料以均数±标准差(x±s)表示,采用Student t检验进行比较。以P < 0.05为差异具有统计学意义。
2 结果 2.1 miR-34a在结直肠癌组织和结直肠癌细胞中低表达RT-qPCR检测30例结直肠癌患者样本中miR-34a的表达情况显示,结直肠癌组织中miR-34a的表达水平低于癌旁组织(P < 0.01,图 1A)。结直肠癌细胞RKO、LoVo、SW480和SW620中miR-34a的表达水平均低于人正常结肠上皮细胞株FHC(均P < 0.05,图 1B)。选取miR-34a表达最低的SW480细胞用于后续转染过表达细胞实验。
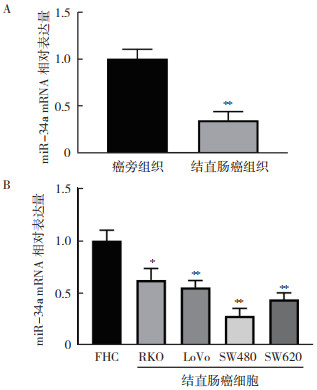
|
| 注 A:RT-qPCR检测miR-34a在结直肠癌组织和癌旁组织中的表达;B:RT-qPCR检测miR-34a在结直肠癌细胞和人正常结肠上皮细胞FHC中的表达;*P < 0.05;**P < 0.01 图 1 miR-34a在结直肠癌组织和结直肠癌细胞中低表达 Fig.1 miR-34a was low expressed in colorectal cancer tissues and colorectal cancer cells |
结直肠癌细胞SW480中转染pcDNA3.1-miR-34a质粒,通过RT-qPCR验证pcDNA3.1-miR-34a转染效果。转染24 h后miR-34a的表达水平上调11.36倍(P < 0.01,图 2A)。建立miR-34a过表达细胞株后,采用CCK-8试剂盒检测SW480细胞活性水平表明,过表达miR-34a 72 h后SW480细胞活性均降低(均P < 0.05,图 2B)。
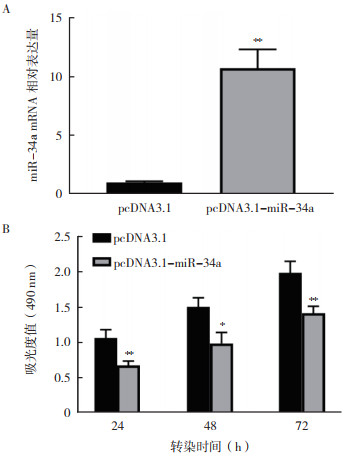
|
| 注 A:RT-qPCR验证pcDNA3.1-miR-34a瞬转SW480细胞24 h后的转染效果;B:CCK-8检测pcDNA3.1-miR-34a瞬转SW480细胞24、48和72 h后的细胞活性;*P < 0.05;**P < 0.01 图 2 过表达miR-34a抑制结直肠癌细胞SW480的活性 Fig.2 Overexpression of miR-34a inhibited the viability of colorectal cancer cell SW480 |
Western blot检测显示,SW480细胞过表达miR-34a 48 h后,LC3-Ⅰ向LC3-Ⅱ的转化减少(P < 0.01,图 3A)。采用免疫荧光实验观察LC3荧光斑点的形成情况发现,过表达miR-34a 24 h后,SW480细胞LC3荧光斑点形成减少(P < 0.01,图 3B)。
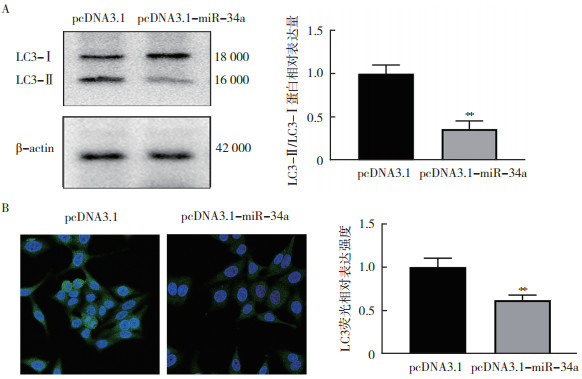
|
| 注 A:Western blot检测pcDNA3.1-miR-34a瞬转SW480细胞48 h后LC3蛋白的表达水平;B:免疫荧光检测pcDNA3.1-miR-34a瞬转SW480细胞24 h后LC3蛋白的表达水平;**P < 0.01 图 3 过表达miR-34a抑制结直肠癌细胞SW480的自噬水平 Fig.3 Overexpression of miR-34a inhibited the autophagy of colorectal cancer cell SW480 |
SW480细胞转染pcDNA3.1-miR-34a 24 h后,采用RT-qPCR检测自噬相关蛋白ATG3、ATG5、ATG7、ATG8(LC3)、ATG9和ATG10的表达发现,ATG3、ATG5、ATG7、ATG9和ATG10的mRNA表达水平均下降,其中ATG7蛋白的mRNA表达水平降低最明显(P < 0.01,图 4A)。采用Western blot检测显示,SW480细胞转染pcDNA3.1-miR-34a 24 h后,ATG7表达水平降低(P < 0.05,图 4B)。利用Starbase网站生物信息学分析(starbase.sysu.edu.cn/)发现,ATG7可能是miR-34a的直接靶点(图 5A)。利用荧光素酶报告基因实验结果显示,miR-34a抑制野生型ATG7-3’UTR质粒(ATG7 WT)转染细胞的荧光素酶活性(P < 0.01),而对突变型ATG7-3’UTR质粒(ATG7 MUT)转染细胞的荧光素酶活性并无影响(P > 0.05,图 5B)。
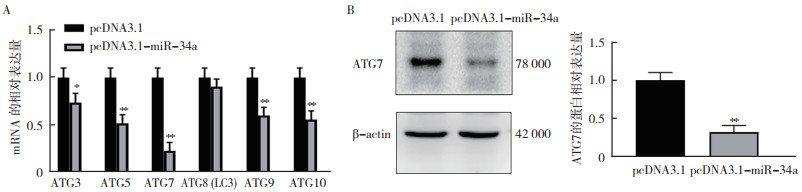
|
| 注 A:RT-qPCR验证过表达miR-34a 24 h后自噬相关蛋白的mRNA表达水平;B:Western blot检测过表达miR-34a 48 h后ATG7蛋白表达水平;*P < 0.05;**P < 0.01 图 4 miR-34a调控ATG mRNA表达 Fig.4 miR-34a regulates ATG mRNA expression |
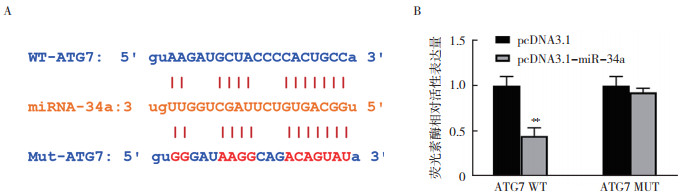
|
| 注 A:Starbase预测miR-34a与ATG7的结合位点;B:荧光素酶报告基因实验验证miR-34a可以靶向结合ATG7;**P < 0.01 图 5 miR-34a靶向结合ATG7 Fig.5 miR-34a targeted binding to ATG7 |
结直肠癌细胞SW480中转染pcDNA3.1-ATG7质粒24 h后,RT-qPCR结果为ATG7的表达水平上调4.41倍(P < 0.01,图 6A),转染48 h后Western blot检测ATG7蛋白表达水平增加(图 6B)。CCK-8法检测细胞活性水平发现,结直肠癌细胞SW480转染pcDNA3.1-miR-34a 72 h后细胞活性降低(P < 0.01,图 7A)。与单独转染pcDNA3.1-miR-34a比较,共转染pcDNA3.1-miR-34a和pcDNA3.1-ATG7 72 h后,SW480细胞活性提高(P < 0.01)。克隆形成实验表明,共转染pcDNA3.1-miR-34a和pcDNA3.1-ATG7 10 d后SW480细胞增殖水平相对提高(P < 0.01,图 7B)。
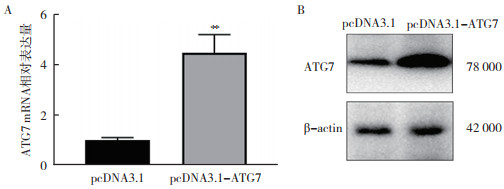
|
| 注 A:RT-qPCR验证pcDNA3.1-ATG7瞬转SW480细胞24 h后的转染效果;B:Western blot检测SW480细胞过表达ATG7 48 h后ATG7蛋白表达水平;**P < 0.01 图 6 结直肠癌细胞SW480过表达ATG7的转染效率检测 Fig.6 Detection of transfection efficiency of overexpression of ATG7 in colorectal cancer cell SW480 |
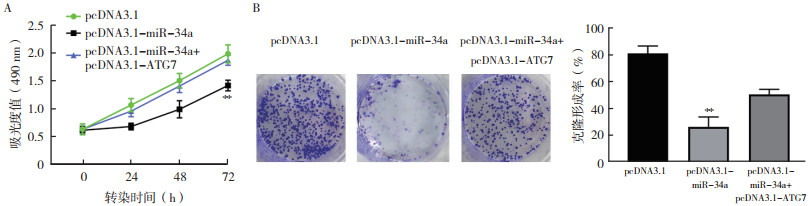
|
| 注 A:CCK-8检测过表达miR-34a和ATG7 72 h后SW480细胞的活性;B:克隆形成检测过表达miR-34a和ATG7 10 d后SW480细胞的增殖效果;**与pcDNA3.1和pcDNA3.1-miR-34a+pcDNA3.1-ATG7比较,均P < 0.01 图 7 过表达miR-34a和ATG7对结直肠癌细胞SW480增殖的影响 Fig.7 Effects of overexpression of miR-34a and ATG7 on the proliferation of colorectal cancer cell SW480 |
结直肠癌是世界上第三大常见的癌症,其发病率和死亡率在全球范围内呈上升趋势[1]。结直肠癌是一种异质性疾病,其进展是由特殊的基因改变引起的。明确结直肠癌发生和发展的分子机制,有助于为肿瘤的预防和治疗提供靶点,改善患者预后。
miRNA的发现扩大了经典肿瘤抑制因子和癌基因的范围。miRNA在各种癌症的发生和发展过程中经历了广泛的改变,包括在结直肠癌中[16]。潜在的肿瘤抑制因子miR-34a在许多类型的癌症中经常被下调[17]。研究表明,miR-34a/b/c通过下调多靶点mRNA抑制抑癌基因Apc丢失引起的肿瘤形成[18]。本研究发现,miR-34a在结直肠癌组织和细胞中的表达水平低于配对的正常结直肠组织和细胞,且过表达miR-34a抑制结直肠癌细胞活性。
自噬与结直肠癌的发生和发展密切相关,miRNA作为自噬的关键调控因子,其介导的转录和转录后水平调控在结直肠癌细胞自噬中起着重要作用[8]。研究表明,miR-34a通过靶向ATG5抑制神经母细胞瘤的进展[19]。ATG7是自噬发展进程中2个泛素样结合系统中的E1样活化酶,可激活ATG12使其与ATG5结合,还可激活ATG8家族蛋白如LC3使之与磷脂酰乙醇胺结合。这2个系统是ATG8与自噬小体膜结合所必需的[20]。本研究评估miR-34a与自噬的关系,通过Western blot和免疫荧光分析证明,miR-34a的上调抑制结直肠癌细胞自噬。进一步探究证实,miR-34a可以与ATG7直接结合,为抑制结直肠癌细胞自噬提供支持。miRNA被认为通过调节结直肠癌细胞自噬水平来增加或降低放化疗敏感性,对结直肠癌的治疗具有潜在的应用价值。例如,miR-22抑制自噬并促进细胞凋亡,从而提高5-FU治疗在结直肠癌细胞中的敏感性[21]。miR-543是结直肠癌的促癌因子,可能通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)途径参与调节自噬从而影响化疗的效果[22]。相反,miR-183-5p直接作用于ATG5,以增强结直肠癌的抗放疗性[23]。而miR-34a在结直肠癌自噬中的研究尚无报道。本研究有望为结直肠癌靶向治疗提供一定借鉴意义。
综上所述,本研究提示,miR-34a在结直肠癌的发展过程中扮演着抑癌基因的角色,能够通过抑制自噬抑制结直肠癌细胞的增殖。本研究结果可能为结直肠癌的靶向治疗提供新的方向。
| [1] |
Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(3): 145-164. DOI:10.3322/caac.21601 |
| [2] |
Ogunwobi OO, Mahmood F, Akingboye A. Biomarkers in colorectal cancer: current research and future prospects[J]. Int J Mol Sci, 2020, 21(15): E5311. DOI:10.3390/ijms21155311 |
| [3] |
Wang H. microRNAs and apoptosis in colorectal cancer[J]. Int J Mol Sci, 2020, 21(15): E5353. DOI:10.3390/ijms21155353 |
| [4] |
彭小波, 苏晓菊, 王一然, 等. microRNA-122抑制胰腺癌细胞增殖、迁移和侵袭[J]. 实用肿瘤杂志, 2021, 36(1): 23-27. |
| [5] |
杨清, 杨海松, 张世泳, 等. miRNA-27a在人乳腺癌MCF-7/ADR细胞株中的表达及其对细胞耐药的影响[J]. 实用肿瘤杂志, 2021, 36(1): 28-32. |
| [6] |
Ali Syeda Z, Langden SSS, Munkhzul C, et al. Regulatory mechanism of microRNA expression in cancer[J]. Int J Mol Sci, 2020, 21(5): 1723. DOI:10.3390/ijms21051723 |
| [7] |
Pidíkova P, Reis R, Herichova I. miRNA clusters with down-regulated expression in human colorectal cancer and their regulation[J]. Int J Mol Sci, 2020, 21(13): E4633. DOI:10.3390/ijms21134633 |
| [8] |
Long JL, He QL, Yin YT, et al. The effect of miRNA and autophagy on colorectal cancer[J]. Cell Prolif, 2020, 53(10): e12900. |
| [9] |
Zhang QY, Wang JY, Li N, et al. miR-34aincreases the sensitivity of colorectal cancer cells to 5-fluorouracil in vitro and in vivo[J]. Am J Cancer Res, 2018, 8(2): 280-290. |
| [10] |
Zhu W, Long JL, Yin YT, et al. microRNA-34a suppresses the invasion and migration of colorectal cancer cells by enhancing EGR1 and inhibiting vimentin[J]. Exp Ther Med, 2019, 18(4): 2459-2466. |
| [11] |
Kardideh B, Samimi Z, Norooznezhad F, et al. Autophagy, cancer and angiogenesis: where is the link?[J]. Cell Biosci, 2019, 9: 65. DOI:10.1186/s13578-019-0327-6 |
| [12] |
Johansen T, Lamark T. Selective autophagy: ATG8 family proteins, LIR motifs and cargo receptors[J]. J Mol Biol, 2020, 432(1): 80-103. DOI:10.1016/j.jmb.2019.07.016 |
| [13] |
Mowers EE, Sharifi MN, MacLeod KF. Functions of autophagy in the tumor microenvironment and cancer metastasis[J]. FEBS J, 2018, 285(10): 1751-1766. DOI:10.1111/febs.14388 |
| [14] |
Gil J, Karpiński P, Sąsiadek MM. Transcriptomic profiling for the autophagy pathway in colorectal cancer[J]. Int J Mol Sci, 2020, 21(19): E7101. DOI:10.3390/ijms21197101 |
| [15] |
Zhuo JW, Wang XY. Combination of targeting CD24 and inhibiting autophagy suppresses the proliferation and enhances the apoptosis of colorectal cancer cells[J]. Mol Med Rep, 2019, 20(1): 539-548. |
| [16] |
Dong JY, Tai JW, Lu LF. miRNA-microbiota interaction in gut homeostasis and colorectal cancer[J]. Trends Cancer, 2019, 5(11): 666-669. DOI:10.1016/j.trecan.2019.08.003 |
| [17] |
Zhang L, Liao Y, Tang LL. microRNA-34 family: a potential tumor suppressor and therapeutic candidate in cancer[J]. J Exp Clin Cancer Res, 2019, 38(1): 53. DOI:10.1186/s13046-019-1059-5 |
| [18] |
Jiang LC, Hermeking H. miR-34aand miR-34b/c suppress intestinal tumorigenesis[J]. Cancer Res, 2017, 77(10): 2746-2758. DOI:10.1158/0008-5472.CAN-16-2183 |
| [19] |
Cheng XR, Xu QY, Zhang YX, et al. miR-34ainhibits progression of neuroblastoma by targeting autophagy-related gene 5[J]. Eur J Pharmacol, 2019, 850: 53-63. DOI:10.1016/j.ejphar.2019.01.071 |
| [20] |
Zheng W, Xie WW, Yin DY, et al. ATG5 and ATG7 induced autophagy interplays with UPR via PERK signaling[J]. Cell Commun Signal, 2019, 17(1): 42. DOI:10.1186/s12964-019-0353-3 |
| [21] |
Zhang HH, Tang JL, Li C, et al. miR-22 regulates 5-FU sensitivity by inhibiting autophagy and promoting apoptosis in colorectal cancer cells[J]. Cancer Lett, 2015, 356(2 Pt B): 781-790. |
| [22] |
Liang Y, Zhu DX, Zhu LM, et al. Dichloroacetate overcomes oxaliplatin chemoresistance in colorectal cancer through the miR-543/PTEN/Akt/mTOR pathway[J]. J Cancer, 2019, 10(24): 6037-6047. DOI:10.7150/jca.34650 |
| [23] |
Zheng S, Zhong YF, Tan DM, et al. miR-183-5p enhances the radioresistance of colorectal cancer by directly targeting ATG5[J]. J Biosci, 2019, 44(4): 92. DOI:10.1007/s12038-019-9918-y |
 2022, Vol. 37
2022, Vol. 37


