文章信息
- 卢燕
- 乳腺实性乳头状癌二例
- 实用肿瘤杂志, 2020, 35(4): 366-368
-
作者简介
- 卢燕(1987-),女,浙江绍兴人,硕士,从事临床病理诊断研究.
-
通信作者
- 卢燕,E-mail:luyan198763@126.com
-
文章历史
- 收稿日期:2019-06-19
病例1,患者女性,60岁。2015年10月9日因发现乳腺结节1年于绍兴市中心医院就诊,行B型超声检查示,左乳内上象限见低回声区,范围约12 mm×4 mm,外形不规则。2015年10月28日行左乳腺癌改良根治术。病理检查示:巨检为乳腺组织局灶剖面见一灰红色结节,大小约2.0 cm×1.8 cm×1.5 cm,质中偏硬,界欠清;镜检示, 肿瘤细胞呈多结节巢状生长,边缘光滑,巢内见纤细的纤维血管轴心,部分细胞内外可见黏液。细胞大小、形态均一,胞质粉染、细颗粒状。局灶细胞巢边缘不规整,周围见大量黏液湖,且黏液分隔纤维间质(图 1A)。免疫表型示:雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor, PR)、嗜铬素A(chromogranin A, CgA)和突触素(synaptophysin,Syn)阳性(图 1B),人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)和p53阴性,Ki-67约5%~10%阳性,p63及平滑肌肌动蛋白(smooth muscle actin,SMA)细胞巢周及纤维血管轴心周均阳性,但局灶细胞巢周围较多黏液区阴性。病理诊断为乳腺实性乳头状癌(solid papillary carcinoma,SPC),局灶浸润间质(直径 > 1 mm)。术后每6个月进行随诊复查,至2019年4月6日未发现肿瘤复发及转移。
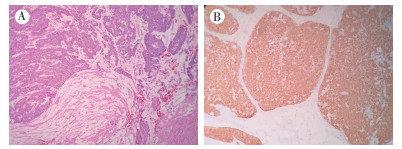
|
| 注 A:肿瘤细胞巢周围见大量黏液,分割纤维间质(HE×100);B:免疫表型Syn阳性(SP×100) 图 1 病例1肿瘤组织形态特征及免疫表型 |
病例2,患者女性,63岁。2016年1月19日因发现左乳结节3 d就诊于绍兴市中心医院,行B型超声检查示,左乳内下象限可见低回声团块29 mm×14 mm,外形不规则,分叶状,回声不均。2016年1月21日行左乳腺癌改良根治术。病理检查示:巨检为乳腺组织内局灶剖面见一灰白、灰黄色结节,大小约2.5 cm×1.5 cm×1.0 cm,质硬,界清;镜检示,肿瘤细胞呈多结节实性生长(图 2A),实性细胞巢内见纤细的纤维血管轴心,部分肿瘤细胞内可见黏液(图 2B),似印戒细胞样,纤维血管轴心内可见泡沫细胞。免疫表型示:ER、PR、CgA和Syn阳性,HER2和p53阴性,Ki-67约10%阳性,p63及SMA细胞巢周及纤维血管轴心周均阳性。病理诊断为SPC。术后每6个月进行随诊复查,至2019年5月31日未发现肿瘤复发及转移。
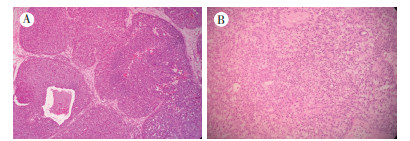
|
| 注 A:肿瘤细胞巢呈实性结节状生长(HE×100);B:实性细胞巢内见黏液(HE×200) 图 2 病例2肿瘤组织形态特征 |
乳腺SPC是一种少见的低度恶性肿瘤[1]。1995年由Maluf等[2]首次报道此肿瘤,称其为神经内分泌导管内癌。2003年乳腺肿瘤WHO组织学分类将其列为导管内乳头状癌的实体变型[3]。2012年最新版WHO乳腺肿瘤分类中首次将其归入为乳腺癌的一种特殊亚型,命名为实性乳头状癌,并且分为原位实性乳头状癌和实性乳头状癌伴浸润2类[4]。
SPC发生于老年女性,临床多表现为乳头溢液[5]或乳腺结节、肿块,而本文2例患者均表现为乳腺结节。彩超为首选的检查方法。彩超表现为分叶状肿块、均匀的实性结节或复杂的腔内病变[6]。SPC临床表现无特异性,其诊断主要靠病理组织学检查。SPC显微镜下表现为多结节实性细胞巢,部分可呈囊实性,巢团内可见纤维血管轴心,细胞围绕纤维血管轴心可呈假菊形团,细胞内外可产生黏液。细胞均一,异型性小,轻~中度异型性,胞质粉染,细胞核圆形、卵圆形或梭形,可见核分裂相。免疫组织化学呈神经内分泌分化,Syn及CgA阳性。大部分SPC神经内分泌标记阳性,但却不是诊断SPC所必需的[7],因有报道部分病例肿瘤细胞神经内分泌标记阴性[8],Ki-67指数低,ER和PR阳性,HER2阴性。
SPC诊断争议最多的是判断是否浸润。李香丹等[9]研究报道,原位SPC纤维血管轴心周及细胞巢周肌上皮阳性,可表达为灶性阳性,非完整性或连续性完整阳性。吴焕文等[10]研究同样表明,多数SPC中肿瘤细胞巢周及纤维血管轴心周存在肌上皮,但当细胞巢膨胀性生长压迫肌上皮时,肌上皮数目较正常导管减少,即表现为不连续阳性或灶性阳性。相反,部分研究报道,原位SPC几乎所有细胞巢周肌上皮SMA和p63均阴性,提示SPC可能是一种具有推挤性生长的浸润性癌[11-12]。Rohilla等[13]研究表明,导管内癌导管周围的肌上皮标记阳性率降低,故即使肿瘤细胞巢周围肌上皮标记阴性,但细胞巢边缘光滑平整,也应考虑为原位癌。故即使肿瘤细胞巢周肌上皮缺失,也不一定诊断为浸润[14-15]。目前判断SPC浸润均没有统一的标准。2012年乳腺肿瘤WHO分类中提到若肿瘤是否浸润不明确时,应视为原位癌[4]。在实际工作中判断SPC浸润尤为困难,需要认真发现浸润的诊断线索,从而得出结论。判断浸润的诊断线索有:(1)肌上皮缺失;(2)肿瘤细胞形态和结构突然改变,如细胞异型性增大,细胞巢边缘不规整,呈地图状、锯齿状边缘;(3)细胞巢周围出现大量黏液,且黏液分割纤维间质;(4)细胞巢边缘不规整,周围出现纤维间质反应。
当SPC的细胞巢内及周围有较多黏液时,需与富细胞型黏液腺癌鉴别,后者黏液湖明显,细胞巢散于黏液湖中,细胞巢内未见纤维血管轴心。在例1中,局灶区域黏液湖明显,细胞巢散在黏液湖中,具富细胞型黏液腺癌的特点,但细胞巢内散在小黏液湖,且细胞巢内可见纤细的纤维血管轴心,此为实性乳头状癌的特点。局灶细胞巢边界不规则,细胞巢周围有黏液外溢,分隔纤维间质,且此区域细胞巢周围无肌上皮标记。结合文献[11]报道,若SPC细胞巢周围有黏液成分时,10年后可发生转移,故例1病理诊断考虑局灶浸润间质。
SPC还需与乳腺小叶肿瘤鉴别:均呈结节状膨胀性生长,后者细胞松散,细胞膜不明显,细胞巢内无纤维血管轴心可鉴别。与导管内乳头状肿瘤鉴别:后者纤维血管轴心粗大、明显,即乳头结构明显,细胞内外无黏液,无神经内分泌分化。与导管内癌鉴别:后者也呈结节状生长,但无纤维血管轴心,细胞内外无黏液。
SPC具有惰性的生物学行为,目前尚未找到靶点药物进行治疗[16]。外科治疗仍然是乳腺癌的综合治疗中的重要组成部分[17]。临床肿瘤手术切除后生存期较长,只要足够范围的局部手术完整切除即可[4, 18],预后较好, 极少有原位SPC复发及淋巴结转移报道。但如果伴浸润或伴其他浸润癌,那此肿瘤的预后就要依据其浸润癌的成分[11, 19]。
| [1] |
Saremian J, Rosa M. Solid papillary carcinoma of the breast:a pathologically and clinically distinct breast tumor[J]. Arch Pathol Lab Med, 2012, 136(10): 1308-1311. DOI:10.5858/arpa.2011-0227-RS |
| [2] |
Maluf HM, Koerner FC. Solid papillary carcinoma of the breast:a form of intraductal carcinoma with endocrine differentiation frequently associated with mucinous carcinoma[J]. Am J Surg Pathol, 1995, 19(11): 1237-1244. DOI:10.1097/00000478-199511000-00003 |
| [3] |
Tavassoli FA, Devilee P. World health orgarization classification of tumors.Pathology and genetics, tumors of the breast and female genital organs[M]. Lyon: IARC Press, 2003: 85-90.
|
| [4] |
Lakhani SR, Ellis IO, Schinitt SJ, et al. WHO classification of tumors of the breast[M]. Lyon: IARC Press, 2012: 108-110.
|
| [5] |
刘丽丽, 陈定宝, 王思源, 等. 44例乳腺实性乳头状癌临床与病理学特征分析[J]. 中华普通外科杂志, 2019, 34(9): 776-778. DOI:10.3760/cma.j.issn.1007-631X.2019.09.008 |
| [6] |
Lam WW, Chu WC, Tang AP, et al. Role of radiologic features in the management of papillary lesions of the breast[J]. AJR Am J Roentgend, 2006, 185(5): 1322-1327. |
| [7] |
Otsuki Y, Yamada M, Shimizn S, et al. Solid papillary carcinoma of the breast:Clinicopathological study of 20 cases[J]. Pathol Int, 2007, 57(7): 421-429. DOI:10.1111/j.1440-1827.2007.02118.x |
| [8] |
Nassar H. Solid papillary carcinoma of the breast[J]. Pathol Case Rev, 2009, 14(4): 157-161. DOI:10.1097/PCR.0b013e3181b6ad5d |
| [9] |
李香丹, 杨文涛, 孙抒, 等. 乳腺实性乳头状癌73例临床病理诊断[J]. 临床与实验病理学杂志, 2010, 26(1): 35-39. DOI:10.3969/j.issn.1001-7399.2010.01.009 |
| [10] |
吴焕文, 刘旭光, 李俊杰, 等. 乳腺实性乳头状癌中的肌上皮细胞改变[J]. 诊断病理学杂志, 2017, 24(12): 892-896. DOI:10.3969/j.issn.1007-8096.2017.12.003 |
| [11] |
杨苗苗, 翁海燕, 孟刚. 乳腺实性乳头状癌临床病理学特征[J]. 临床与实验病理学杂志, 2014, 30(5): 491-494. |
| [12] |
Nassar H, Qureshi H, Volkanadsay N, et al. Clinicopathologic analysis of solid papillary carcinoma of the breast and associated invasive carcinomas[J]. Am J sung Pathol, 2006, 30(4): 501-507. DOI:10.1097/00000478-200604000-00011 |
| [13] |
Rohilla M, Bal A, Singh G, et al. Phenotypic and functional characterization of ductal carcinoma in situe associated myoepithelial cells[J]. Clin Breast Cancer, 2015, 15(5): 335-342. DOI:10.1016/j.clbc.2015.01.004 |
| [14] |
陈文静, 张江宇, 陈中扬, 等. 乳腺实性乳头状癌临床病理特征及预后分析[J]. 实用医学杂志, 2018, 34(10): 1594-1597. DOI:10.3969/j.issn.1006-5725.2018.10.004 |
| [15] |
Tan BY, Thike AA, Ellis IO, et al. Clinicopathologic characteristic of solid papillary carcinoma of the breast[J]. Am J Surg Pathol, 2016, 40(10): 1334-1342. DOI:10.1097/PAS.0000000000000702 |
| [16] |
宋尔卫, 龚畅, 金歆. 乳腺癌转化医学研究的热点问题及思考[J]. 实用医学杂志, 2017, 33(1): 1-6. DOI:10.3969/j.issn.1006-5725.2017.01.001 |
| [17] |
周美琪, 邱吉利, 陈嘉妮, 等. 乳腺癌外科治疗的个体化精准之路[J]. 实用肿瘤杂志, 2018, 33(4): 377-382. |
| [18] |
Guo S, Wang Y, Rohr J, et al. Solid papillary carcinoma of the breast:a special entity needs to be distinguished form conventional invasive carcinoma avoiding over-treatment[J]. Breast, 2016, 26(4): 67-72. |
| [19] |
胡锦涛, 成志强, 邵牧民, 等. 乳腺实性乳头状癌伴浸润性癌临床病理分析[J]. 临床与实验病理学杂志, 2016, 32(11): 1203-1206. |
 2020, Vol. 35
2020, Vol. 35


