文章信息
- 罗雪娥, 周宁, 唐宏英
- Luo Xuee, Zhou Ning, Tang Hongying
- 循环miR-1229作为原发性肝细胞癌诊断与预后生物标志物的价值分析
- Value of circulating miR-1229 as a diagnostic and prognostic biomarker for primary hepatocellular carcinoma
- 实用肿瘤杂志, 2020, 35(4): 349-354
- Journal of Practical Oncology, 2020, 35(4): 349-354
基金项目
- 湖南省人民医院青年博士基金(BSJJ201808)
-
作者简介
- 罗雪娥(1984-), 女, 湖南长沙人, 主治医师, 从事肝胆外科临床和基础研究.
-
通信作者
- 唐宏英,E-mail:tanghylady79@aliyun.com
-
文章历史
- 收稿日期:2019-07-15
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的消化道恶性肿瘤。随着酒精性脂肪肝的增加和肝炎病毒的传播,我国已成为HCC发病率最高的国家之一[1]。尽管近年来诊断和治疗技术的不断进步,但HCC患者术后的肿瘤复发及转移率仍然很高,因而导致患者5年总体生存率很不理想[2-3]。HCC的发生与进展是十分复杂的多因素过程,涉及肿瘤本身和微环境中复杂信号传导途径的异常调节[4-6]。因此,迫切需要找到与HCC进展相关的重要分子机制,以提高HCC的诊断和治疗效率,改善患者的生活质量。微小RNA(microRNA,miRNA)是一种19~25个核苷酸长度的非编码RNA,主要在转录后水平调节基因表达[7]。在过去十几年中,由于miRNA在癌组织与细胞中的表达差异性,且在控制癌症发生过程中的基础作用而受到广泛关注[8]。
近年来,研究者发现,循环miRNA是一种新型的细胞外信号分子,能在各种体液中被检测出来,如血液、乳汁、眼泪、唾液、尿液、脑脊髓、精液和腹腔积液等[9]。基于非凡的稳定性,较不复杂的化学结构和缺乏后处理修饰,循环miRNA被认为是癌症和其他疾病的最佳生物标志物[10-11]。循环miRNA可与血清蛋白和脂蛋白结合,也可包裹到细胞外囊泡中,包括外泌体、微泡或凋亡小体,并在细胞通讯中发挥重要作用[12]。原发性结直肠癌患者血清中循环miR-1229的表达水平高于健康对照者,循环miR-1229可作为结肠癌诊断的有希望的生物标志物[13]。然而,循环miR-1229在HCC诊断与预后中的价值仍然未知。本研究分析循环miR-1229在HCC血清中的表达特征,并评估其作为HCC诊断与预后生物标志物的潜在价值。
1 资料与方法 1.1 一般资料 1.1.1 仪器与试剂常温-低温冷冻离心机购自德国Eppendorf公司。-80℃超低温冰箱购自日本SANYO公司。高压蒸汽灭菌锅购自美国Invitrogen公司。Prism 7900HT/FAST荧光定量PCR仪购自美国ABI公司。NanoDrop 2000/2000c紫外-可见分光光度计购自美国Thermo Fisher Scientific公司。RNAiso Blood购自日本Takara公司。逆转录及qRT-PCR试剂购自美国Promega公司。
1.1.2 外周血标本收集2006年6月1日至2012年12月31日本院肝胆外科确诊的HCC患者(HCC组)与2015年1月1日至2018年10月31日本院体检的健康者(对照组)各150例的外周血标本5 mL,常规分离血清后立即放置于液氮保存备用。HCC患者中男性87例,女性63例。年龄19~75岁,(54.36±5.70)岁;健康者中男性95例,女性55例。年龄23~59岁,(47.10±6.39)岁。所有HCC患者术前6个月内均未接受化疗、放疗或经皮消融治疗。入院后详细收集HCC患者的临床信息,包括年龄、性别、乙肝表面抗原(hepatitis B surface antigen,HBsAg)、甲胎蛋白(α-fetoprotein,AFP)水平、肿瘤体积、分化程度、TNM分期、巴塞罗那(barcelona-clinic liver cancer,BCLC)分期、淋巴结转移及远处转移等,术后随访时间为5年。本研究已通过湖南省人民医院伦理委员会审批,所有患者均签署知情同意书。
1.2 方法 1.2.1 RNA提取取1 mL血清样本添加3 mL RNAiso Blood,常温静置5 min。添加800 μL氯仿溶液,常温静置5 min。在4℃、13 000 r/min条件下离心15 min,收集上清液。添加800 μL异丙醇,常温静置10 min。在4℃、13 000 r/min条件下离心10 min,丢弃上清液,保留沉淀。添加1 mL 75%乙醇溶液,常温静置5 min。在4℃、13 000 r/min条件下离心5 min,丢弃上清液,保留沉淀。添加10 μL无RNA酶去离子水溶解沉淀,静置5 min使沉淀充分溶解,将RNA定量后置于-80 ℃冰箱中保存备用。
1.2.2 逆转录实验采用无RNA酶去离子水将RNA样本浓度调定为1 μg/μL。取1 μg RNA进行逆转录合成cDNA。反应总体积为10 μL,包括RNA 1 μL,逆转录试剂5 μL和无RNA酶去离子水4 μL。反应温度条件如下:70℃10 min,42℃15 min,95℃5 min,4℃5 min。将合成的cDNA放置于-80℃冰箱中保存备用。
1.2.3 qRT-PCR实验取1 μL cDNA为模板进行qRT-PCR实验。反应总体积为20 μL,包括cDNA 1 μL,上游引物和下游引物各0.5 μL,qRT-PCR试剂10 μL和无RNA酶去离子水8 μL。反应温度条件为:95℃20 min,然后98℃20 s,58℃30 s和72℃30 s,随后进行40个循环。miR-1229上游引物为5’-GTGGGTAGGGTTTGGGGGAGA-3’,下游引物为5’-CTGTGGGAGGGCAGTGGTGAG-3’;以人U6核内小RNA(U6)为内参,U6上游引物为5’-CTCGCTTCGGCAGCAC-3’,下游引物为5’-ACGCTTCACGAATTTGC-3’。反应结束后,采用2-ΔΔCt法[14]计算循环miR-1229的表达水平,ΔΔCt=Δ(Ct癌组织miR-1229-Ct癌组织U6) - Δ(Ct癌旁组织miR-1229-Ct癌旁组织U6)。实验独立重复≥3次。
1.3 随访所有患者从手术结束后开始随访,随访时间范围为60个月。采用电话方式随访,每隔3个月随访1次,主要询问患者的近期生存状况及肿瘤复发情况。若患者中途因肿瘤出现死亡,则随访结束;若患者中途失访,则将该患者记录为删失患者。生存时间定义为手术到死亡或手术到最后随访时间。
1.4 统计学分析采用SPSS 17.0软件进行统计学分析。计量数据采用均数±标准差(x±s)表示。通过配对t检验分析循环miR-1229在HCC和健康者血清中的表达差异。通过χ2检验分析循环miR-1229的表达水平与HCC患者临床病理特征的关系。通过Kaplan-Meier与log-rank法评估循环miR-1229的表达水平与HCC预后的关系。通过受试者工作特征(receiver operating characteristic,ROC)曲线评估循环miR-1229对HCC诊断的特异度和敏感度。以P < 0.05为差异具有统计学意义。
2 结果 2.1 循环miR-1229在HCC血清中的表达水平HCC组血清中循环miR-1229表达水平高于对照组[(1.50±0.54) vs (0.94±0.39),P < 0.05;图 1A)。淋巴结转移阳性患者血清中循环miR-1229表达水平高于阴性患者[(1.85±0.48) vs (1.19±0.45),P < 0.05;图 1B]。
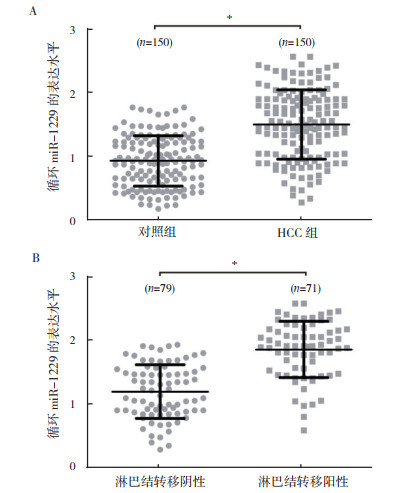
|
| 注 A: HCC组和对照组血清中循环miR-1229的表达水平;B: HCC淋巴结转移阳性及阴性患者血清中循环miR-1229的表达水平;* P < 0.05 图 1 HCC患者血清中循环miR-1229的表达情况 Fig.1 Expression of circulating miR-1229 in serum from HCC patients |
根据循环miR-1229在HCC血清中表达水平的中位数值(1.48)为临界点,将150例HCC患者分为低表达循环miR-1229组(低miR-1229组)和高表达循环miR-1229组(高miR-1229组),每组各75例。高miR-1229组和低miR-1229组在淋巴结转移和远处转移方面比较,差异均具有统计学意义(均P < 0.01,表 1),但在年龄、性别、HBsAg、AFP水平、肿瘤体积、分化程度、TNM分期及BCLC分期方面比较,差异均无统计学意义(均P > 0.05)。
| 临床病理特征 | 例数 | 低miR-1229组(n=75) | 高miR-1229组(n=75) | χ2值 | P值 |
| 年龄 | 1.06 | 0.30 | |||
| < 60岁 | 52(34.7) | 23(15.3) | 29(19.3) | ||
| ≥ 60岁 | 98(65.3) | 52(34.7) | 46(30.7) | ||
| 性别 | 1.34 | 0.25 | |||
| 男性 | 87(58.0) | 40(26.7) | 47(31.3) | ||
| 女性 | 63(42.0) | 35(23.3) | 28(18.7) | ||
| HBsAg | 2.06 | 0.15 | |||
| 否 | 44(29.3) | 18(12.0) | 26(17.3) | ||
| 是 | 106(70.7) | 57(38.0) | 49(32.7) | ||
| AFP水平 | 0.68 | 0.41 | |||
| < 20 ng/mL | 65(43.3) | 30(20.0) | 35(23.3) | ||
| ≥20 ng/mL | 85(56.7) | 45(30.0) | 40(26.7) | ||
| 肿瘤体积 | 0.87 | 0.35 | |||
| < 5 cm | 39(26.0) | 17(11.3) | 22(14.7) | ||
| ≥5 cm | 111(74.0) | 58(38.7) | 53(35.3) | ||
| 分化程度 | 0.74 | 0.39 | |||
| 良 | 26(17.3) | 11(7.3) | 15(10.0) | ||
| 中等~差 | 124(82.7) | 64(42.7) | 60(40.0) | ||
| TNM分期 | 0.82 | 0.37 | |||
| Ⅰ~Ⅱ期 | 43(28.7) | 19(12.7) | 24(16.0) | ||
| Ⅲ~Ⅳ期 | 107(71.3) | 56(37.3) | 51(34.0) | ||
| BCLC分期 | 0.45 | 0.50 | |||
| A~B | 58(38.7) | 27(18.0) | 31(20.7) | ||
| C~D | 92(61.3) | 48(32.0) | 44(29.3) | ||
| 淋巴结转移 | 22.49 | < 0.01 | |||
| 否 | 79(52.7) | 25(16.7) | 54(36.0) | ||
| 是 | 71(47.3) | 50(33.3) | 21(14.0) | ||
| 远处转移 | 12.48 | < 0.01 | |||
| 否 | 93(62.0) | 36(24.0) | 57(38.0) | ||
| 是 | 57(38.0) | 39(26.0) | 18(12.0) | ||
| 注HCC:肝细胞癌(hepatocellular carcinoma);HBsAg:乙肝表面抗原(hepatitis B surface antigen);AFP:甲胎蛋白(α-fetoprotein);BCLC:巴塞罗那分期(barcelona-clinic liver cancer) | |||||
循环miR-1229区分HCC患者与健康者的ROC曲线曲线下面积(area under curve,AUC)为0.79,敏感度为68.5 %,特异度为77.5 %(P < 0.05,图 2A)。循环miR-1229区分淋巴结转移阳性患者与淋巴结转移阴性患者的AUC为0.86,敏感度为71.9 %,特异度为82.2%(P < 0.05,图 2B)。
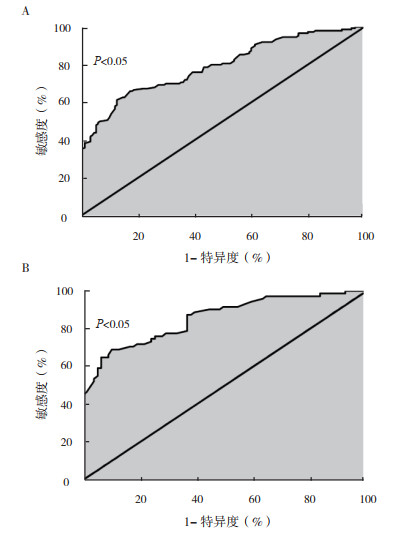
|
| 注 A:循环miR-1229对HCC的诊断价值;B:循环miR-1229对淋巴结转移的诊断价值 图 2 ROC曲线分析循环miR-1229对HCC患者及淋巴结转移情况的诊断价值 Fig.2 ROC curves of the diagnostic value of circulating miR-1229 for HCC and lymph node metastasis |
高miR-1229组患者5年总体生存率低于低miR-1229组患者(20.0% vs 26.7%,HR=1.47,95% CI: 1.01~2.14,P < 0.05;图 3)。
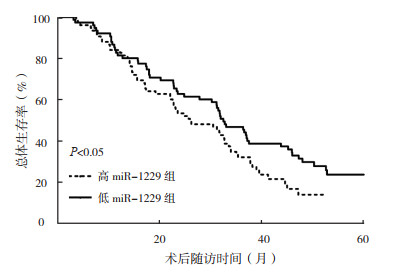
|
| 图 3 高miR-1229组和低miR-1229组HCC患者总生存曲线比较 Fig.3 Comparison of overall survival curves of HCC patients with high and low miR-1229 expression |
手术切除仍然是HCC患者最主要的治疗方法,但由于缺乏有效的早期诊断方法,仅30%~40%的患者在确诊时可行手术治疗。AFP是一种常见的用于HCC筛查的肿瘤生物标志物,但其在早期HCC筛查中的诊断效率仍不能令人满意[15]。因此,迫切需要鉴定新型的生物标志物用于早期HCC筛查。近年来,miRNA在各种癌症的发生和发展中作为重要调节分子起作用,而受到越来越多的关注。最近,miRNA被发现在血液中以无细胞形式循环,并证实循环miRNA在HCC中具有较高诊断和预后价值[16-17]。Guo等[18]报道循环miR-21在HCC患者血清中高表达,与临床分期和远处转移有关,且循环miR-21对HCC具有良好的诊断价值,AUC为0.83,敏感度为81.2%,特异度为83.2%。低表达循环miR-26a/29a可作为HCC患者根治术后预后不良的标志物[19]。循环miR-1246在早期肿瘤复发的HCC患者中表达上调,与淋巴结转移、肿瘤分化和门静脉侵袭相关,循环miR-1246对具有早期肿瘤复发的HCC具有较高的诊断价值[20]。循环miR-101-3p、miR-106b-3p与miR-1246(单独或组合)作为HCC的诊断生物标志物也具有潜在价值[21]。循环miRNA作为生物标志物具有如下的优点:(1)稳定性高,不易被降解;(2)肿瘤早期可检测到表达变化;(3)检测时所需样本量少,检测方法相对简单。然而,关于循环miR-1229在HCC诊断与预后中的价值仍然未知。
miR-1229位于5q35.3染色体上,在一些癌症中被发现表达失调,包括胃癌、乳腺癌和结肠癌等[13]。循环miR-1229水平在结直肠癌患者血清中上调,并且与肿瘤大小、淋巴转移、TNM分期和预后不良相关,过表达循环miR-1229通过靶向同源域相互作用蛋白激酶2(homeodomain-interacting protein kinase 2, HIPK2)促进血管生成[22]。miR-1229在乳腺癌中表达上调且与预后不良相关[23]。过表达miR-1229抑制体外乳腺癌细胞增殖与裸鼠体内肿瘤生长。miR-1229过表达通过直接靶向腺瘤性结肠息肉(denomatous polyposis coli,APC)、糖原合酶激-3β(glycogen synthase kinase 3 beta,GSK-3β)、β-连环蛋白和T细胞因子抑制物(T cytokine inhibitor,ICAT)激活乳腺癌中的Wnt/β-catenin信号通路而促进肿瘤生长。本研究通过收集150例HCC患者与150例健康者的外周血标本,采用qRT-PCR检测血清中循环miR-1229的表达水平,发现HCC患者中循环miR-1229的表达水平高于健康者,且淋巴结转移阳性患者血清中循环miR-1229的表达水平高于淋巴结转移阴性患者。该结果与已报道的研究结果一致[22-23]。本研究还发现,循环miR-1229在Ⅰ~Ⅱ期HCC患者血液中表达升高,提示循环miR-1229对HCC早期诊断可能具有一定的参考价值。
本研究对循环miR-1229表达水平与HCC患者临床病理特征的关系的分析结果显示,循环miR-1229表达水平在淋巴结转移及远处转移方面比较,差异均具有统计学意义(均P < 0.05),但在年龄、性别、HBsAg、AFP水平、肿瘤体积、分化程度、TNM分期及BCLC分期方面比较,差异均无统计学意义(均P > 0.05)。ROC曲线显示,循环miR-1229对HCC及淋巴结转移具有较高的诊断价值,AUC分别为0.79和0.86,敏感度分别为68.5 %和71.9 %,特异度分别为77.5%和82.2%。该结果与循环miR-1229在结直肠癌中的诊断价值基本一致[22],表明循环miR-1229可用于HCC的诊断和区分HCC的淋巴结转移状态。目前HCC的预后监测缺乏有效的标志物。本研究发现,循环miR-1229与HCC预后相关,高表达循环miR-1229患者5年总体生存率低于低表达循环miR-1229患者,表明循环miR-1229作为HCC预后的生物标志物可能具有较高的潜在价值。本研究存在的一些不足:(1)本研究本质上是单中心回顾性研究,因此可能存在选择偏倚;(2)临床样本数量仍不够大;(3)未能将几种消化系统肿瘤作为对照。因此,本研究组计划进行前瞻性大规模和多中心研究,以进一步阐明循环miR-1229在HCC诊断与预后中的价值,目前该研究正在积极准备中。
综上所述,本研究发现,循环miR-1229在HCC中表达上调,并与淋巴结及远处转移相关。循环miR-1229对HCC及淋巴结转具有较高的诊断价值并与预后相关。高表达循环miR-1229提示HCC患者预后不良,表明循环miR-1229可能为一种新的HCC诊断与预后的生物标志物。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
何明燕, 夏景林. 肝癌精准医学之路:面临的挑战[J]. 实用肿瘤杂志, 2018, 33(1): 34-37. |
| [3] |
孙惠川, 王征, 周俭, 等. 2017年版中国肝癌诊断和治疗规范解读[J]. 实用肿瘤杂志, 2018, 33(1): 1-3. |
| [4] |
Chen C, Lou T. Hypoxia inducible factors in hepatocellular carcinoma[J]. Oncotarget, 2017, 8(28): 46691-46703. DOI:10.18632/oncotarget.17358 |
| [5] |
Moon H, Cho K, Shin S, et al. High risk of hepatocellular carcinoma development in fibrotic liver:role of the hippo-YAP/TAZ signaling pathway[J]. Int J Mol Sci, 2019, 20(3): 581. DOI:10.3390/ijms20030581 |
| [6] |
Vilchez V, Turcios L, Marti F, et al. Targeting Wnt/beta-catenin pathway in hepatocellular carcinoma treatment[J]. World J Gastroenterol, 2016, 22(2): 823-832. DOI:10.3748/wjg.v22.i2.823 |
| [7] |
Michlewski G, Caceres JF. Post-transcriptional control of miRNA biogenesis[J]. RNA, 2019, 25(1): 1-16. DOI:10.1261/rna.068692.118 |
| [8] |
Cheng CJ, Bahal R, Babar IA, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J]. Nature, 2015, 518(7537): 107-110. DOI:10.1038/nature13905 |
| [9] |
Makarova JA, Shkurnikov MU, Turchinovich AA, et al. Circulating microRNAs[J]. Biochemistry (Mosc), 2015, 80(9): 1117-1126. DOI:10.1134/S0006297915090035 |
| [10] |
de Gonzalo-Calvo D, Iglesias-Gutierrez E, LlorenteCortes V. Epigenetic biomarkers and cardiovascular disease:circulating microRNAs[J]. Rev Esp Cardiol (Engl Ed), 2017, 70(9): 763-769. DOI:10.1016/j.recesp.2017.02.027 |
| [11] |
Jamali L, Tofigh R, Tutunchi S, et al. Circulating micro RNAs as diagnostic and therapeutic biomarkers in gastric and esophageal cancers[J]. J Cell Physiol, 2018, 233(11): 8538-8550. DOI:10.1002/jcp.26850 |
| [12] |
Fichtlscherer S, De Rosa S, Fox H, et al. Circulating microRNAs in patients with coronary artery disease[J]. Circ Res, 2010, 107(5): 677-684. |
| [13] |
Ogata-Kawata H, Izumiya M, Kurioka D, et al. Circulating exosomal microRNAs as biomarkers of colon cancer[J]. PLoS One, 2014, 9(4): e92921. DOI:10.1371/journal.pone.0092921 |
| [14] |
Nolan T, Hands RE, Bustin SA. Quantification of mRNA using real-time RT-PCR[J]. Nat Protoc, 2006, 1(3): 1559-1582. DOI:10.1038/nprot.2006.236 |
| [15] |
Wang Y, Zhang C, Zhang P, et al. Serum exosomal microRNAs combined with alpha-fetoprotein as diagnostic markers of hepatocellular carcinoma[J]. Cancer Med, 2018, 7(5): 1670-1679. |
| [16] |
Loosen SH, Schueller F, Trautwein C, et al. Role of circulating microRNAs in liver diseases[J]. World J Hepatol, 2017, 9(12): 586-594. DOI:10.4254/wjh.v9.i12.586 |
| [17] |
Zhang Y, Li T, Qiu Y, et al. Serum microRNA panel for early diagnosis of the onset of hepatocellular carcinoma[J]. Medicine (Baltimore), 2017, 96(2): e5642. DOI:10.1097/MD.0000000000005642 |
| [18] |
Guo X, Lv X, Ma Y, et al. Circulating miR-21 serves as a serum biomarker for hepatocellular carcinoma and correlated with distant metastasis[J]. Oncotarget, 2017, 8(27): 44050-44058. DOI:10.18632/oncotarget.17211 |
| [19] |
Cho HJ, Kim SS, Nam JS, et al. Low levels of circulating microRNA-26a/29a as poor prognostic markers in patients with hepatocellular carcinoma who underwent curative treatment[J]. Clin Res Hepatol Gastroenterol, 2017, 41(2): 181-189. DOI:10.1016/j.clinre.2016.09.011 |
| [20] |
Chuma M, Toyoda H, Matsuzaki J, et al. Circulating microRNA-1246 as a possible biomarker for early tumor recurrence of hepatocellular carcinoma[J]. Hepatol Res, 2019, 49(7): 810-822. |
| [21] |
Moshiri F, Salvi A, Gramantieri L, et al. Circulating miR-106b-3p, miR-101-3p and miR-1246 as diagnostic biomarkers of hepatocellular carcinoma[J]. Oncotarget, 2018, 9(20): 15350-15364. DOI:10.18632/oncotarget.24601 |
| [20] |
Ogata-Kawata H, Izumiya M, Kurioka D, et al. Circulating exosomal microRNAs as biomarkers of colon cancer[J]. PLoS One, 2014, 9(4): e92921. DOI:10.1371/journal.pone.0092921 |
| [23] |
Tan Z, Zheng H, Liu X, et al. MicroRNA-1229 overexpression promotes cell proliferation and tumorigenicity and activates Wnt/beta-catenin signaling in breast cancer[J]. Oncotarget, 2016, 7(17): 24076-24087. DOI:10.18632/oncotarget.8119 |
 2020, Vol. 35
2020, Vol. 35


