文章信息
- 王思斯, 陈明, 孙哲, 林洁涛, 曹洋
- Wang Sisi, Chen Ming, Sun Zhe, Lin Jietao, Cao Yang
- 非小细胞肺癌生存预测列线图的构建与验证
- Development and validation of a nomogram for predicting survival of patients with non-small-cell lung cancer
- 实用肿瘤杂志, 2020, 35(4): 327-335
- Journal of Practical Oncology, 2020, 35(4): 327-335
基金项目
- 广东省自然科学基金(2016A03031364;2017A030313886);中医药防治肺癌转移创新科研团队(2017TD01)
-
作者简介
- 王思斯(1992-), 男, 海南临高人, 硕士生, 从事中西医结合防治肿瘤学研究.
-
通信作者
- 曹洋, E-mail:393556828@qq.com
-
文章历史
- 收稿日期:2019-04-13
2. 广州中医药大学第一附属医院肿瘤中心, 广东 广州 510080
2. Oncology Department, No.1 Affiliated Hospital of Guangzhou University of Traditional Chinese Medicine, Guangzhou 510080, China
肺癌,又称原发性支气管肺癌,起源于支气管黏膜或肺泡细胞,是恶性肿瘤中发病率及死亡率最高的癌种。根据GLOBOCAN预计,2018年全球约有1 810万例新发癌症,其中新发肺癌约209万例,占癌症发病例数的11.6%,死亡病例约176万例,占癌症死亡例数的18.4%,两者均呈缓慢上升阶段[1]。肺癌按病理可分非小细胞肺癌与小细胞肺癌,两者生物学特性、治疗措施和预后各不相同,美国癌症学会(American Cancer Society)2017年数据报告,非小细胞肺癌约占肺癌总数的80%~85%,而小细胞肺癌仅占15%~20%[2]。美国国家癌症研究所统计,2007年至2013年期间肺癌5年总生存率只有18%,其中未转移的非小细胞肺癌5年生存率约为55.6%,区域淋巴结转移的非小细胞肺癌5年生存率约为28.9%,而一旦发生远处转移,5年生存率仅为4.5%。本研究应用美国癌症中心“监测、流行病学和结果”(Surveillance,Epidemiology,and End Results,SEER)数据库中的非小细胞肺癌病例进行统计分析,筛选独立预后因素,建立Cox比例风险模型,并绘制列线图进行可视化,协助临床医师评估病情及治疗决策。
1 资料与方法 1.1 数据来源所有数据来源于SEER数据库,数据集取自SEER 18 Regs Custom Data(with additional treatment fields), Nov 2017 Sub(1973-2015 varying)。研究者注册并登陆SEER*Stat(v8.3.5)软件,以2010年至2015年为时间限定,肺与支气管为部位限定,生存时间 > 1个月为生存期限定,共下载308 561例,作为建模组,提取以下变量:患者编号(Patient ID)、诊断年龄、诊断年份、性别、人种、婚姻状态、肿瘤位置、病理分级、病理类型、TNM分期、肿瘤大小、淋巴结转移情况、远处转移情况、手术与否以及方式、放疗策略、化疗情况、生存状态、生存时间和死亡原因。
按照以下标准进行数据清洗:(1)无明确记录肿瘤大小、淋巴结以及远处肿瘤情况病例; (2)病理提示小细胞癌病例,病理分级和病理类型未明确病例; (3)交界瘤或其他良性肿瘤病例; (4)无明确记录手术、放疗以及化疗数据病例; (5)无明确生存时间病例; (6)死于非肿瘤疾病病例。
验证组数据选取2004至2009年SEER数据库肺部肿瘤病例,变量提取及剔除标准同建模组。
1.2 统计学分析Kaplan-Meier法分析绘制生存曲线。因肿瘤独特的生物学特性,其TNM分期及病理分级视为无序分类变量,连续性变量(年龄和肿瘤大小)进行分组转换为无序分类变量,应用方差膨胀因子(variance inflation factor, VIF)分析多重共线性问题,所有变量采用单因素回归分析(univariate Cox hazard analysis),筛选差异具有统计学意义(P < 0.05,经临床研究证实为独立预后因素的变量符合P < 0.1即可)的变量进行多因素Cox回归分析(multivariate Cox hazard analysis)确定独立预后因素。
列线图基于Cox风险比例回归模型(Cox proportional hazards model),以区分度(discrimination)和校准度(calibration)作为评价指标分别进行内部验证及外部验证,C-index与预测能力正相关,通过bootstrap重采样绘制校准曲线。
以上分析、验证及绘图均由R语言(3.5.1)完成,主要应用程序包为rms和Hmisc[3]。
2 结果共线性分析结果提示,TNM分期存在严重共线性问题,故将该变量从模型中剔除。单因素回归分析提示,13个变量(年龄、人种、性别、婚姻状态、病理分级、病理类型、肿瘤大小、淋巴结转移情况、远处转移情况、手术、放疗和化疗)差异均具有统计学意义(均P < 0.05),且经过多因素Cox回归进一步分析,均为独立预后因素。但是风险比(hazard ratio,HR)提示放疗为危险因素,与实际临床和以往研究不符[4-5],对TNM分期进行分层分析发现,放疗在Ⅳ期中表现为危险因素,而在非Ⅳ(nⅣ)期中则为保护因素,故本研究将所有数据分为Ⅳ期组(Ⅳ组)及nⅣ期组(nⅣ组)进行分析,变量特征见表 1。
| 预测因子 | nⅣ组 | Ⅳ组 | |||
| 建模组 | 验证组 | 建模组 | 验证组 | ||
| 年龄 | |||||
| < 50岁 | 1 272 (3.57) | 1 585 (5.66) | 708 (5.28) | 705 (7.32) | |
| 50~59岁 | 5 903 (16.55) | 5 042 (18.01) | 2 563 (19.12) | 1 886 (19.59) | |
| 60~69岁 | 11 826 (33.15) | 9 138 (32.65) | 4 258 (31.77) | 3 036 (31.54) | |
| 70~79岁 | 11 687 (32.76) | 8 853 (31.63) | 3 921 (29.25) | 2 800 (29.09) | |
| ≥80岁 | 4 990 (13.99) | 3 370 (12.04) | 1 953 (14.57) | 1 198 (12.45) | |
| 人种 | |||||
| 白人 | 29 392 (82.38) | 23 339 (83.39) | 10 362(77.31) | 7 667 (79.66) | |
| 黑人 | 3 742 (10.49) | 2 811 (10.04) | 1 819 (13.57) | 1 280 (13.30) | |
| 亚州太平洋岛民 | 2 544 (7.13) | 1 838 (6.57) | 1 222 (9.12) | 678 (7.04) | |
| 性别 | |||||
| 女性 | 17 831 (49.98) | 13 575 (48.50) | 6 009 (44.83) | 4 270 (44.36) | |
| 男性 | 17 847 (50.02) | 14 413 (51.50) | 7 394 (55.17) | 5 355 (55.64) | |
| 婚姻状态 | |||||
| 单身或离异 | 15 913 (44.60) | 11 688 (41.76%) | 6 237 (46.53) | 4 256 (44.22) | |
| 已婚 | 19 765 (55.40) | 16 300 (58.24%) | 7 166 (53.47) | 5 369 (55.78) | |
| 病理分级 | |||||
| Ⅰ | 4 982 (13.96) | 3 106 (11.10) | 732 (5.46) | 621 (6.45) | |
| Ⅱ | 15 113 (42.36) | 11 523 (41.17) | 4 303 (32.10) | 2 880 (29.92) | |
| Ⅲ | 15 047 (42.17) | 12 416 (44.36) | 8 043 (60.01) | 5 559 (57.76) | |
| Ⅳ | 536 (1.50) | 943 (3.37) | 325 (2.42) | 565 (5.87) | |
| 病理类型 | |||||
| 腺癌 | 19 892 (55.75) | 13 905 (49.68) | 8 591 (64.10) | 5 598 (58.16) | |
| 鳞癌 | 12 740 (35.71) | 9 979 (35.65) | 3 995 (29.81) | 2 898 (30.11) | |
| 腺鳞癌 | 828 (2.32) | 662 (2.37) | 224 (1.67) | 138 (1.43) | |
| 支气管肺泡腺癌 | 1 111 (3.11) | 1 826 (6.52) | 85 (0.63) | 180 (1.87) | |
| 未分化癌 | 1 107 (3.10) | 1 616 (5.77) | 508 (3.79) | 811 (8.43) | |
| 病灶大小 | |||||
| < 2 cm | 8 100 (22.70) | 5 268 (18.82) | 764 (5.70) | 608 (6.32) | |
| 2~3.9 cm | 14 097 (39.51) | 11 144 (39.82) | 3 827 (28.55) | 2 893 (30.06) | |
| 4~5.9 cm | 7 185 (20.14) | 6 248 (22.32) | 3 898 (29.08) | 2 934 (30.48) | |
| 6~7.9 cm | 3 725 (10.44) | 3 173 (11.34) | 2 683 (20.02) | 1 799 (18.69) | |
| 8~9.9 cm | 1 578 (4.42) | 1 318 (4.71) | 1 374 (10.25) | 856 (8.89) | |
| ≥10 cm | 993 (2.78) | 837 (2.99) | 857 (6.39) | 535 (5.56) | |
| 淋巴结情况 | |||||
| 无转移 | 22 877 (64.12) | 16 434 (58.72) | 3 027 (22.58) | 2 153 (22.37) | |
| 区域淋巴结 | 12 801 (35.88) | 11 554 (41.28) | 9 352 (69.78) | 6 528 (67.82) | |
| 远处淋巴结 | 0 (0.00) | 0 (0.00) | 1 024 (7.64) | 944 (9.81) | |
| 手术 | |||||
| 否 | 11 030 (30.92) | 8 525 (30.46) | 13 403 (100) | 9 625 (100) | |
| 是 | 24 648 (69.08) | 19 463(69.54) | 0 (0.00) | 0 (0.00) | |
| 放疗 | |||||
| 否 | 24 198 (67.82) | 19 383 (69.25) | 6 687 (49.89) | 4 505 (46.81) | |
| 是 | 11 480 (32.18) | 8 605 (30.75) | 6 716 (50.11) | 5 120 (53.19) | |
| 化疗 | |||||
| 否 | 22 503 (63.07) | 17 018 (60.80) | 5 097 (38.03) | 3 912 (40.64) | |
| 是 | 13 175 (36.93) | 10 970 (39.20) | 8 306 (61.97) | 5 713 (59.36) | |
数据清洗后建模组共49 081例,验证组37 614例。对建模组进行分析,nⅣ组35 678例,中位生存时间为66个月(95%CI:63~70),1、3和5年生存率分别为80.0%(95%CI:79.6%~80.4%)、59.5%(95%CI:58.9%~60.1%)、51.4%(95%CI:50.6%~52.1%); Ⅳ组13 403例,中位生存期为7个月(95%CI:6~7),1、3、5年生存率分别为30.5%(95%CI:29.6%~31.3%)、7.8%(95%CI:7.2%~8.4%)、3.7%(95%CI:3.2%~4.3%),见图 1。
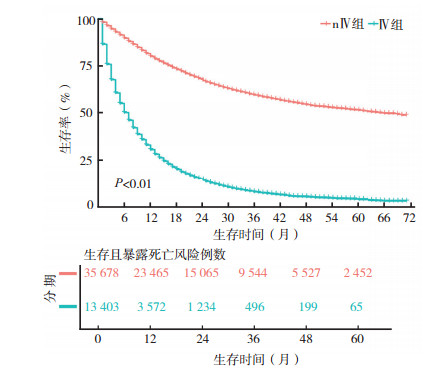
|
| 图 1 nⅣ组和Ⅳ组生存曲线图 Fig.1 overall survival curves of the nⅣ and Ⅳ groups |
对nⅣ组和Ⅳ组分别进行单因素回归分析及多因素Cox回归分析,两组结果基本一致。年龄、性别、人种、婚姻状态、病理分级、病理类型、肿瘤大小、淋巴结转移情况、手术、放疗和化疗均为独立预后因素(均P < 0.05)。高龄、男性、未婚、病理分化差、肿瘤体积大、淋巴结转移、未行手术及放化疗均为危险因素,人种中亚裔及太平洋岛屿居民预后较好,黑种人次之,白种人预后最差,病理类型中细支气管肺泡腺癌预后较好,腺癌、鳞癌和未分化癌次之,腺鳞癌预后最差。nⅣ组中淋巴结仅分无转移与区域转移2组,Ⅳ组分无转移、区域转移及远处转移3组,Ⅳ组手术变量为缺失值(表 2)。
| 预测因子 | nⅣ组单因素分析 | nⅣ组多因素分析 | Ⅳ组单因素分析 | Ⅳ组多因素分析 | |||||||
| HR | P值 | HR | P值 | HR | P值 | HR | P值 | ||||
| 年龄 | |||||||||||
| < 50岁 | 参照 | 参照 | 参照 | 参照 | |||||||
| 50~59岁 | 1.12 | 0.048 3 | 1.06 | 0.305 6 | 1.19 | 0.000 3 | 1.10 | 0.060 3 | |||
| 60~69岁 | 1.15 | 0.010 0 | 1.15 | 0.012 8 | 1.31 | < 0.01 | 1.18 | 0.000 4 | |||
| 70~79岁 | 1.38 | < 0.01 | 1.38 | < 0.01 | 1.50 | < 0.01 | 1.32 | < 0.01 | |||
| ≥80岁 | 2.12 | < 0.01 | 1.69 | < 0.01 | 1.68 | < 0.01 | 1.29 | < 0.01 | |||
| 人种 | |||||||||||
| 白人 | 参照 | 参照 | 参照 | 参照 | |||||||
| 黑人 | 1.08 | 0.005 6 | 0.90 | 0.000 6 | 0.98 | 0.365 3 | 0.94 | 0.025 1 | |||
| 亚州太平洋岛民 | 0.79 | < 0.01 | 0.85 | < 0.01 | 0.67 | < 0.01 | 0.72 | < 0.01 | |||
| 性别 | |||||||||||
| 女性 | 参照 | 参照 | 参照 | 参照 | |||||||
| 男性 | 1.50 | < 0.01 | 1.30 | < 0.01 | 1.23 | < 0.01 | 1.19 | < 0.01 | |||
| 婚姻状态 | |||||||||||
| 单身或离异 | 参照 | 参照 | 参照 | 参照 | |||||||
| 已婚 | 0.81 | < 0.01 | 0.84 | < 0.01 | 0.85 | < 0.01 | 0.90 | < 0.01 | |||
| 病理分级 | |||||||||||
| Ⅰ | 参照 | 参照 | 参照 | 参照 | |||||||
| Ⅱ | 2.06 | < 0.01 | 1.44 | < 0.01 | 1.21 | < 0.01 | 1.10 | 0.036 3 | |||
| Ⅲ | 3.20 | < 0.01 | 1.67 | < 0.01 | 1.56 | < 0.01 | 1.39 | < 0.01 | |||
| Ⅳ | 3.19 | < 0.01 | 1.67 | < 0.01 | 1.57 | < 0.01 | 1.27 | 0.002 5 | |||
| 病理类型 | |||||||||||
| 腺癌 | 参照 | 参照 | 参照 | 参照 | |||||||
| 鳞癌 | 1.88 | < 0.01 | 1.15 | < 0.01 | 1.29 | < 0.01 | 1.06 | 0.005 7 | |||
| 腺鳞癌 | 1.42 | < 0.01 | 1.25 | < 0.01 | 1.36 | < 0.01 | 1.17 | 0.032 5 | |||
| 支气管肺泡腺癌 | 0.43 | < 0.01 | 0.79 | 0.002 5 | 0.59 | < 0.01 | 0.71 | 0.007 6 | |||
| 未分化癌 | 1.77 | < 0.01 | 1.19 | 0.000 9 | 1.31 | < 0.01 | 1.11 | 0.048 0 | |||
| 病灶大小 | |||||||||||
| < 2 cm | 参照 | 参照 | 参照 | 参照 | |||||||
| 2~3.9 cm | 1.94 | < 0.01 | 1.47 | < 0.01 | 1.03 | 0.513 8 | 1.05 | 0.289 5 | |||
| 4~5.9 cm | 3.64 | < 0.01 | 2.06 | < 0.01 | 1.19 | < 0.01 | 1.19 | < 0.01 | |||
| 6~7.9 cm | 4.85 | < 0.01 | 2.38 | < 0.01 | 1.32 | < 0.01 | 1.29 | < 0.01 | |||
| 8~9.9 cm | 6.31 | < 0.01 | 2.96 | < 0.01 | 1.45 | < 0.01 | 1.41 | < 0.01 | |||
| ≥10 cm | 6.58 | < 0.01 | 3.19 | < 0.01 | 1.71 | < 0.01 | 1.60 | < 0.01 | |||
| 淋巴结情况 | |||||||||||
| 无转移 | 参照 | 参照 | 参照 | 参照 | |||||||
| 区域淋巴结 | 3 | < 0.01 | 2.01 | < 0.01 | 1.19 | < 0.01 | 1.30 | < 0.01 | |||
| 远处淋巴结 | \ | \ | \ | \ | 1.23 | < 0.01 | 1.41 | < 0.01 | |||
| 手术 | |||||||||||
| 否 | 参照 | 参照 | \ | \ | \ | \ | |||||
| 是 | 0.22 | < 0.01 | 0.33 | < 0.01 | \ | \ | \ | \ | |||
| 放疗 | |||||||||||
| 否 | 参照 | 参照 | 参照 | 参照 | |||||||
| 是 | 2.47 | < 0.01 | 0.91 | < 0.01 | 1.03 | 0.129 3 | 1.07 | 0.000 5 | |||
| 化疗 | |||||||||||
| 否 | 参照 | 参照 | 参照 | 参照 | |||||||
| 是 | 1.81 | < 0.01 | 0.80 | < 0.01 | 0.46 | < 0.01 | 0.45 | < 0.01 | |||
上述变量纳入Cox风险比例模型,绘制列线图。其中nⅣ组共11个变量,包括年龄、性别、人种、婚姻状态、病理分级、病理类型、肿瘤大小、淋巴结转移情况、手术、放疗和化疗(图 2),列线图中Total分值为各个预后因素的分值总和,分值越高,预后越差,危险因素及保护因素的分值高低与表 2中各因素HR值相关,HR值越高,分值越高。内部验证C-index为0.772(95%CI:0.768~0.776),外部验证C-index为0.736(95%CI:0.733~0.739),校准曲线示,内部验证及外部验证的预测曲线斜率趋向1,表示预测概率接近实际概率,预测效应较好(图 3)。Ⅳ组共10个变量,包括年龄、性别、人种、婚姻状态、病理分级、病理类型、肿瘤大小、淋巴结转移情况、放疗和化疗。列线图示,内部验证C-index为0.687(95%CI:0.681~0.693),外部验证C-index为0.661(95%CI:0.655~0.666),见图 2。校准曲线示,预测曲线斜率偏向1,具有一定的预测效应(图 4)。2个模型经过检验,结合区分度及校准曲线,可以认为nⅣ组模型对nⅣ期非小细胞肺癌患者预后有较好的预测能力,Ⅳ组模型对Ⅳ期预后具有一定的预测能力[6]。
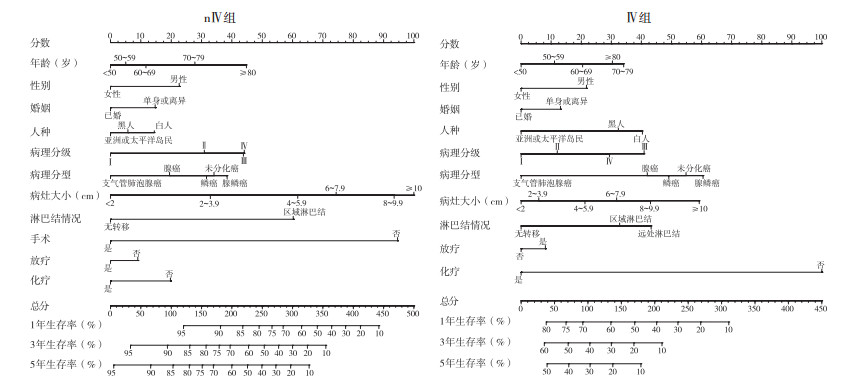
|
| 图 2 nⅣ组和Ⅳ组1、3和5年生存率列线图 Fig.2 nomograms for predicting 1-, 3-, and 5-year survival rates of the nⅣ and Ⅳ groups |
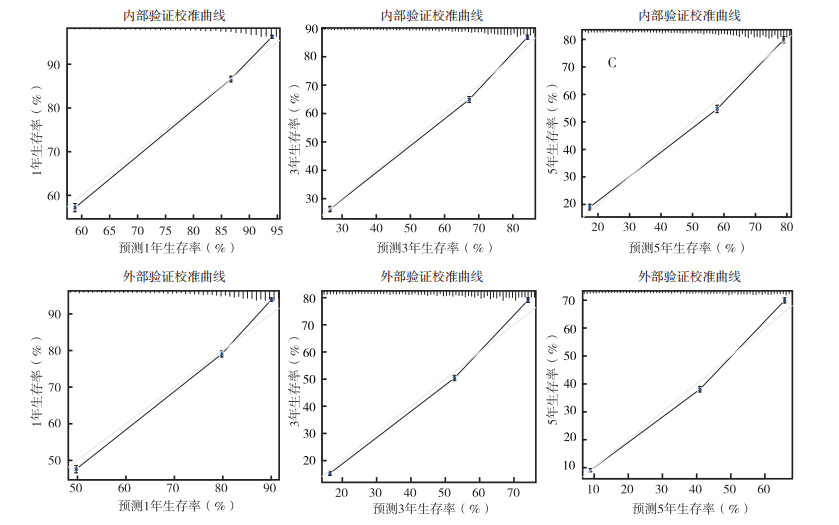
|
| 图 3 nⅣ组1、3和5年内部和外部验证校准曲线 Fig.3 The 1-, 3-, and 5-year internal and external verification calibration curves of the nⅣ group |
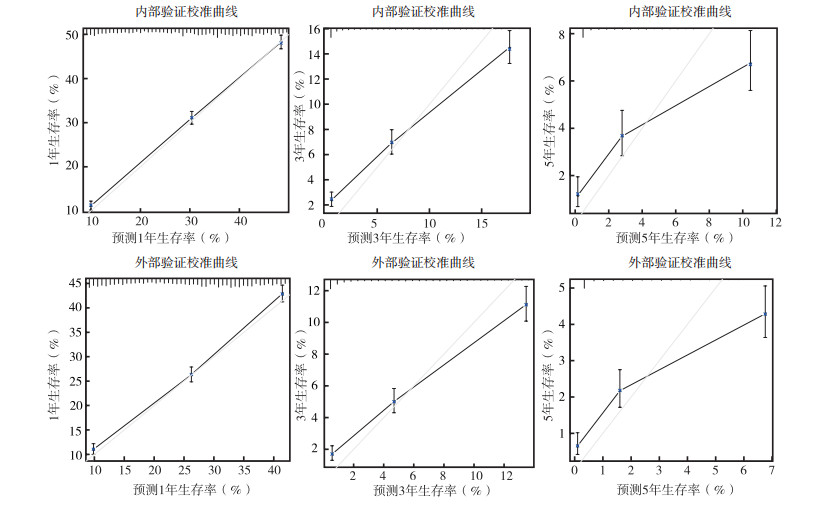
|
| 图 4 Ⅳ组1、3和5年内部和外部验证校准曲线 Fig.4 The 1-, 3-, and 5-year internal and external verification calibration curves of the Ⅳ group |
目前非小细胞肺癌治疗手段主要包括手术、放疗、化疗、靶向治疗以及免疫治疗。临床医师治疗决策前都应当对患者的预后以及能否获益进行评估,非小细胞肺癌预后因素复杂多样[7-11],仅根据肿瘤-淋巴结-转移(tumor-node-metastasis,TNM)难以准确评估患者预后。预测模型最开始用于天气预测或者经济预测,但近年来在医学领域的应用也越来越多,临床医师与患者可以通过预测模型进行治疗方案的选择。如应用心血管风险评分(modifications of the Framingham cardiovascular risk score)选择抗胆固醇以及降压药[12],预测术后恶心、呕吐发生率,制定术后止呕方案[13]。SEER数据库是北美最具代表性的大型肿瘤登记注册数据库之一,收集大量循证医学的相关证据,为循证研究实践提供宝贵的资料。该数据库登记站覆盖面积较广,从该数据库提供的脚本手册可发现,所纳入人种几乎涵盖全世界居民,为各地数据分析人员提供多种分析模式,随着大数据时代的到来以及生信技术的发展,SEER数据库的分析结果在非小细胞肺癌领域得到极大认可并对非小细胞肺癌CSCO指南的制定起到一定的指导作用,如Ⅲ期患者中N2的患者术后放疗的获益问题,有相关分析发现该期患者术后放疗组的死亡风险降低,且5年总生存提高[14-15],但是有细心的研究者通过分析SEER数据库中1992至2005年肺癌患者生存数据发现,术后放疗未能改善老年患者的总生存[16],因此对N2期的患者术后放疗与否仍需进行相关的临床试验以及详细的预后评价,可见SEER数据库在临床上的重大应用价值。现如今国内外对非小细胞肺癌的预后仍没有出现准确的预测工具,临床医师无法对患者进行个体化的整体评估,在治疗方案选择上缺乏个体化的疗效评估。考虑SEER数据库的庞大样本量以及其潜在的临床应用价值,本研究组深入分析此数据库肺部肿瘤病例,筛选出部分与非小细胞肺癌相关的独立预后因素,发现其结果基本与既往研究一致,并且建立列线图,希望能在一定程度上对患者的预后进行预测以期为临床医师诊疗决策提供适当的依据。
研究者发现年龄越大,预后越差,这可能与老年患者对治疗耐受性以及治疗意愿相关[10]。男性患者预后多不如女性,一项回顾性研究发现,女性患者吸烟史与慢性肺疾病病史少于男性,且女性肺癌患者以预后较好的腺癌居多,男性患者鳞癌占比较女性高[17]。本研究中,女性患者中腺癌占64.81%,鳞癌26.85%,男性腺癌51.62%,鳞癌40.94%。而另一项研究发现,女性术后复发高峰较男性延迟[11]。这些都可能是女性生存率较高的原因。种族变量的预测结果也与既往研究相符[18],与社会经济、社区医疗和酒精滥用相关。已婚状态的患者经济条件与精神状态较未婚或丧偶患者稳定,能得到更多的治疗机会[19]。病理分期、病理分型、肿瘤大小和淋巴结转移预测结果均同于既往研究[3]。
早期患者与部分孤立转移灶晚期患者可从手术获益[20]。放疗作为非小细胞肺癌常见的主要治疗手段,是早期肺癌患者及部分晚期患者改善预后的主要因素[21-22],在既往进行预后模型构建的研究中,鲜有研究者将此列入预测因素队列[23-24],原因可能在于单因素分析未通过筛查或多因素分析结果与实际临床不符,未行探索性分析。本研究通过分层分析发现,放疗在nⅣ期与Ⅳ期中作用方向相反,因此分开分析,分别构建模型。化疗是非小细胞肺癌无手术指征患者以及部分手术患者的治疗基石[25-26]。
非小细胞肺癌预后因素不仅有本研究所诉因素,随着基因测序的发展,靶向治疗已成为主要的治疗手段之一[27-28],常见的基因突变如表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)以及T790M等可能会成为非小细胞肺癌预后的重要指标。免疫治疗的发展也逐渐趋于成熟,随着细胞程序性死亡受体1(programmed cell death protein 1,PD-1)/细胞程序性死亡配体1(programmed cell death ligand 1,PD-L1)抑制剂在治疗上得到认可[29-30],PD-L1受体表达率和肿瘤突变负荷(tumor mutational burden,TMB)等也可作为主要预后因素对非小细胞肺癌患者进行预测评估。中医药治疗非小细胞肺癌具有一定的优势和疗效[31-33],对患者预后有一定的影响。SEER数据库中缺乏明确的化疗信息,无基因突变及靶向用药的登记,因此其占有的预测权重未能在本研究中得到体现,也是本研究以及诸多SEER相关研究难以避免的局限性,以后随着SEER登记信息的完善,这个处境也会得到解决。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Rusch VW, Chansky K, Kindler HL, et al. The IASLC mesothelioma staging project:proposals for the M descriptors and for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for mesothelioma[J]. J Thorac Oncol, 2016, 11(12): 2112-2119. DOI:10.1016/j.jtho.2016.09.124 |
| [3] |
Liang W, Zhang L, Jiang G, et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer[J]. J Clin Oncol, 2015, 33(8): 861-869. DOI:10.1200/JCO.2014.56.6661 |
| [4] |
Rusthoven KE, Pugh TJ. Stereotactic body radiation therapy for inoperable lung cancer[J]. JAMA, 2010, 303(23): 2354-2355. |
| [5] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [6] |
Alba AC, Agoritsas T, Walsh M, et al. Discrimination and calibration of clinical prediction models:users' guides to the medical literature[J]. JAMA, 2017, 318(14): 1377-1384. DOI:10.1001/jama.2017.12126 |
| [7] |
Fang P, He W, Gomez DR, et al. Influence of age on guideline-concordant cancer care for elderly patients in the United States[J]. Int J Radiat Oncol Biol Phys, 2017, 98(4): 748-757. DOI:10.1016/j.ijrobp.2017.01.228 |
| [8] |
Ferrara R, Mezquita L, Auclin E, et al. Immunosenescence and immunecheckpoint inhibitors in non-small cell lung cancer patients:Does age really matter?[J]. Cancer Treat Rev, 2017, 60(8): 60-68. |
| [9] |
Paz-Ares LG, Zimmermann A, Ciuleanu T, et al. Meta-analysis examining impact of age on overall survival with pemetrexed for the treatment of advanced non-squamous non-small cell lung cancer[J]. Lung Cancer, 2017, 104(12): 45-51. |
| [10] |
Schulkes K, Hamaker ME, Lammers JJ, et al. Multidisciplinary decision-making regarding chemotherapy for lung cancer patients-An age-based comparison[J]. Eur J Cancer Care (Engl), 2018, 27(1): e12768. DOI:10.1111/ecc.12768 |
| [11] |
Watanabe K, Sakamaki K, Nishii T, et al. Gender differences in the recurrence timing of patients undergoing resection for non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2018, 19(3): 719-724. |
| [12] |
WB kannel DM, Gordon T. A general cardiovascular risk profile:the Framingham Study[J]. Am J Cardiol, 1976, 38: 46-51. DOI:10.1016/0002-9149(76)90061-8 |
| [13] |
Van den Bosch JE, Moons KG, Bonsel GJ, et al. Does measurement of preoperative anxiety have added value for predicting postoperative nausea and vomiting?[J]. Anesth Analg, 2005, 100(5): 1525-1532. DOI:10.1213/01.ANE.0000149325.20542.D4 |
| [14] |
Urban D, Bar J, Solomon B, et al. Lymph node ratio may predict the benefit of postoperative radiotherapy in non-small-cell lung cancer[J]. J Thorac Oncol, 2013, 8(7): 940-946. DOI:10.1097/JTO.0b013e318292c53e |
| [15] |
Robinson CG, Patel AP, Bradley JD, et al. Postoperative radiotherapy for pathologic N2 non-small-cell lung cancer treated with adjuvant chemotherapy:a review of the National Cancer Data Base[J]. J Clin Oncol, 2015, 33(8): 870-876. DOI:10.1200/JCO.2014.58.5380 |
| [16] |
Wisnivesky JP, Halm EA, Bonomi M, et al. Postoperative radiotherapy for elderly patients with stage Ⅲ lung cancer[J]. Cancer, 2012, 118(18): 4478-4485. DOI:10.1002/cncr.26585 |
| [17] |
杨胜利, 周雪宇, 庞洁, 等. 女性原发性肺癌临床和预后特征与男性差异的分析[J]. 四川医学, 2012, 33(7): 1304-1306. DOI:10.3969/j.issn.1004-0501.2012.07.084 |
| [18] |
Tannenbaum SL, Koru-Sengul T, Zhao W, et al. Survival disparities in non-small cell lung cancer by race, ethnicity, and socioeconomic status[J]. Cancer J, 2014, 20(4): 237-245. DOI:10.1097/PPO.0000000000000058 |
| [19] |
Saito-Nakaya K, Nakaya N, Akechi T, et al. Marital status and non-small cell lung cancer survival:the Lung Cancer Database Project in Japan[J]. Psychooncology, 2008, 17(9): 869-876. DOI:10.1002/pon.1296 |
| [20] |
Vansteenkiste J, Crinò L, Dooms C, et al. 2nd ESMO Consensus Conference on Lung Cancer:early-stage nonsmall-cell lung cancer consensus on diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(8): 1462-1474. DOI:10.1093/annonc/mdu089 |
| [21] |
Allen AM, Shochat T, Flex D, et al. High-dose radiotherapy as neoadjuvant treatment in non-small-cell lung cancer[J]. Oncology, 2018, 95(1): 13-19. |
| [22] |
Yuksel C, Bozkurt M, Yenigun BM, et al. The outcome of bifocal surgical resection in non-small cell lung cancer with synchronous brain metastases:results of a single center retrospective study[J]. Thorac Cardiovasc Surg, 2014, 62(7): 605-611. |
| [23] |
吴桂平, 赵婷婷, 张霞, 等. 局部晚期非小细胞肺癌后程加速超分割联合同期化疗的临床观察[J]. 实用肿瘤杂志, 2018, 33(6): 560-564. |
| [24] |
Ma K, Sun F, Yang X, et al. Prognosis of patients with primary malignant main stem bronchial tumors:7, 418 cases based on the SEER database[J]. Onco Targets Ther, 2018, 11: 83-95. |
| [25] |
Scagliotti GV, Parikh P, von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-3551. DOI:10.1200/JCO.2007.15.0375 |
| [26] |
Mordant P, Arame A, De Dominicis F, et al. Which metastasis management allows long-term survival of synchronous solitary M1b non-small cell lung cancer?[J]. Eur J Cardiothorac Surg, 2012, 41(3): 617-622. DOI:10.1093/ejcts/ezr042 |
| [27] |
Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957. DOI:10.1056/NEJMoa0810699 |
| [28] |
Planchard D, Boyer MJ, Lee JS, et al. Post-progression outcomes for osimertinib versus standard-of-care EGFR-TKI in patients with previously untreated EGFR-mutated advanced non-small cell lung cancer[J]. Clin Cancer Res, 2019, 25(7): 2058-2063. DOI:10.1158/1078-0432.CCR-18-3325 |
| [29] |
Wu YL, Lu S, Cheng Y, et al. Nivolumab versus docetaxel in a predominantly chinese patient population with previously treated advanced non-small cell lung cancer:CheckMate 078 randomized phase Ⅲ clinical trial[J]. J Thorac Oncol, 2019, 14(5): 867-875. DOI:10.1016/j.jtho.2019.01.006 |
| [30] |
Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK):a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/S0140-6736(16)32517-X |
| [31] |
周岱翰, 林丽珠, 田华琴, 等. 益气化痰法为主中医药治疗方案对老年非小细胞肺癌中位生存期的影响:一项多中心、前瞻性临床队列研究[J]. 世界中医药, 2014, 9(7): 833-838, 844. DOI:10.3969/j.issn.1673-7202.2014.07.003 |
| [32] |
林丽珠, 周岱翰, 郑心婷. 中医药提高晚期非小细胞肺癌患者生存质量的临床观察[J]. 中国中西医结合杂志, 2006, 26(5): 389-393. DOI:10.3321/j.issn:1003-5370.2006.05.001 |
| [33] |
毛维, 王瑞, 华莎, 等. 化瘀通络方对肺癌微环境树突状细胞的影响及其相关机制[J]. 实用肿瘤杂志, 2019, 34(5): 410-416. |
 2020, Vol. 35
2020, Vol. 35


