文章信息
- 林涛, 闻卿, 徐永远, 潘敏强, 张超
- 浅谈超声造影在诊断胃外生高危胃间质瘤中的应用价值
- 实用肿瘤杂志, 2020, 35(3): 274-277
基金项目
- 浙江省自然科学基金(Y16H180019)
-
作者简介
- 林涛(1985-), 男, 山东临沂人, 住院医师, 硕士, 从事超声波临床应用研究.
-
通信作者
- 张超, E-mail:2513036@zju.edu.cn
-
文章历史
- 收稿日期:2020-01-18
病例1, 患者女性, 60岁。1个月前无明显诱因下出现上腹部胀痛不适感, 无恶心、呕吐和畏寒、发热等不适。2019年11月外院增强全腹CT检查示, 胃小弯和胰腺前方不规则囊性密度影, 腹腔系膜稍模糊, 肿瘤性病变待排。遂以腹腔胃肠道肿块于2019年12月13日收入本院, 查体示, 左上腹轻压痛, 饱胀感明显。实验室检查示, 血常规和肝肾功能等无异常。肿瘤标志物检查提示, 糖类抗原199(carbohydrate antigen 199, CA 199) 66.8 U/mL, CA 242为36.2 U/mL, 鳞状上皮细胞癌相关抗原(squamous cell carcinoma antigen, SSC) 1.8 ng/mL, 均升高。2019年12月10日全腹部增强CT检查示, 脾胃间隙胃底处可见一囊性灶, 大小约63 mm×58 mm×68 mm, 部分与胃壁边界不清, 壁厚略不均, 可见少许钙化灶, 内可见分层液平, 增强扫描囊壁较明显强化, 肝胃间隙胃底处肿瘤, 间质瘤可能(图 1)。2019年12月16日超声造影(contrastenhanced ultrasound, CEUS)示, 脾胃间隙胃底处可见一囊实性块, 大小约7.5 cm×6.2 cm, 边界可辨, 内回声不均, 彩色多普勒血流显像(colour Doppler flow imaging, CDFI)内可见血流信号。肿块实性部分呈不均匀高增强, 呈"快进快出"表现。造影提示脾胃间隙胃底处囊实性块, 间质瘤考虑(图 2)。2019年12月17日肝脏增强MRI检查示, 胃底部占位, 病灶呈类圆形, 边界大部分清楚, 局部与胃壁分界欠清, 大小约6.8 cm×6.6 cm×7.2 cm, T1WI呈等信号, 其内可见条片状高信号, T2WI呈混杂等低信号伴中央条片状更低信号, 弥散加强成像(diffusion weighted imaging, DWI)示环壁弥散受限, 增强扫描环壁明显强化, 脾动静脉受推压变窄。胃底部占位伴出血, 中高危险度间质瘤首先考虑(图 3)。患者于2019年12月20日行"胰体尾切除+脾脏切除+近端胃大部切除+胃-空肠吻合+食管-空肠吻合+空肠-空肠吻合"术, 术中所见:近端胃可触及大小约8 cm×7 cm质硬肿块, 边缘不清, 与胰腺和脾脏致密粘连, 游离远端胃与胰腺间隙可见黑色陈旧血块, 考虑肿瘤此前破裂可能。肿物可见大量陈旧黑色血性液体及血块, 囊壁呈灰白色, 与胃壁相连, 术中送检, 冰冻病理检查示, 梭形细胞肿瘤, 首先考虑间质瘤。免疫组织化学结果符合胃肠道间质瘤; 大小9 cm×7 cm×4 cm; 核分裂>5个/50 HPF, 临床危险度评估为高危。免疫组织化学检查示, CD117弥漫+, DOG-1弥漫+, CD34弥漫+, SMA -, Desmin -, S-100 -, Beta-catenin浆+, Ki-67 40%, P53 +, SDHA存在, SDHB存在, CD99 -, Bcl-2部分+, EMA部分+, STAT6 -, SOX10 -, HMB45 -, Melan-A -(图 4)。
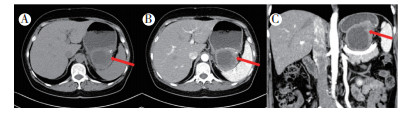
|
| 注 A:胃腔内囊性灶,部分与胃壁边界不清、可见少许钙化; B:增强扫描囊壁可见明显强化; C:冠状位扫擦可见肿瘤位于胃底部,内部无增强;箭头示胃腔内囊性灶 图 1 病例1 胃外生性高危胃间质瘤CT表现 |
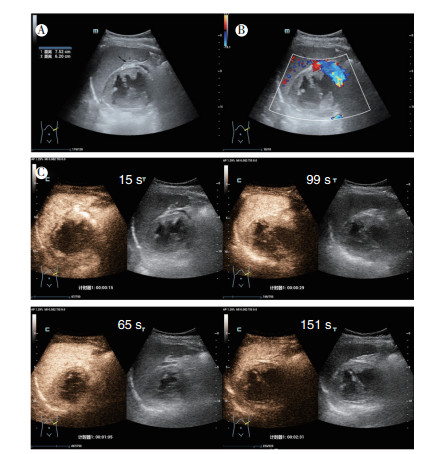
|
| 注 A:脾胃间隙胃底处可见一囊实性块,边界可辨,内回声不均; B:彩色多普勒超声检查示,肿块实性部分可见少许血流信号; C:超声造影示,肿块实性部分呈不均匀高增强,呈“快进快出”表现 图 2 病例1 胃外生性高危胃间质瘤二维超声及超声造影表现 |
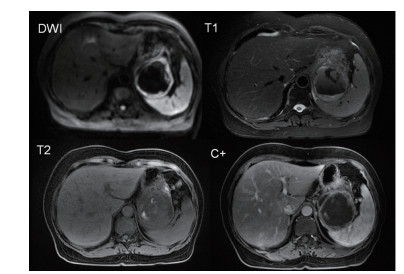
|
| 注 肿瘤T1WI呈等信号,其内可见条片状高信号,T2WI呈混杂等低信号伴中央条片状更低信号,DWI示环壁弥散受限,增强扫描环壁明显强化 图 3 病例1 胃外生性高危胃间质瘤MRI表现 |
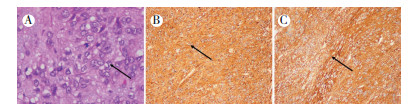
|
| 注 A:病理检查示,弥漫排列的上皮样细胞(箭头示;HE×100);B:免疫组织化学检查示,CD117弥漫+(箭头示部分阳性细胞;SP×100);C:免疫组织化学检查示,DOG-1弥漫+(箭头示部分阳性细胞;SP×100) 图 4 病例1 胃外生性高危胃间质瘤病理及免疫组织化学检查结果 |
病例2, 患者男性, 66岁。患者2019年11月18日于本院因甲状腺结节微波消融术前检查, 行全腹CT增强发现胃小弯侧黏膜下肿块。无恶心、呕吐、腹痛、腹胀、黑便或便秘等, 于2019年11月21日门诊拟以"胃占位性病变"收住入院。查体:无殊。实验室检查:血常规、尿常规、粪便常规、电解质及肝肾功能均无明显异常。肿瘤标志物检查示:CA 199为5.9 U/mL, CA 242为5.7 U/mL, SSC 1.1 ng/mL, 均未见明显异常。2019年11月13日于本院行胃超声双重造影示, 胃小弯见一低回声肿块, 大小约5.16 cm×4.88 cm, 边界可辨, 局部胃壁连续性欠光整, 内回声不均匀, CDFI示血流信号不明显。注射造影剂后, 呈向心性高增强; 提示胃小弯肿块, 间质瘤伴局部溃疡考虑(图 5)。2019年11月18日本院全腹增强CT检查示, 胃小弯侧可见外生性肿块, 大小约46 mm×46.3 mm×44.1 mm (左右×前后×上下), 表面可见溃疡, 增强呈持续轻中度强化(图 6)。2019年11月20日胃镜检查示, 胃角切迹见巨大隆起性病变, 直径约4.0 cm, 中间可见巨大溃疡, 周边可见小溃疡(图 7)。患者于2019年11月26日行"腹腔镜下胃癌根治+Roux-Y食管空肠吻合+肠排列术":腹腔探查可见胃小弯侧壁可及一质韧肿块, 大小约6 cm×5 cm×4 cm, 边界欠清, 未明显侵及浆膜外, 胃腔内肿块可见一大小约1 cm×1 cm溃疡面, 腹腔内未见明显腹腔积液。常规病理检查示, 胃角部见上皮样和梭形异型细胞排列成片, 结合免疫组织化学检查结果, 符合胃肠道间质瘤。免疫组织化学结果示, CD117弥漫+, DOG-1弥漫+, CD34-, SMA部分+, Desmin-, S-100部分+, β-catenin胞质+, Ki- 67 5% +, P53散在+, SDHA +, SDHB +, HE深切(图 8)。
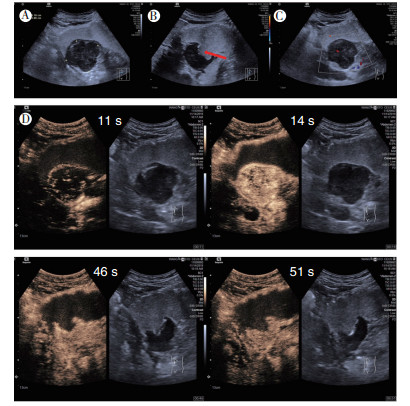
|
| 注 A:胃小弯见一低回声肿块,边界可辨,局部胃壁连续性欠光整,内回声不均匀; B:肿块中央溃疡表现出“充盈缺损”(箭头示); C:彩色多普勒超声检示,肿块血流信号不明显; D:超声造影示,肿块呈向心性高增强表现 图 5 病例2 胃外生性高危胃间质瘤二维超声及超声造影表现 |
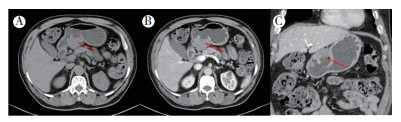
|
| 注 A:胃小弯侧可见外生性肿块,表面可见溃疡; B:横断面增强扫描可见肿块增强呈持续轻中度强化; C:冠状位增强扫描表现;箭头示胃小弯侧所见外生性肿块 图 6 病例2 胃外生性高危胃间质瘤CT表现 |
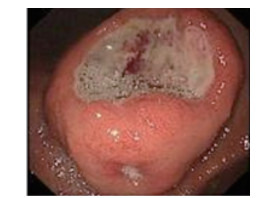
|
| 注 胃角切迹见巨大隆起性病变,中间可见巨大溃疡,周边可见小溃疡 图 7 病例2 胃外生性高危胃间质瘤胃镜表现 |
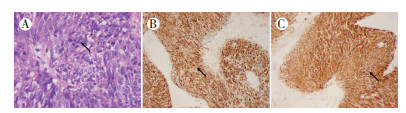
|
| 注 A:病理检查结果,镜下见上皮样和梭形异型细胞排列成片(箭头示;HE×100); B:免疫组织化学检查示,CD117弥漫+(箭头示部分阳性细胞;SP×100); C:免疫组织化学检查示,DOG-1弥漫+(箭头示部分阳性细胞;SP×100) 图 8 病例2 胃外生性高危胃间质瘤病理及免疫组织化学检查结果 |
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是发生于胃肠道的一种间叶源性肿瘤, 是消化道最常见的间叶源性肿瘤, 占胃肠道间叶肿瘤的70%, 占消化道恶性肿瘤的比例较少, 为0.1%~3%, 好发于胃和小肠[1]。外生性胃间质瘤是GIST的一种, 临床表现主要跟肿瘤大小及疾病进展程度相关, 临床上无明显特异性, 较大的病灶会导致患者出现腹痛、腹胀及消化不良等表现[2], 本文中2例患者中1例因腹痛腹胀为首发症状, 而另1例患者无明显症状, 因其他手术检查时偶然发现。目前, 胃间质瘤认可的危险度分级标准是美国国立卫生研究院(National Institutes of Health, NIH)原发GIST危险度分级方案(2008年改良版)[3]。该方案根据原发病灶的大小、部位及镜下核分裂数量, 将GIST分为极低、低、中等和高危险度4级, 高危胃间质瘤诊断标准为任何最大径>5 cm或核分裂数>5个/50 HPF的肿瘤均应诊断为高危胃间质瘤。本文中2例患者均符合高危胃间质瘤诊断标准。
内镜检查是诊断胃外生性间质瘤患者最常见的手段, 但是多数患者是因为其他病因无意中被检出, 因此实际检出率并不理想。X线钡餐造影检查可显示胃间质瘤腔内病变范围及黏膜结构, 但对于较小肿瘤难以显示, 且仅能够观察腔内病变情况。CT检查能够较清晰显示病灶部位、大小、形态以及与周围脏器间的解剖层次关系等情况[4], 是胃外生性间质瘤患者诊断以及分期鉴别的重要手段, 胃外生性间质瘤生长方式具有多样性, 包括腔内型、腔外型、混合型以及内生型, 较大的肿瘤会伴有不同程度的液化、钙化或坏死及溃疡等情况[5], 强化方式也多以不均匀强化为主要表现。MRI检查在比较大的胃间质瘤方面表现尤为突出, 可显示肿瘤内部内出血、坏死和囊变情况, 多表现为高信号、低信号及混杂高信号, 增强扫描后发现病灶实质部分均匀强化[6]。但是根据肿瘤生长方式及疾病进展程度的不同, CT和MRI检查均有不同影像表现, 整体特异性较差。
超声造影作为一种有效的影像新技术, 其对胃外生性间质瘤患者的检出效果十分显著, 有助于患者病情诊断与观察。胃作为空腔脏器, 并且通过口腔与外界相通, 气体干扰对常规超声检查造成困难, 通过采用胃双重超声造影技术, 患者口服超声造影剂后, 能够较好充盈患者的胃腔, 排除将胃内气体[7]。胃外生性间质瘤胃腔造影的主要表现:胃腔内的局限性占位, 形态规则或不规则, 可呈类球型和分叶型等, 肿块以低回声为主, 部分较大瘤体可见液化坏死时, 会伴有不均质回声。CDFI检查:瘤体实性部分可见少许血流信号或无。胃双重超声造影表现:肿块根据大小和性质不同呈现出不同灌注模式, 恶性胃间质瘤与良性胃间质瘤比较最大径更大, 形状多不规则, 超声造影动脉期多可见粗大不规则的血管, 实质期多不均匀增强。本文2例患者瘤体大小及超声造影表现及最终病理结果与既往报道具有一致性[8]。
超声造影剂与常用的CT和MRI对比剂的药物代谢动力学特征不同, 多数的CT和MRI的对比剂会迅速从血池清除进入到细胞外间隙, 而目前临床使用的超声造影剂只停留于血管内, 是纯血池造影剂; 超声造影的另一个固有优点在于可以对增强模式进行实时评估, 其时间分辨率也比其他成像技术高很多。而且, 超声造影剂具有很好的耐受性和安全性, 在需要时可以在间隔很短时间后重复注射。因此, 超声造影在诊断胃以及其他实性脏器肿瘤时能更加直观、有效和灵活地观测病灶血流灌注模式[9]。
胃间质瘤的实质主要由未分化或多能的梭形或上皮样细胞组成, 免疫组织化学检查CD117、CD34及DOG-1表达阳性对诊断胃间质瘤具有重要价值, Ki-67表达情况对区分胃间瘤良恶性具有一定意义[10]。目前, 外科手术仍是治疗局限型或潜在可切除胃间质瘤首选治疗方法, 而对于晚期、不可切除或转移性胃间质瘤患者则首选靶向治疗, 目前靶向治疗药物主要有酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)一线伊马替尼、二线舒尼替尼和三线瑞戈非尼。
| [1] |
李强, 支小飞, 姜胜华, 等. 胃肠道间质瘤循环肿瘤细胞的监测及其对患者预后的意义[J]. 中华普通外科杂志, 2016, 31(10): 836-838. |
| [2] |
吴琼, 邵艳波, 吴海燕, 等. 64排螺旋CT诊断胃肠道间质瘤的临床应用价值分析[J]. 影像研究与医学应用, 2017, 1(7): 66-67. |
| [3] |
Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10): 1411-1419. |
| [4] |
史振乾, 史富磊. 恶性不典型胃肠道间质瘤的MSCT表现与手术病理[J]. 中国中西医结合影像学杂志, 2017, 15(1): 32-34. |
| [5] |
刘晔. 超声造影检查1例胃外生性间质瘤患者的体会[J]. 中国医疗器械信息, 2019, 25(22): 39-40. |
| [6] |
顾亮亮, 夏淦林, 冯峰. CT及MRI在胃肠道间质瘤诊断中价值[J]. 中华实用诊断与治疗杂志, 2014, 28(11): 1120-1122. |
| [7] |
董英娜, 曹军英, 张筠, 等. 彩色多普勒超声联合胃肠造影剂在胃肠道间质瘤中诊断价值[J]. 临床军医杂志, 2017, 45(5): 462-465. |
| [8] |
高美莹, 苗立英, 葛辉玉, 等. 胃间质瘤超声造影表现与良恶性的相关性分析[J]. 中国超声医学杂志, 2017, 33(2): 184-186. |
| [9] |
中国医师协会超声医师分会. 中国超声造影临床应用指南[M]. 2版, 北京: 人民卫生出版社, 2017: 3-4.
|
| [10] |
冯佳. 胃肠道间质瘤病临床病理及免疫组化特征分析[J]. 中外医学研究, 2016, 14(30): 47-48. |
 2020, Vol. 35
2020, Vol. 35


