文章信息
- 黄文浩, 冯广森
- Huang Wenhao, Feng Guangsen
- 聚乙烯醇载药微球介入栓塞治疗原发性肝癌的临床分析
- Clinical analysis of polyvinyl alcohol callispheres in interventional embolization therapy for primary hepatocellular carcinoma
- 实用肿瘤杂志, 2020, 35(3): 260-264
- Journal of Practical Oncology, 2020, 35(3): 260-264
-
作者简介
- 黄文浩(1981-), 男, 河南郑州人, 主治医师, 硕士, 从事肿瘤临床诊治研究.
-
通信作者
- 冯广森, E-mail:fengguangsen@126.com
-
文章历史
- 收稿日期:2019-08-06
原发性肝癌是最常见的消化系统疾病之一, 发病隐匿, 病情进展迅速, 多数患者就诊时已是中晚期, 失去手术根治的机会。经导管动脉栓塞(transcatheter arterial chemoembolization, TACE)已成为治疗原发性中晚期肝癌的最佳选择。目前, 聚乙烯醇载药微球作为一种新型载药栓塞系统被应用于治疗中晚期肝癌, 与传统介入栓塞治疗比较, 聚乙烯醇载药微球的作用更具多样性和彻底性, 载药微球规格多样, 大小均匀, 不易粘附, 是一种永久性栓塞剂。聚乙烯醇载药微球可以维持病灶区化疗药物处于治疗浓度水平, 延长药物释放时间, 减少化疗药物进入体循环剂量, 减轻全身不良反应。本文旨在分析聚乙烯醇载药微球介入栓塞治疗原发性肝癌的有效性及安全性, 以此验证其临床价值。
1 资料与方法 1.1 一般资料回顾性分析郑州大学第二附属医院2017年6月至2019年3月确诊并接受TACE治疗的原发性肝癌患者104例, 其中男性75例, 女性29例, 年龄31~74岁, 中位年龄52岁。其中接受聚乙烯醇载药微球治疗的48例为观察组, 接受碘化油+化疗药治疗的56例为对照组。两组一般资料比较, 差异均无统计学意义(均P>0.05, 表 1)。纳入标准: (1)确诊为原发性肝癌患者; (2)患者不愿意接受外科手术治疗; (3)肝功能为Child A~B级; (4)无严重凝血功能障碍; (5)无对比剂、化疗药物及碘化油过敏反应。排除标准:(1)合并有严重心、脑或肾系统疾病; (2)肝功能为Child C级, 巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer, BCLC)分期为D期; (3)门静脉左或右支存在瘤栓; (4)患者家属不愿接受或拒绝签署手术知情同意书者; (5)对铂类或多柔比星药物过敏者; (6)术中或术后无法配合治疗或随访者。
| 临床特征 | 观察组(n=48) | 对照组(n=56) | P值 |
| 年龄(岁, |
52.81±10.00 | 52.19±11.30 | 0.771 |
| 性别 | 0.866 | ||
| 男性 | 35 (72.9) | 40(71.4) | |
| 女性 | 13(27.1) | 16(28.6) | |
| 病因 | 0.908 | ||
| 乙肝 | 39(81.3) | 45 (80.4) | |
| 其他 | 9(18.7) | 11(19.6) | |
| 肝硬化 | 0.552 | ||
| 有 | 43 (89.6) | 48 (85.7) | |
| 无 | 5(10.4) | 8(14.3) | |
| Child-Pugh分级 | 0.760 | ||
| A级 | 28 (58.3) | 31(55.4) | |
| B级 | 20(41.7) | 25 (44.6) | |
| BCLC分期 | 0.919 | ||
| A期 | 17(35.4) | 21(37.5) | |
| B期 | 25 (52.1) | 27 (48.2) | |
| C期 | 6(124.5) | 8(14.3) |
观察组采用苏州恒瑞迦俐生生物医药科技有限公司生产的Callispheres载药微球; 对照组采用传统栓塞治疗:碘化油与化疗药混合乳剂。
术前常规准备, 采用Seldinger技术穿刺右侧股动脉, 成功后, 分别进行腹腔干及肠系膜上动脉造影以观察肝动脉、肿瘤供血动脉及门静脉情况。根据肿瘤大小、位置及血供情况, 将微导管超选择插至肿瘤供血动脉并进行化疗药物灌注化疗, 然后进行栓塞治疗。观察组采用100~300 μm或300~500 μm聚乙烯醇载药微球1瓶与40~50 mg表柔比星充分混合并静置30 min, 使微球充分吸收化疗药物。对照组用碘化油与表柔比星(根据肿瘤大小和血供情况选择碘化油和化疗药物用量, 一般碘化油10 mL, 表柔比星20~30 mg)充分混合乳化后进行栓塞治疗。透视下经微导管用载药微球或碘化油与表柔比星混悬液进行栓塞治疗, 复查造影肿瘤未见染色, 手术结束。
1.3 术后处理及随访分析介入微创治疗后, 根据患者情况给予保肝、镇痛、抑酸和抗感染等对症治疗; 术后及时观察患者的不良反应。术后1个月来院随访, 并检测肝功能指标和甲胎蛋白(alpha fetoprotein, AFP)值; 通过MRI或CT检查观察肿瘤坏死率。采用美国肝病协会提出的改良实体瘤评价标准(modified Response Evaluation Criteria in Solid Tumors, mRECIST)[1]评估患者疗效:完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。疾病缓解率=CR+PR, 疾病控制率= CR+PR+SD。
1.4 统计学分析采用SPSS17.0统计软件分析数据。计量资料采用均数±标准差(
观察组和对照组术后不良反应主要表现有恶心、呕吐、腹痛及发热等。经积极对症治疗后, 不良反应均得到缓解或消失, 术后均未出现严重并发症。观察组与对照组术后恶心、呕吐及腹痛发生率比较, 差异均具有统计学意义(均P < 0.05, 表 2)。
| 组别 | 恶心 | 呕吐 | 腹痛 | 发热 |
| 观察组(n=48) | 15(32.2) | 11(22.7) | 14(30.0) | 17(35.7) |
| 对照组(n=56) | 44 (78.0) | 31(55.2) | 30 (52.8) | 25 (45.1) |
| χ2值 | 23.578 | 11.298 | 6.307 | 0.914 |
| P值 | < 0.01 | 0.001 | 0.012 | 0.339 |
两组术前和术后血清AFP浓度变化差异均具有统计学意义(均P < 0.01), 术后观察组与对照组血清AFP浓度比较, 差异无统计学意义(P>0.05, 表 3)。
| 组别 | 治疗前AFP浓度 | 治疗后AFP浓度 | t值 | P值 |
| 观察组(n=48) | 637.02±114.10 | 255.45±112.96 | 4.702 | < 0.01 |
| 对照组(n=56) | 610.37±106.41 | 302.02±87.27 | 3.817 | < 0.01 |
| t值 | 1.231 | 0.892 | ||
| P值 | 0.221 | 0.374 |
观察组与对照组治疗后1个月复查肝功能指标。两组谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(glutamic oxaloacetic transaminase, AST)水平比较, 差异均具有统计学意义(均P < 0.05, 表 4)。
| 组别 | ALT(U/L) | AST(U/L) | 白蛋白(g/L) | 总胆红素(μmol/L) | 凝血酶原时间(s) |
| 观察组(n=48) | 31.46±4.62 | 30.21±3.34 | 35.81±2.14 | 17.24±2.67 | 21.58±4.22 |
| 对照组(n=56) | 57.62±3.10 | 63.55±5.62 | 59.38±4.36 | 19.91±4.53 | 23.71±5.78 |
| t值 | 0.916 | 0.857 | 0.311 | 0.690 | 0.346 |
| P值 | 0.037 | 0.041 | 0.442 | 0.531 | 0.438 |
| 注 ALT:谷丙转氨酶(alanine aminotransferase);AST:谷草转氨酶(glutamic oxaloacetic transaminase) | |||||
观察组与对照组治疗后1个月复查肿瘤坏死率。观察组肿瘤坏死率高于对照组, 差异具有统计学意义[(85.20±12.83)% vs(49.07±15.24)%, P=0.027]。载药微球栓塞肿瘤血管更具有优势(图 1), 阻断肿瘤组织血供更彻底, 实现治疗目的更有效。
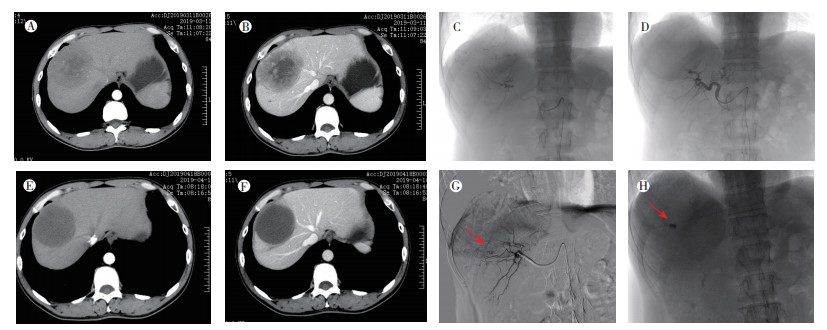
|
| 注 A:首次就诊,行TACE前动脉期肿瘤明显强化,中心坏死区不强化;B:静脉期图像,病灶强化程度减低;C:TACE栓塞前造影,病灶明显染色;D:载药微球栓塞后复查造影图像,肿瘤血管未见显影;E:治疗后1个月复查CT动脉期图像,病灶未见明确强化;F:治疗后1个月复查CT静脉期图像,病灶明显坏死;G:再次行栓塞治疗前造影图像,原发病灶内见点状肿瘤染色影(箭头示残留肿瘤染色影),其他未见染色;H:栓塞治疗后,见碘化油点状沉积(箭头示残留肿瘤碘化油沉积影) 图 1 1例原发性肝癌患者治疗前及治疗后CT和DSA影像学表现 Fig.1 CT and DSA imaging findings of a typical liver cancer patient before and after treatment |
治疗后1个月, 观察组和对照组疾病缓解率分别为77.0%(37/48)和48.2%(27/56), 两组比较差异具有统计学意义(P=0.003, 表 5)。两组疾病控制率分别为95.8%(46/48)和89.3%(50/56), 差异无统计学意义(P=0.379)。
| 组别 | CR | PR | SD | PD | 疾病 缓解率 |
疾病 控制率 |
| 观察组(n=48) | 10(20.8) | 27(56.2) | 9(18.8) | 2(4.2) | 37(77.0) | 46(95.8) |
| 对照组(n=56) | 7(12.5) | 20(35.7) | 23(41.1) | 6(10.7) | 27(48.2) | 50(89.3) |
| χ2值 | 9.101 | 0.775 | ||||
| P值 | 0.003 | 0.379 | ||||
| 注 CR:完全缓解(complete remission);PR:部分缓解(partial remission);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease) | ||||||
原发性肝癌是我国发生率较高的恶性肿瘤之一。随着科技的发展, 对肝癌的治疗方法也呈现多样化[2]。治疗原发性肝癌的首选方法仍是外科手术切除, 但其发病隐匿, 进展较快, 发现时多为中晚期, 已失去手术切除的最佳时机。目前指南对于无法手术切除的原发性肝癌患者推荐行TACE治疗[3]。肝脏是双重供血器官, 同时接受肝动脉和门静脉系统供血, 25%的血供来自肝动脉, 75%的血供来自门静脉, 当肝动脉供血被阻断后, 门静脉仍可向正常肝细胞提供供血, 因此正常肝细胞仍能存活。而原发性肝癌肿瘤的血供>90%来自肝动脉供血, 这种血供差异确定TACE治疗的理论基础, 同时保证治疗肝癌的有效性和安全性。研究表明, 阻断肿瘤供血血管可有效阻断肿瘤的营养供给, 从而导致肿瘤细胞的死亡, 而对正常肝细胞影响却很小[4-5]。而TACE作为一种非手术治疗方法, 成为非手术治疗原发性肝癌的首选方法, 能够延长患者生存时间, 提高生存率, 改善患者预后。
常规TACE栓塞剂有碘化油与化疗药物混合栓塞, 而碘化油乳剂携带化疗药物可随血流进入全身循环系统, 增加不良反应的发生率, 同时病灶部位的局部药物浓度降低, 瘤周侧枝循环冲刷碘化油, 引起栓塞不彻底, 进而影响预后效果。聚乙烯醇栓塞微球作为一种新型栓塞剂, 其具有以下特点:(1)微球直径大小均匀, 可通过微导管输送, 有多种规格可供选择; (2)载药微球不易黏附、聚集堵管; (3)良好的生物相容性, 避免引起排斥反应; (4)加载药物量大, 能满足治疗需要; (5)载药微球可在病灶内持续释放化疗药物并能提高治疗的有效药物浓度[6]。通过导管将微球注入肿瘤组织后, 其位置相对较固定, 不易随血流移动, 可以提高肿瘤组织内的药物浓度, 延长化疗药物的作用时间, 同时减少化疗药物进入体循环系统, 降低血药浓度[7], 减轻全身的不良反应, 减少不良反应的发生率[8], 安全性更高。Lammer等[9]研究显示, 载药微球栓塞治疗的肝脏毒性低于常规TACE。同时载药微球可以彻底栓塞肿瘤供血末梢血管, 引起肿瘤组织缺血缺氧坏死, 进一步达到治疗肿瘤的目的。总之, 对肝脏恶性肿瘤进行载药微球栓塞时, 遵循的原则是既对肿瘤供血动脉尽可能完全栓塞, 又要尽可能避免栓塞过度或误栓正常肝组织, 影响正常肝功能[10]。
本研究所用聚乙烯醇载药微球为Callispheres。其具有极好的可变弹性和良好的生物相容性, 可压缩变形50%左右而容易通过导管, 且到达靶血管后可恢复至原状。术者可根据病灶大小、治疗目的及血供情况选择不同规格的微球, 以达到理想治疗效果。本研究中, 两组均未出现严重并发症及不可逆不良反应。观察组术后栓塞不良反应恶心(32.2%)、呕吐(22.7%)及腹痛(30.0%)的发生率均低于对照组(78.0%、55.2%和52.8%)。两组患者术后AFP水平较术前降低, 而两组之间术后AFP水平比较, 差异无统计学意义(P>0.05)。Malagari等[11]对71例原发性肝癌患者用载药微球行TACE治疗, AFP水平在栓塞后1个月下降(P < 0.01)。本研究中, 两组术后均出现肝功能指标一过性升高, 经积极治疗后均缓解或消失, 两组除了ALT和AST水平(均P < 0.05)外, 其余指标比较, 差异均无统计学意义(均P>0.05)。Jeon等[12]研究发现, TACE术后ALT和AST等指标变化与碘化油的栓塞容积程度呈较高的线性相关(P=0.025)。本研究显示, 术后1个月, 观察组患者肿瘤坏死率较对照组增高, 这可能与载药微球栓塞肿瘤血管更彻底有关。Frenette等[13]研究显示, 载药微球组肿瘤坏死率比传统TACE更高。而陈刚等[14]对42例不切除中晚期肝癌患者研究显示, Callispheres组与传统TACE组栓塞治疗后肿瘤坏死率比较, 差异无统计学意义(P>0.05)。本研究中, 观察组和对照组疾病缓解率比较, 差异具有统计学意义(77.0% vs 48.2%, P < 0.05), 而两组疾病控制率比较, 差异无统计学意义(P>0.05))。邵海波等[15]对23例原发性肝癌患者研究显示, 载药微球治疗患者临床获益率为95.7%, 其栓塞性能优越, 临床效果显著。
综上所述, 聚乙烯醇载药微球应用于治疗原发性肝癌安全性更高, 临床疗效更明显, 术后不良反应少, 肝肾不良反应较碘化油轻, 更有利于患者术后恢复, 提高患者生活质量。
| [1] |
Lencioni R, Liovest JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Sem Liver Dis, 2010, 30(1): 52-60. |
| [2] |
苏泳诗, 于新发. 小肝癌临床治疗研究进展[J]. 实用肿瘤杂志, 2019, 34(2): 175-179. |
| [3] |
中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017年版)[J]. 临床肝胆病杂志, 2017, 33(8): 1419-1431. |
| [4] |
Lee YK, Jung KS, Kim DY, et al. Conventional versus drug-eluting beads chemoembolization for hepatocellular carcinoma:Emphasis on the impact of tumor size[J]. Gastroenterol Hepatol, 2017, 32(2): 487-496. |
| [5] |
许飞, 李忱瑞, 孙伟, 等. 原发性肝癌TACE术中雷替曲塞的临床应用[J]. 介入放射学杂志, 2017, 26(5): 418-421. |
| [6] |
Kerr DJ. Microparticulate drug delivery systems as an sdjunct to cancer treatment[J]. Cancer Drug Delivery, 2009, 4(1): 55. |
| [7] |
Lewis AL, Taylor RR, Hall B, et al. Pharmacokinetic and safety study of doxorubicineluting beads in a porcine model of hepatic arterial embolization[J]. Clin Cancer Res, 2006, 12(8): 2563-2567. |
| [8] |
Liu YS, Lin CY, Chuang MT, et al. Five-year outcome of conventional and drug-eluting transcatheter arterial chemoembolization in patients with hepatocellular carcinoma[J]. BMC Gastroenterol, 2018, 18(1): 124. |
| [9] |
Lammer J, Malagari K, Vogl T, et al. Prospective randomized study of doxorubicin-eluting -bead embolization in the treatment of hepatocelluar carcinoma:results of the Precision V study[J]. Cardiovasc Intervent Radiol, 2010, 33(1): 41-52. |
| [10] |
韩建军, 宋金龙, 谢印法, 等. 载药微球治疗恶性肝脏肿瘤的全程管理[J]. 中华介入放射学电子杂志, 2019, 7(1): 7-16. |
| [11] |
Malagari K, Alexopoulou E, Chatzimichail K, et al. Transcatheter chemoembolization in the treatment of HCC in patients not eligible for curative treatments:midterm results of doxorubicin-loaded DC bead[J]. Abdom Imaging, 2008, 33(5): 512-519. |
| [12] |
Jeon SH, Park KS, Kim YH, et al. Incidence and risk factors of acute hepatic after transcatheter arterial chemoembolization for hepatocellular carcinoma[J]. Korean J Gastroenterol, 2007, 50(3): 176-182. |
| [13] |
Frenette CT, Osorio RC, Stark J, et al. Conventional TACE and drug-eluting bead TACE as locoregional therapy before orthotopic liver transplantation:comparision of explant pathologic response[J]. Transplantation, 2014, 98(7): 781-787. |
| [14] |
陈刚, 张鼎, 应亚草, 等. 国产载药微球经动脉化疗栓塞治疗不可切除原发性肝癌的临床研究[J]. 浙江大学学报:医学版, 2017, 46(1): 44-51. |
| [15] |
邵海波, 张曦彤, 李红, 等. 栓塞微球在肝癌介入治疗中的应用[J]. 介入放射学杂志, 2008, 17(11): 776-778. |
 2020, Vol. 35
2020, Vol. 35


