文章信息
- 王欢欢, 周正扬, 朱丽晶, 何健, 闫婧, 李茗, 俞海平
- Wang Huanhuan, Zhou Zhengyang, Zhu Lijing, He Jian, Yan Jing, Li Ming, Yu Haiping
- MR扩散加权成像联合肿瘤指标对子宫颈癌放化疗疗效的评估
- Evaluation of MR diffusion weighted imaging combined with tumor markers in effi cacy of chemoradiotherapy for cervical cancer
- 实用肿瘤杂志, 2020, 35(3): 255-259
- Journal of Practical Oncology, 2020, 35(3): 255-259
-
作者简介
- 王欢欢(1990-), 女, 安徽亳州人, 住院医师, 硕士, 从事腹盆腔肿瘤影像学研究.
-
通信作者
- 周正扬, E-mail:zyzhou@nju.edu.cn
-
文章历史
- 收稿日期:2019-08-26
2. 南京大学医学院附属鼓楼医院肿瘤中心, 江苏 南京 210008
2. Department of Oncology, The Affiliated Drum Tower Hospital of Nanjing University Medical School, Nanjing 210008, China
子宫颈癌是女性常见妇科恶性肿瘤, 仅次于乳腺癌及结直肠癌, 是女性生殖系统第一大恶性肿瘤[1]。早发现和早治疗是治疗本病的关键, 但多数患者发现时已属于中晚期, 同步放化疗是中晚期(>ⅡB期)子宫颈癌的首选治疗方法[2]。如何早期预测、评估其放化疗疗效及监测复发是目前较为关注的问题, 临床上主要是根据MR图像上的病灶大小及肿瘤标志物变化来判断其放化疗疗效, 但肿瘤形态学上变化要晚于其内部结构及功能的变化。目前国内外开始从功能方面研究可以更早地预测及评估放化疗效果的指标, 这其中之一就是MR扩散加权成像(diffusion weighted imaging, DWI)。研究表明, 在治疗开始后表观扩散系数(apparent diffusion coefficient, ADC)会升高并且早于病灶大小变化[3], 但局限于样本量较小且没有长期随访监测及复发, 故需多中心多样本进一步证实其预测作用。本研究加入对肿瘤指标的分析, 选取癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原125(carbohydrate antigen-125, CA-125)、CA- 153及细胞角蛋白19片段(cytokeratin19 fragment, CYFRA21-1)等肿瘤指标, 测量并分析其变化规律; 通过分别测量子宫颈癌放化疗前后病灶大小、ADC以及肿瘤指标的变化, 探讨MR DWI联合肿瘤指标对子宫颈癌放化疗疗效的评估价值。
1 资料与方法 1.1 一般资料前瞻性纳入2015年8月至2018年7月南京大学医学院附属鼓楼医院收治的中晚期子宫颈癌患者。纳入标准:(1)经阴道穿刺活检病理证实为子宫颈癌; (2)初次MR扫描之前未接受任何治疗; (3)拟在本院接受放化疗联合治疗[2], 放疗分盆腔外照及后装内照, 辅助化疗为顺铂或者顺铂联合氟尿嘧啶周疗, 治疗周期约为1.5个月; (4)治疗后再次行MR扫描复查并能接受随访; (5)随访获得放化疗前后相应的肿瘤指标检查结果。排除标准:MR的禁忌证(如体内有金属支架和幽闭恐惧症等)。本研究得到医院伦理委员会批准, 并获得患者知情同意书。
共纳入39例患者, 均为女性, 年龄18~77岁, 中位年龄为51岁。穿刺活检病理均证实为子宫颈癌, 其中鳞癌38例, 小细胞癌1例。临床分期[4]:ⅡB期17例, Ⅲ期12例, Ⅳ期10例。根据RECIST标准评价疗效[5]:完全缓解(complete response, CR)为肿瘤病灶消失; 部分缓解(partial response, PR)为肿瘤最大径减少≥ 30%;疾病进展(progressive disease, PD)为肿瘤最大径增加≥ 20%;疾病稳定(stable disease, SD)为肿瘤最大径变化介于PR与PD之间。
1.2 MR扫描方法患者准备, 初次MR检查前2~3 h行灌肠准备, 若扫描时伪影较重, 重新进行屏气扫描。采用Philip Achieva 3.0T X-series超导体磁共振扫描仪, 16通道相控阵体部线圈。仰卧位, 头先进。扫描序列:轴位T1加权成像(T1 weighted imaging, T1WI)、T2加权成像(T2 weighted imaging, T2WI), 轴位和矢状位压脂T2W-光谱衰减翻转恢复(spectral attenuated inversion recovery, SPAIR), 轴位和矢状位DWI以及增强。扫描参数:(1)轴位T1W-快速自旋回波(turbo spin echo, TSE), 重复时间(repetition time, TR)/回波时间(echo time, TE)为500 ms/12 ms, 层厚/层距为5 mm/0.5 mm, 视野(field of view, FOV) 35~40 cm, 矩阵282×400, 激励次数(number of excitation, NEX)2;(2)轴位T2WI-TSE, TR/TE为4500 ms/80 ms, 层厚/层距为5 mm/0.5 mm, FOV 35~40 cm, 矩阵408×960, NEX 2; (3)轴位T2WI-SPAIR, TR/TE为4 700 ms/60 ms, 层厚/层距为5 mm/0.5 mm, FOV 35~40 cm, 矩阵364×720, NEX 2;(4)矢状位T2WI-SPAIR, TR/TE为4 700 ms/60 ms, 层厚/层距为5 mm/0.5 mm, FOV 18 cm, 矩阵171×336, NEX 2。DWI参数:自旋回波-平面回波(spin echo-echo planar imaging, SE-EPI)采集; 矢状位, TR/TE为1 252 ms/40 ms, 层厚/间距为5 mm/0.5 mm, FOV 25.6 cm, 矩阵85×144, NEX 3;轴位, TR/TE为1 236 ms/40 ms, 层厚/间距为5 mm/0.5 mm, FOV 40 cm, 矩阵133×224, NEX 3;扩散敏感梯度取2个b值(0、800 s/mm2)。轴位及矢状位增强:TR/TE为3.0 ms/1.42 ms, 层厚/间距为1.5 mm/0 mm, 矩阵256×194, 静脉推注钆双胺注射液对比剂, 剂量约0.1 mmol/kg。总体扫描时间约为30 min。治疗前、后扫描方案保持一致。
1.3 图像分析由2名具有经验的放射科医师在Extended MR Workspace 2.6.3.4工作站上对图像进行后处理, 选择b值, 生成ADC相应的参数图。综合观察横断位及矢状位MR图像, 分别测量肿瘤的前后、左右及上下径; 并人工设置感兴趣区(region of interest, ROI)于病灶实质部分, 尽量避开肿瘤边缘及肉眼可见的液化坏死区, 多次测量取平均值。对于放化疗后病灶显示不清的病例, 可将ROI设置于治疗前病灶位置, 肿瘤大小可记为0 mm[6]。
1.4 肿瘤指标检测方法所有患者均于放化疗前、后分别抽取静脉血送检, 采用西门子centaur XP全自动化学发光免疫分析仪及配套试剂盒(德国)对血清中CEA、CA-125进行检测; 采用罗氏Cobas E601全自动电化学发光免疫分析仪及配套试剂盒(瑞士)对CA-153及CYFRA21-1进行检测。CEA正常范围为0~5.0 ng/mL, CA-125为0~35 U/mL, CA-153为0~25 U/mL, CYFRA21-1为0~3.3 ng/mL。
1.5 统计学分析采用SPSS 16.0统计学软件进行数据分析。计量资料以均数±标准差(
所有患者均成功完成放化疗, 且治疗前、后均复查MR及相应的肿瘤指标。治疗后多数患者病灶可见明显缩小或未见明显病灶(图 1)。其中, 29例CR, 10例PR, PD和SD均0例。6例CEA升高, 6例CA-125升高, 6例CA-153升高, 15例CYFRA21-1升高, 4例所有指标均升高。
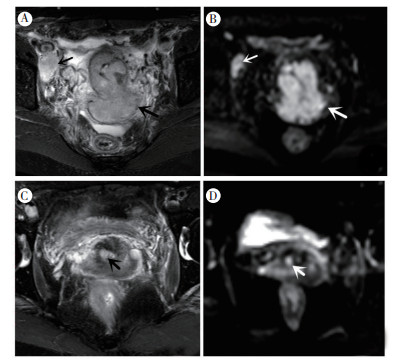
|
| 注 患者女性44岁,子宫颈鳞癌Ⅳ期,治疗后部分缓解;A:治疗前T2压脂横断位可见不规则软组织肿块影,大小约5.8 cm× 4.9 cm×5.2 cm(粗箭头示),右侧盆壁见肿大淋巴结影(细箭头示);B:DWI均呈明显高信号(粗箭头示子宫颈癌病灶,细箭头示肿大淋巴结),病灶ADC值为0.957×10-3 mm2/s;C:治疗后子宫颈右侧壁见结节样稍长T2信号影(箭头示残余病灶),大小0.7 cm× 0.7 cm×0.7 cm;D:DWI呈高信号(箭头示残余病灶),ADC值为1.388×10-3 mm2/s。 图 1 典型病例子宫颈癌治疗前和治疗后MR检查结果 Fig.1 Comparison of the MR images of cervical cancer before and after the treatment in a typical patient |
子宫颈癌患者放化疗治疗后与治疗前比较, ADC值升高[(1.388±0.948)×10-3mm2/s vs (0.885± 0.086)×10-3mm2/s, t=-23.990, P < 0.01], 肿瘤最大径缩小[(2.2±0.4) cm vs (4.5±1.9) cm, t=13.590, P < 0.01], 差异均具有统计学意义。
2.3 治疗前肿瘤指标升高组与正常组ADC值和肿瘤最大径比较治疗前肿瘤指标CEA、CA-125、CA-153及CYFRA21-1中各项或者全部指标升高患者, 其对应的ADC值均较正常组升高, 差异均具有统计学意义(均P < 0.05, 表 1)。
| 肿瘤指标 | 升高组 | 正常组 | t值 | P值 |
| CEA | ||||
| 例数 | 6 | 33 | ||
| ACD值(×10-3mm2/s) | 0.956±0.090 | 0.872±0.080 | 0.844 | 0.026 |
| 肿瘤最大径(cm) | 4.8±0.1 | 6.1±0.2 | -1.928 | 0.062 |
| CA-125 | ||||
| 例数 | 6 | 33 | ||
| ACD值(×10-3mm2/s) | 0.959±0.084 | 0.871±0.081 | 2.467 | 0.018 |
| 肿瘤最大径(cm) | 4.6±0.1 | 6.1±0.2 | -1.650 | 0.107 |
| CA-153 | ||||
| 例数 | 6 | 33 | ||
| ACD值(×10-3mm2/s) | 0.963±0.083 | 0.870±0.080 | 2.579 | 0.014 |
| 肿瘤最大径(cm) | 4.4±0.1 | 6.1±0.2 | -2.005 | 0.052 |
| CYFRA21-1 | ||||
| 例数 | 15 | 24 | ||
| ACD值(×10-3mm2/s) | 0.938 ±0.065 | 0.851±0.083 | 3.433 | 0.001 |
| 肿瘤最大径(cm) | 4.8±0.2 | 6.5±0.2 | -2.732 | 0.010 |
| 均升高 | ||||
| 例数 | 4 | 35 | ||
| ACD值(×10-3mm2/s) | 0.988 ±0.094 | 0.873 ±0.079 | 2.723 | 0.010 |
| 肿瘤最大径(cm) | 4.4±0.1 | 6.0±0.2 | -1.507 | 0.140 |
CYFRA21-1升高组的肿瘤最大径小于正常组, 差异具有统计学意义(P=0.01), 其余各项肿瘤指标升高者肿瘤最大径均有小于正常组的趋势, 但是差异均无统计学意义(均P>0.05, 表 1)。
3 讨论本研究显示, 子宫颈癌放化疗后有较好疗效, 39例患者中29例CR, 10例PR, 肿瘤大小明显变小, 治疗后ADC值较之前升高, 与之前研究结果相似[7-8]。这一现象符合其病理基础以及DWI弥散原理, 肿瘤和正常组织的扩散特性差异为DWI区别肿瘤和正常组织提供理论基础[9]。造成这种差异的主要原因是:(1)恶性肿瘤细胞多数繁殖旺盛, 导致细胞密度较高, 细胞外间隙变窄, 导致水分子弥散受限; (2)肿瘤细胞代谢旺盛, 含蛋白质等大分子物质较多, 而这些物质对水分子吸附作用增强, 从而使水分子弥散较正常组织明显受限, 因此肿瘤组织一般表现为弥散高信号。治疗后ADC值升高, 主要是因为当接受有效治疗后细胞出现大片坏死, 细胞密度明显减小, 细胞外间隙增大; 并且细胞内结构发生改变, 一些大分子物质对水分子的吸附作用降低, 因此水分子弥散受限程度较之前明显减小, ADC值会明显增高。这也说明如果在治疗过程中ADC值升高, 说明肿瘤细胞对治疗方法有反应, 反之, 如果ADC值不增高或者反而降低, 也许提示肿瘤对这种治疗方法不敏感, 因此在后续治疗中, 可以及时改变治疗方案, 寻找更适合患者的个体化治疗方案。
肿瘤标志物对肿瘤的辅助诊断、指导治疗、监测病情和判断预后等有重要的预测价值[10-11]。CEA为非特异性肿瘤标志物, 约有30%~70%的子宫颈癌患者CEA水平升高, 并且CEA水平与疾病的诊断、疗效观察、预后及复发预测有关[12]。CYFRA21-1及CEA水平可以反映子宫颈癌预后, 子宫颈癌治疗后复发或远程转移者, 其水平高于无瘤生存患者、子宫颈良性病变患者和健康人, 在复发性子宫颈癌中, 多数患者存在CEA升高, 治疗后下降幅度与肿瘤控制程度成正比[13]。血清CA-125水平对子宫颈癌的诊断具有特异性。CA- 153是乳腺导管上皮细胞中的特异性抗原, 在肿瘤细胞发生时, 其含量增高。CYFRA21-1在健康人外周血中不表达或低表达[14]。CYFRA21-1升高的子宫颈癌患者中, 42%~63%为子宫颈鳞癌, 25%~40%为子宫颈腺癌或腺鳞癌。本研究中, 39例患者中, 只有6例CEA升高, 6例CA-125升高, 6例CA-153升高, 15例CYFRA21-1升高, 4例所有指标均升高, 阳性率为15.4%~38.4%, 子宫颈癌的肿瘤标志物阳性率较低, 其对子宫颈癌的诊断参考价值有限, 但对肿瘤指标升高组来说, 密切观测其变化, 有利于观察判断其疗效、预后及复发。
本研究得出肿瘤指标升高的各组其ADC值较肿瘤指标正常组高。造成这一差异的原因可能是肿瘤指标升高组较正常组细胞中的水分子扩散更不受限, 细胞外间隙更大, 细胞内大分子物质的差异使其对水分子的吸附作用更小, 导致ADC值相对偏高。肿瘤细胞恶性程度越高其ADC值越高, 并且ADC值与肿瘤间质细胞比例存在一定相关性, 肿瘤细胞间质比例越小, 细胞密度减低, ADC值增加, 反之, ADC值降低。此外分化差的子宫颈癌ADC值高于分化好的ADC值。本研究样本量较小, 需要进一步扩大样本量进行研究证实。本研究发现CR患者较PR患者治疗前ADC值低, 但差异无统计学意义(P>0.05), 但以往有研究表明, 治疗前ADC值较低者治疗效果更好, 越趋向于CR[15], 而本研究中肿瘤指标正常者其ADC值更低, 可能提示肿瘤侵袭性更小, 对治疗更敏感, 因此治疗效果更好。此外, 治疗前肿瘤指标升高者在经过有效治疗后, 在随访过程中, 其肿瘤指标均下降至正常。因此肿瘤指标可以考虑作为评估疗效的一个指标, 且联合ADC值可以对疗效进行预测。本研究中, 治疗前肿瘤大小与肿瘤标志物之间没有相关性。可能原因是与本研究样本量较小有关。本研究未发现治疗前ADC值与肿瘤大小存在相关性, 提示大小不同的病灶不存在细胞间隙或者细胞内大分子成分方面的不同, 仍需要进一步大样本多部位病灶的研究。
综上所述, 本研究发现肿瘤标志物的升高与 ADC值的高低存在一定相关性, 需要进一步大样本量进行研究, 并且经过有效治疗后肿瘤指标升高者会降至正常, ADC值升高, 肿瘤最大径缩小, 联合肿瘤指标及ADC值可以对子宫颈癌疗效进行预测及评估。
| [1] |
Dappa E, Elger T, Hasenburg A, et al. The value of advanced MRI techniques in the assessment of cervical cancer:a review[J]. Insights Imaging, 2017, 8(5): 471-481. |
| [2] |
周琦, 吴小华, 刘继红, 等. 宫颈癌诊断与治疗指南(第四版)[J]. 中国实用妇科与产科杂志, 2018, 34(6): 41-50. |
| [3] |
施优波, 童竑章, 陈孟达, 等. MR扩散成像对宫颈癌放化疗早期疗效的评价[J]. 医学影像学杂志, 2011, 21(6): 887-889. |
| [4] |
Pecorelli S, Zigliani L, Odicino F. Revised FIGO staging for carcinoma of the cervix[J]. Int J Gynecol Obstetr, 2009, 105(2): 107-108. |
| [5] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours:Revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. |
| [6] |
Harry VN, Semple SI, Gilbert FJ, et al. Diffusion-weighted magnetic resonance imaging in the early detection of response to chemoradiation in cervical cancer[J]. Gynecol Oncol, 2008, 111(2): 213-220. |
| [7] |
Kim HS, Kim CK, Park BK, et al. Evaluation of therapeutic response to concurrent chemoradiotherapy in patients with cervical cancer using diffusion-weighted MR imaging[J]. J Magn Reson Imaging, 2013, 37(1): 187-193. |
| [8] |
鲁雪红, 王健, 刘文亚, 等. 磁共振扩散加权成像技术预测及评估宫颈癌放疗疗效价值[J]. 中华实用诊断与治疗杂志, 2013, 27(4): 358-360. |
| [9] |
Punwani S. Diffusion weighted imaging of female pelvic cancers:Concepts and clinical applications[J]. Eur J Radiol, 2011, 78(1): 21-29. |
| [10] |
杜鲁涛, 靖旭, 段伟丽. 妇科肿瘤标志物应用专家共识[J]. 山东大学学报:医学版, 2018, 56(10): 9-14. |
| [11] |
张蕾, 薛永飞, 冀叶, 等. 胃癌血清肿瘤标志物和HER2表达的临床意义[J]. 实用肿瘤杂志, 2019, 34(1): 61-65. |
| [12] |
赵乌云. 探讨肿瘤标记物CEA、CA125在宫颈癌中的检测的临床价值[J]. 中外健康文摘, 2013, 46: 107-109. |
| [13] |
张小玲, 陈真云, 盛修贵, 等. 血清CYFRA21-1、CEA联合检测在诊断复发性子宫颈鳞癌中的价值[J]. 实用肿瘤杂志, 2006, 21(5): 432-435. |
| [14] |
Molina R, Filella X, Auge JM, et al. CYFRA 21.1 in patients with cervical cancer:comparison with SCC and CEA[J]. Anticancer Res, 2005, 25(3A): 1765-1771. |
| [15] |
刘颖, 白人驹, 孙浩然. 扩散加权成像预测、监测宫颈癌放化疗效果[J]. 中国医学影像技术, 2009, 25(7): 1269-1272. |
 2020, Vol. 35
2020, Vol. 35


