文章信息
- 费杰, 岑浩锋
- Fei Jie, Cen Haofeng
- 浸润性与非浸润性肺孤立性磨玻璃结节的回顾性分析
- Retrospective analysis of infi ltrating and non-infi ltrating solitary ground-glass nodules of lung
- 实用肿瘤杂志, 2020, 35(3): 236-240
- Journal of Practical Oncology, 2020, 35(3): 236-240
-
作者简介
- 费杰(1990-), 男, 浙江舟山人, 住院医师, 硕士, 从事胸心外科学研究.
-
通信作者
- 岑浩锋, E-mail:yinzxxwk@sina.com
-
文章历史
- 收稿日期:2019-04-16
随着计算机断层扫描(computed tomography, CT)技术不断发展和改善以及低剂量CT(lowdose CT, LDCT)在肺癌早期筛查上的推广及应用, 越来越多的孤立性磨玻璃结节(ground-glass nodules, GGN)被检出。Nakata等[1]发现GGN与早期肺癌(主要是肺腺癌)密切相关, 并且表现为GGN的肺部结节, 其恶性率高于实性结节(34% vs 7%)。国内外相关研究表明, 非浸润性腺癌与浸润性腺癌根治性术后无症状生存率存在差异, 并且非浸润性肺腺癌通常进展缓慢, 转移发生较晚, 可进行低剂量CT随访或楔形切除[2]。而以GGN为表现的浸润性腺癌则需行根治手术治疗(肺段或肺叶切除+淋巴结清扫), 与非浸润性比较, 手术创伤大, 术后恢复慢, 并发症发生率增加[3]。因此, 本研究通过对浸润组和非浸润组GGN患者的一般临床资料、临床及实验室检查表现进行对比分析, 为肺孤立性磨玻璃结节治疗方式的选择和减少不必要的手术创伤提供帮助。
1 资料与方法 1.1 一般资料收集2014年1月至2017年12月在本院接受手术治疗的GGN患者。纳入标准:(1)以肺孤立GGN为唯一影像表现; (2)接受手术治疗并有明确病理结果; (3)排除其他原发肿瘤。排除标准:(1) GGN为单侧多发或者双侧多发; (2)未行手术治疗; (3)无明确病理结果; (4)其他原发肿瘤转移[4]。
按照术后病理结果共收集125例患者, 按照国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)/美国胸科学会(American Thoracic Society, ATS)/欧洲呼吸学会(European Respiratory Society, ERS)分类标准分为两组, 分别为浸润组(微浸润性腺癌、浸润性腺癌及浸润性黏液腺癌)和非浸润组(良性病变、非典型腺瘤样增生及原位腺癌), 收集两组患者的性别、年龄、吸烟史、血清癌胚抗原(carcinoembryonic antigen, CEA)及CYFRA21-1水平, 详细记录高分辨率CT(high resolution CT, HRCT)特点, 包括结节大小、性质[单纯型磨玻璃结节(pure GGN, pGGN)和混合型磨玻璃结节(mixed GGN, mGGN)]、边缘形态(叶征和毛刺征)、界面(模糊和清楚)、邻近结构(胸膜牵拉和血管集束)和内部结构(空泡征和空气支气管征)。
浸润组96例, 男性69例, 女性27例; 年龄49~65岁, (58.2±4.8)岁。非浸润组29例, 男性21例, 女性8例; 年龄51~62岁, (56.0±2.9)岁。两组在年龄和性别方面比较, 差异均无统计学意义(均P>0.05), 具有可比性。
1.2 方法 1.2.1 采集胸部HRCT的图像所有患者均采用64层螺旋CT成像系统, 深吸气后连续扫描包括肺尖至肺底的所有区域, 分别予肺窗和纵隔窗进行观察, 影像诊断报告由2名以上具有丰富经验的放射科医师协商得出, 如有存在争议, 则求助上级医院影像科主任医师并协商后得出[5-6]。
1.2.2 采集血清肿瘤标志物所有患者于清晨抽取空腹静脉血5 mL, 在室温下静置离心分离血清后进行CEA及CYFRA21-1血清肿瘤标志物的测定, 按照检验科标准, CYFRA21-1 ≥ 3.3 ng/mL评估为阳性, CEA ≥ 5 ng/mL评估为阳性。
1.3 统计学分析采用SPSS 22.0软件作统计学分析。计量资料采用均数±标准差(
浸润组有吸烟史的患者31例(32.3%), CEA水平为(2.65±1.12)ng/mL(阳性3例), CYFRA21-1水平为(2.89±1.13)ng/mL(阳性5例)。非浸润组有吸烟史患者3例(10.3%), CEA水平为(1.54±0.91)ng/mL(阳性1例), CYFRA21-1水平为(1.65±1.22)ng/mL(阳性0例)。两组在吸烟史、CEA水平及CYFRA21-1水平方面比较, 差异均具有统计学意义(均P < 0.05), 而在CEA及CYFRA21-1阳性率方面比较, 差异均无统计学意义(均P>0.05)。
2.2 结节大小及性质浸润组pGGN 10例(10.4%), mGGN 86例(89.6%), 结节大小为(15.92±3.86)mm。非浸润组pGGN 25例(86.2%), mGGN 4例(13.8%), 结节大小为(9.13±2.29)mm。结节大小按(最大直径+最短直径)/2计算。两组在结节性质及大小方面比较, 差异均具有统计学意义(χ2=59.756, P=0.001; Z=-8.239, P=0.019)。
2.3 结节在HRCT上的表现两组在结节界面、内部空气支气管征、邻近胸膜牵拉、邻近结构血管集束和边缘分叶征方面比较, 差异均具有统计学意义(均P < 0.05), 而在病灶周围是否存有毛刺和内部结构是否有空泡征方面比较, 差异均无统计学意义(均P>0.05, 表 1, 图 1A~B)。
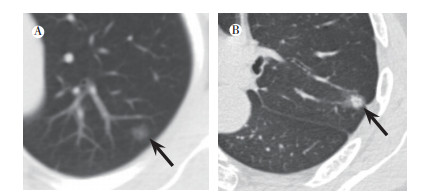
|
| 注 A:女性,61岁,左肺上叶见一处9 mm pGGN(箭头示),病灶边界不清,术后病理证实为微浸润腺癌;B:男性,59岁,左上肺尖后段mGGN(箭头示),病灶大小为14 mm,呈不规则形,病灶边缘见分叶及毛刺,可见空泡征和血管集束征,邻近胸膜牵拉,术后病理证实为浸润性腺癌 图 1 结节在HRCT上的表现 Fig.1 Partial images of nodules on HRCT |
| HRCT表现 | 浸润组(n=96) | 非浸润组(n=29) | χ2值 | P值 |
| 界面 | 30.229 | < 0.01 | ||
| 清楚 | 76 (79.2) | 7(24.1) | ||
| 模糊 | 20 (20.8) | 22 (75.9) | ||
| 内部结构 | 1.229 | 0.268 | ||
| 空泡征 | 51(53.1) | 12(41.4) | 12.489 | < 0.01 |
| 空气支气管征 | 39 (40.6) | 1(3.4) | ||
| 邻近结构 | 19.084 | < 0.01 | ||
| 胸膜牵拉 | 49(51.0) | 1(3.4) | 15.052 | < 0.01 |
| 血管集朿 | 56 (58.3) | 5(3.4) | ||
| 边缘形态 | 23.712 | < 0.01 | ||
| 分叶 | 76 (79.2) | 9(31.0) | ||
| 毛刺 | 47 (50.0) | 11(37.9) | 1.089 | 0.297 |
GGN病理结果主要包括良性病变、非典型腺瘤样增生、原位腺癌、微浸润腺癌、浸润性腺癌以及浸润性黏液腺癌, 其中良性疾病主要由肺部感染、水肿及其他良性间质性疾病引起, 其在CT上主要表现为模糊的混浊致密影, 密度轻度增加, 局部呈云雾状, 但仍可见血管及支气管结构, 多数是由于肺泡壁组织液增多造成的[7]。GGN通常体积小, 密度低, 形态不典型, 可单发亦可多发, 单发GGN诊断相对困难。
3.1 吸烟史吸烟已经被公认为肺癌最主要的危险因素之一。相关研究表明, 吸烟使肺癌发病率升高的原理可能是长期吸烟引起的慢性炎性反应刺激支气管黏膜上皮, 使其增殖并且使未分化的基底细胞异常增生或者转化为鳞状细胞, 最终促发癌变[8-9]。研究显示, 吸烟与肺癌的发病关系密切[10]。本研究通过对比分析也表明, 浸润组有吸烟史的患者多于非浸润组。国外学者通过进一步分析比较发现, 吸烟史与GGN的发生和进展也存在一定的关系, 大样本对比表明, 有吸烟史患者最初发现GGN所测得直径大于没有吸烟史的患者, 并且其增长的速度更快[11]。
3.2 血清肿瘤标志物CYFRA21-1被认为是一种主要被用于检测肺癌的肿瘤标志物, 是肺泡及气管上皮细胞角质蛋白19的片段之一, 而肺部的良性疾病如肺炎和肺结核等一般不引起CYFRA21-1的升高或升高不明显[12]。本研究结果表明, 浸润组的CYFRA21-1水平高于非浸润组, 浸润组的CEA水平也高于非浸润组, 但这2种标志物的阳性率在两组中比较, 差异均无统计学意义。而CEA作为肿瘤标志物虽然是较早并且广泛应用于临床, 但是不是诊断特定恶性肿瘤的特异性指标, 只在某些恶性肿瘤包括胃肠道恶性肿瘤、乳腺癌、肺癌及其他恶性肿瘤的病情监测、鉴别诊断和治疗效果的评价等方面具有临床应用价值[13]。因此CEA对于GGN癌变与否的提示价值仍存在较大的争议。有学者分析认为GGN即使已经癌变, 但多数仍处于早期状态, 癌细胞释放的CEA仍未大量扩散入血液中, 因此其在GGN癌变患者血清中的含量升高的并不明显[14]。近来, 国内外学者通过对比良恶性GGN中肺泡灌洗液的CEA含量, 结果表明恶性患者CEA水平高于良性患者[15]。针对该类研究, 为利用CEA作为肿瘤标志物来判断GGN的良恶性提供新的思路。
3.3 GGN在HRCT上的表现GGN基本上并没有特异的临床表现, 多数是在体检或者诊治其他疾病过程中发现。虽然GGN的早期发现及随访都是通过普通CT或低剂量CT, 但是HRCT对于GGN却是更重要的存在, 特别是对于pGGN和mGGN的鉴别上, 发挥着重要的作用。本研究中, 浸润组mGGN占比高于非浸润组, 并且结节的直径长于非浸润组。相关研究表明, mGGN的生长速度及癌变的可能性较pGGN高[16], 因此GGN是否存在实性成分及结节的大小对于诊断其浸润与否具有一定应用价值。
分叶征指肿块朝各个方向的生长速度并不一致, 或受周围结构的阻挡, 或多个病灶相互融合, 轮廓向多个方向呈弧形凸起而形成分叶形。相关研究表明, 分叶征在恶性肿瘤中多见, 但仍有较多的良性结节可见分叶征表现, 主要与病灶内部结构及周围结缔组织增生粘连及瘢痕收缩有关[17]。毛刺征指肿块边缘指向肺内的线状影, 其病理表现主要指细胞浸润、淋巴管炎及血栓形成, 或呈纤维组织增生。研究表明, 良、恶性的肺部结节在分叶征及毛刺征方面比较, 差异均具有统计学意义(均P < 0.05)[18]。本研究结果显示, 浸润组和非浸润组仅在分叶征方面比较, 差异具有统计学意义(P < 0.05), 而在毛刺征方面比较, 差异无统计学意义(P>0.05), 可能与标本量较少有关。
空气支气管征、血管集束及邻近结构的胸膜牵拉的病理基础均为肿瘤细胞浸润导致的支气管、血管壁和胸膜受侵, 最终牵拉变形。而空泡征的病理基础主要是尚未被破坏、替代的肺支架结构; 有时肿瘤细胞沿细小支气管壁生长, 阻塞肺泡管也可呈现空泡征[19]。本研究结果表明, 浸润组和非浸润组在空气支气管征、血管集束和邻近结构的胸膜牵拉方面比较, 差异均具有统计学意义(均P < 0.05), 而在空泡征方面比较, 差异无统计学意义(P>0.05)。相关研究表明, 恶性病变主要呈现模糊的界面, 并且其出现率超过良性病变[20]。本研究结果也显示, 两组在界面方面比较, 差异具有统计学意义(P < 0.05)。
综上所述, 肺部存在孤立结节的患者, 若既往有吸烟史, 且在HRCT上呈混合型, 界面模糊, 直径较大, 且存在分叶征、空气支气管征、血管集束及邻近结构的胸膜牵拉, 其病理更倾向于浸润性。考虑孤立肺结节一般在早期状态, CEA和CYFRA21-1并未大量释放入血, 在血液中浓度较低, 所以CEA和CYFRA21-1暂不能作为判断GGN是否浸润的指标。
| [1] |
Nakata M, Takata I, Politis C, et al. Focal ground glass opacuty detecated by low-dose helical CT[J]. Chest, 2013, 121(5): 1464-1467. |
| [2] |
Shin JY, Yoon JK, Nys M, et al. Progress in the treatment and outcomes for early-stage non-small cell lung cancer[J]. Lung, 2018, 65(3): 351-358. |
| [3] |
Cheng X, Zheng D, Li Y, et al. Tumor histology predicts mediastinal nodal status and may be used to guide limited lymphadenectomy in patients with clinical stageⅠnonsmall cell lung cancer[J]. J Thorac Cardiovasc Surg, 2018, 41(6): 2648-2656. |
| [4] |
Ye T, Deng L, Xiang J, et a. Predictors of pathologic tumor invasion and prognosis for ground glass opacity featured lung adenocarcinoma[J]. Ann Thorac Surg, 2018, 101(6): 1682-1690. |
| [5] |
肖时满, 张玉. 超高分辨率CT(UHRCT)鉴别肺原位腺癌(AIS)与微浸润腺癌(MIA)[J]. 复旦学报:医学版, 2014, 32(3): 172-174. |
| [6] |
李献帅, 陈献国. 一种基于回顾性分析的早期非小细胞肺癌手术方式的风险评估模型[J]. 实用肿瘤杂志, 2017, 32(6): 515-520. |
| [7] |
Wang XW, Chen WF, He WJ, et al. CT features differentiating pre- and minimally invasive from invasive adenocarcinoma appearing as mixed ground-glass nodules:mass is a potential imaging biomarker[J]. Clin Radiol, 2018, 98(6): 549-554. |
| [8] |
López-Nicolás Á. Smoking, health-related quality of life and economic evaluation[J]. HEPAC, 2018, 121(5): 747-756. |
| [9] |
Cattaneo SM. Lung cancer screening in the community setting[J]. TATS, 2018, 52(6): 1627-1632. |
| [10] |
Lacourt A. Time-dependent effect of intensity of smoking and of occupational exposure to asbestos on the risk of lung cancer:results from the ICARE case-control study[J]. J Occup Environ Med, 2018, 85(5): 156-159. |
| [11] |
Zeng Y, Bao J. A sandwich-type electrochemical immunoassay for ultrasensitive detection of non-small cell lung cancer biomarker CYFRA21-1[J]. Bioelectrochemistry, 2018, 12(12): 183-189. |
| [12] |
Xie D, Allen MS, Marks R, et al. Nomogram prediction of overall survival for patients with non-small-cell lung cancer incorporating pretreatment peripheral blood markets[J]. EACS, 2018, 67(6): 1214-1222. |
| [13] |
张海华, 张涛. 早期非小细胞肺癌亚肺叶切除临床研究进展[J]. 实用肿瘤杂志, 2019, 32(3): 198-201. |
| [14] |
Xie Y, Zhang Y. Circulating long noncoding RNA act as potential novel biomarkers for diagnosis and prognosis of non-small cell lung cancer[J]. Mol Oncol, 2018, 38(5): 648-658. |
| [15] |
Muley T, Rolny V. The combination of the blood based tumor biomarkers cytokeratin 19 fragments (CYFRA 21-1) and carcinoembryonic antigen (CEA) as a potential predictor of benefit from adjuvant chemotherapy in early stage squamous cell carcinoma of the lung (SCC)[J]. Lung Cancer, 2018, 47(6): 46-53. |
| [16] |
Zhang YP, Heuvelmans MA. Changes in quantitative CT image features of ground-glass nodules in differentiating invasive pulmonary adenocarcinoma from benign and in situ lesions:histopathological comparisons[J]. Clin Radiol, 2018, 78(5): 504-506. |
| [17] |
Cohen JG, Reymond E. CT-texture analysis of subsolid nodules for differentiating invasive from in-situ and minimally invasive lung adenocarcinoma subtypes[J]. Diagn Interv Imag, 2018, 98(5): 291-299. |
| [18] |
Yue X, Liu S. HRCT morphological characteristics distinguishing minimally invasive pulmonary adenocarcinoma from invasive pulmonary adenocarcinoma appearing as subsolid nodules with a diameter of ≤ 3 cm[J]. Clin Radiol, 2018, 214(4): 411-415. |
| [19] |
Chen D, Dai C. New horizons in surgical treatment of ground-glass nodules of the lung:experience and controversies[J]. Ther Clin Risk Manag, 2018, 156(14): 203-211. |
| [20] |
Lee SM, Park CM. CT assessment-based direct surgical resection of part-solid nodules with solid component larger than 5 mm without preoperative biopsy:experience at a single tertiary hospital[J]. Eur Radiol, 2017, 85(12): 5119-5126. |
 2020, Vol. 35
2020, Vol. 35


