文章信息
- 郑海红, 谢伯剑, 朱优优, 张玲娜, 甘梅富
- Zheng Haihong, Xie Bojian, Zhu Youyou, Zhang Linna, Gan Meifu
- BRAFV600E基因检测在术前辅助细针穿刺细胞学诊断甲状腺微小乳头状癌中的意义
- Signifi cance of fi ne-needle aspiration biopsy with BRAFV600E gene detection in preoperative diagnosis of papillary thyroid microcarcinoma
- 实用肿瘤杂志, 2020, 35(3): 228-230
- Journal of Practical Oncology, 2020, 35(3): 228-230
基金项目
- 台州市科技计划项目(1301ky05)
-
作者简介
- 郑海红(1980-), 女, 浙江临海人, 副主任医师, 硕士, 从事肿瘤病理诊断研究.
-
通信作者
- 郑海红, E-mail:zhenghh@enzemed.com
-
文章历史
- 收稿日期:2019-01-24
2. 浙江省台州医院肿瘤外科, 浙江 临海 317000
2. Department of Surgical Oncology, Taizhou Hospital of Zhejiang Province, Linhai 317000, China
在世界范围内, 甲状腺癌是最常见的内分泌恶性肿瘤, 约占所有癌症的1%~5%, 且女性高发[1]。在过去几十年中, 甲状腺癌发病率快速增长。甲状腺癌中最常见类型是甲状腺乳头状癌, 占所有病例的75%~85%, 是全球甲状腺癌增加的主要原因。虽然细针穿刺活检(fine-needle aspiration biopsy, FNAB)细胞学检查在多数情况下可以提供甲状腺病变的明确诊断, 但高达30%的甲状腺FNAB细胞学诊断结果被归类为不确定的[2], 临床上往往需要术中冰冻来明确诊断并决定手术方式。对于患者来说, 往往会延长手术时间, 增加手术麻醉风险。本研究的目的是评估BRAFV600E突变在甲状腺FNAB结果不确定时术前区分甲状腺微小乳头状癌(papillary thyroid microcarcinoma, PTMC)的意义。
1 资料与方法 1.1 一般资料收集2015年1月至2016年12月浙江省台州医院收治的81例甲状腺疾病患者。所有患者均经术前FNAB检查诊断为意义不明的非典型细胞或可疑癌细胞的, 经过手术治疗后有术后明确的病理诊断。其中, 男性19例, 女性62例; 年龄21~71岁, (48.5±10.8)岁; 意义不明的非典型细胞24例, 可疑癌细胞57例。
1.2 研究方法FNAB标本采集:取仰卧位, 颈部垫高, 充分显露穿刺部位。在彩色多普勒超声定位下穿刺。穿刺针保持在负压的条件下, 通过改变穿刺针的方向, 边退针边吸取组织, 反复提插抽取≥ 5次。消除负压, 拔出针头, 无菌棉球按压穿刺部位5 min。尽可能将针管内的标本推至玻璃载玻片上, 涂片后95%乙醇固定, HE染色。将固定好的涂片进行HE染色, 由专业细胞学病理医师作出诊断.细胞学诊断参照甲状腺细胞病理学Bethesda分类法(The Bethesda System for Reporting Thyroid Cytopathology, TBSRTC)[3]:Ⅰ级为无法明确诊断或细胞成分不足: Ⅱ级为良性病变:Ⅲ级为意义不明确的细胞异型性或滤泡性病变; Ⅳ级为滤泡性肿瘤或可疑滤泡性肿瘤:Ⅴ级为可疑甲状腺癌; Ⅵ级为甲状腺癌。另再取一针, 将标本置入10 mL的液基细胞保存液中, 离心, 去除上清液后, 保存在4℃冰箱里直至当前用于基因检测研究。BRAFV600E基因检测试剂盒[闽厦食药监械(准)字2013第1400068号]由厦门艾德生物医药科技有限公司提供的。
1.3 实时定量聚合酶链反应(real-time PCR)检测BRAF基因突变使用厦门艾德生物医药科技有限公司的人类BRAFV600E突变检测试剂盒(国械注准20143401824号), 严格按照使用说明书操作。阴性对照、阳性对照和内控等均按试剂盒说明书进行。待反应结束分析收集荧光信号, 在阴性、阳性对照和内控均在合适范围的前提下, 若待测基因循环阈值(Ct) < 28为BRAFV600E突变阳性结果, Ct ≥ 28则为突变阴性。
2 结果 2.1 甲状腺结节FNAB和BRAFV600E基因突变检测结果81例甲状腺结节FNAB患者中, 24例为意义不明确的细胞非典型病变(图 1A), 其中14例发生BRAFV600E突变, 阳性率为58.3%;57例为可疑乳头状癌细胞(图 1B), 其中50例发生BRAFV600E突变, 阳性率为87.7%;总阳性率为79.0%。
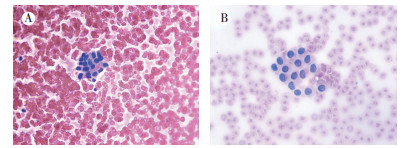
|
| 注 A:红细胞背景下见少量异型增生的滤泡上皮,个别细胞见核沟;B:红细胞背景下见少量异型增生的滤泡上皮,个别细胞见核内包涵体 图 1 甲状腺结节FNAB病理图片(HE ×400) Fig.1 FNAB pathological picture of thyroid nodule |
24例细胞学诊断为意义不明确的细胞非典型病变的病例中, 17例术后病理确诊为PTMC, 7例术后病理诊断为良性病变, BRAFV600E基因突变判断PTMC的阳性预测值为100.0%, 阴性预测值为70.0%。57例细胞学诊断为可疑乳头状癌细胞的病例中, 55例术后病理确诊为PTMC, 2例术后病理诊断为良性病变, BRAFV600E基因突变判断PTMC的阳性预测值100.0%, 阴性预测值为28.6%。两组病例总的阴性预测值为52.9%。术前FNAB联合BRAF基因检测, 可以提高术前FNAB细胞学恶性诊断率, 提高约79.0%(表 1)。
| FNAB检查结果 | BRAF未突变 | BRAF突变 | 阳性预测值(%) | 阴性预测值(%) | |||
| 手术良性 | 手术恶性 | 手术良性 | 手术恶性 | ||||
| 意义不明确的细胞 | 7 | 3 | 0 | 14 | 100.0 | 70.0 | |
| 非典型病变 | |||||||
| 可疑乳头状癌细胞 | 2 | 5 | 0 | 50 | 100.0 | 28.6 | |
BRAFV600E基因突变是甲状腺乳头状癌(papillary thyroid carcinoma, PTC)中最常见的遗传改变, 总的突变率约29%~90%, 且多数学者认为BRAF基因突变与PTC的发生和发展密切相关。BRAF突变最主要是BRAFV600E点突变, 可致使BRAF蛋白结构中V600E的氨基酸突变, 从而使BRAF激酶发生持续性活化。激活丝裂原活化蛋白激酶通路, 从而导致癌变[4]。在本研究中, 72例甲状腺乳头状癌中, BRAFV600E基因突变有64例, 突变率为88.9%。本研究为回顾性研究, 选择手术患者均术前怀疑甲状腺癌, 并且术前细胞学诊断为意义不明确的细胞非典型病变或可疑乳头状癌细胞的, 因此BRAF V600E基因突变检出率较高。
对于PTC来说, BRAFV600E基因突变预示着更差的预后, 如淋巴结转移风险较高, 甲状腺外侵犯, 更晚分期, 血管侵犯, 碘摄取受损, 复发和死亡[5-6]。此外, 据报道, PTC < 1 cm, BRAFV600E突变比其大小更能提示不良预后, 如甲状腺外侵犯和淋巴结转移等[7-9]。
BRAFV600E基因突变检测对PTC诊断有用, 可用于评估甲状腺结节是否存在潜在恶性, 特别是当细针穿刺(fine-needle aspiration, FNA)细胞形态学表现为意义不明确的时候。研究发现≥ 20%的甲状腺结节FNAB细胞学检查显示不确定[10]。在这些情况下, FNAB标本中检测到BRAFV600E突变有利于PTC的诊断, 患者更易于进行外科手术干预, 比单独使用FNAB诊断速度更快[9]。研究表明, 最初在FNAB检查中诊断为意义不确定的患者中有17%检出BRAFV600E突变, 然后被诊断为恶性[11]。本研究接受手术治疗的病例中, 所有BRAFV600E突变阳性患者均确诊为PTMC, 诊断敏感度为100.0%, 阳性预测值为100.0%, 阴性预测值为52.9%。术前FNAB联合BRAF基因检测, 可以提高术前FNAB细胞学恶性诊断率, 与研究报道基本一致[11]。
本研究入组患者细胞学为Ⅲ级及Ⅴ级, 这些患者影像学上往往高度怀疑为恶性, 一般建议手术治疗, 患者接受手术治疗后, 医师选择术中冰冻确定疾病的良恶性, 再决定手术方式。术中冰冻诊断不能作为第一诊断, 会存在误诊。如果术前细胞学能够明确诊断, 一方面能够减少术中冰冻数, 减少病理医师术中冰冻诊断压力, 另一方面手术医师在术前就能更好选择手术方式, 减少术中麻醉风险, 更合理地利用医疗资源。本研究有一定的临床应用价值, 能够指导临床更好的选择手术方式, 节约医疗资源。
| [1] |
La Vecchia C, Malvezzi M, Bosetti C, et al. Thyroid cancer mortality and incidence:a global overview[J]. Int J Cancer, 2015, 136(9): 2187-2195. DOI:10.1002/ijc.29251 |
| [2] |
王利娟. 甲状腺结节细针穿刺细胞学检查联合BRAFV600E基因突变检测穿刺标本临床价值[J]. 临床军医杂志, 2018, 46(2): 205-207. |
| [3] |
Cibas ES, Ali SZ. The bethesda system for reporting thyroid cytopathology[J]. Am J Clin Pathol, 2009, 132(5): 658-665. DOI:10.1309/AJCPPHLWMI3JV4LA |
| [4] |
章美武, 张燕, 范晓翔, 等. 甲状腺细针穿刺细胞学联合BRAF基因检测的诊断价值[J]. 介入放射学杂志, 2017, 26(7): 622-626. DOI:10.3969/j.issn.1008-794X.2017.07.011 |
| [5] |
王成晨, 向大鹏, 李志宇. 甲状腺乳头状癌相关基因突变与其临床病理特征的关系[J]. 实用肿瘤杂志, 2019, 34(3): 239-244. |
| [6] |
Pak K, Suh S, Kim SJ, et al. Prognostic value of genetic mutations in thyroid cancer:a meta-analysis[J]. Thyroid, 2015, 25(1): 63-70. |
| [7] |
Caronia LM, Phay JE, Shah MH. Role of BRAF in thyroid oncogenesis[J]. Clin Cancer Res, 2011, 17(24): 7511-7517. DOI:10.1158/1078-0432.CCR-11-1155 |
| [8] |
Omur O, Baran Y. An update on molecular biology of thyroid cancers[J]. Crit Rev Oncol Hematol, 2014, 90(3): 233-252. |
| [9] |
Xing M, Alzahrani AS, Carson KA, et al. Association between BRAFV600E mutation and mortality in patients with papillary thyroid cancer[J]. JAMA, 2013, 309(14): 1493-501. DOI:10.1001/jama.2013.3190 |
| [10] |
Gharib H, Papini E, Paschke R, et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules:Executive summary of recommendations[J]. J Endocrinol Invest, 2010, 33(Suppl 5): 51-56. |
| [11] |
Brown AE, Lim KS, Corpus G, et al. Detection of BRAF mutation in the cytocentrifugation supernatant fluid from fine-needle aspiration of thyroid lesions may enhance the diagnostic yield[J]. Cytojournal, 2017, 14: 4. DOI:10.4103/1742-6413.200935 |
 2020, Vol. 35
2020, Vol. 35


