文章信息
- 赵为民, 金博, 于震, 王海江
- Zhao Weimin, Jin Bo, Yu Zhen, Wang Haijiang
- MACC1对裸鼠移植HT-29细胞所致结肠癌复发及肝转移的影响
- Effect of MACC1 on recurrence and liver metastasis of colon cancer in nude mice induced by HT-29 cells
- 实用肿瘤杂志, 2020, 35(3): 217-223
- Journal of Practical Oncology, 2020, 35(3): 217-223
基金项目
- 新疆维吾尔自治区自然科学基金(2017D01C386)
-
作者简介
- 赵为民(1973-), 男, 重庆人, 主任医师, 硕士, 从事胃肠肿瘤基础与临床研究.
-
通信作者
- 王海江, E-mail:Wanghaijiang@medmail.com.cn
-
文章历史
- 收稿日期:2019-08-15
结直肠癌在世界及我国都是最常见的消化道系统恶性肿瘤之一, 发病率呈逐年增高趋势[1]。每年全球新发结直肠癌患者约180万例, 占所有新发癌症患者的10%[2]。2015年我国新发结直肠癌患者37.63万例, 因结直肠癌死亡例数为19.1万例, 病死率高达50.8%[3]。目前结直肠癌的治疗方法以手术为主, 辅助以药物的局部治疗、靶向治疗、免疫治疗和化疗等综合疗法, 但因复发和转移导致患者死亡率仍然较高[4-5]。据统计, 接受根治性手术治疗的患者中仍有30%~50%最终出现局部复发或远处转移, 盆腹腔手术区域、吻合口、腹膜和肝脏等是常见的转移部位[6]。复发和转移是导致结肠癌治疗失败的主要原因。抑制结肠癌术后的复发转移可提高患者的生存率和生存质量[7]。
结肠癌转移相关基因1(metastasis-associated in colon cancer l, MACC1)是与结肠癌转移相关的基因[8]。MACC1在正常组织中存在少量表达, 在多种恶性肿瘤中存在异常高表达, 但在结肠癌细胞中表达水平最高。研究表明, MACC1表达的增高常伴随恶变发生, 高表达MACC1 mRNA的患者5年生存率降低, 死亡风险增加[9]。MACC1与肿瘤的临床病理特征、发展及预后等有较强的关联性, 可作为转移和预后的独立评价指标[10]。尽管近年来, MACC1表达水平反映原发肿瘤的远处转移能力得到越来越多的临床证实, 但是关于MACC1基因与结肠癌复发及转移的直接关系研究尚不充分, 尤其是与术后复发转移关系的研究仍比较少。本研究开展MACC1基因敲降对结肠癌细胞在裸鼠体内侵袭转移能力的调控作用, 以期为结肠癌的靶向MACC1基因治疗提供理论基础, 为癌症的分子靶向治疗提供一种新的治疗思路和选择。
1 材料与方法 1.1 细胞与动物人结肠癌HT-29细胞株购自中国科学院上海细胞研究所; 裸鼠购自常州卡文斯实验动物有限公司。
1.2 试剂与仪器胎牛血清、达尔伯克必需基本培养液(dulbecco's minimum essential medium, DMEM)、青链双抗、5%胎牛血清(fetal bovine serum, FBS)、胰蛋白酶和磷酸缓冲盐溶液(phosphate buffer solution, PBS)均购自美国Hyclone公司。shRNA干扰质粒购自苏州吉玛基因股份有限公司。Lipofectamine 2000和Trizol购自美国Invitrogen公司。SYBRGreen PCR试剂盒和反转录试剂盒购自美国Thermo公司。Hoechst购自上海碧云天公司。MACC1一抗购自北京博奥森公司。菁染料3(cyanine dye 3, CY3)荧光素标记和异硫氰酸荧光素酯(fluorescein isothiocyanate isomer Ⅰ, FITC)荧光素标记的二抗购自美国Protein-Tech公司。噻唑蓝(thiazolyl blue, MTT)、二甲基亚砜(dimethyl sulfoxide, DMSO)和焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)处理水购自美国Sigma公司。4%多聚甲醛和0.1%Triton购自上海润捷公司。氯仿、异丙醇和无水乙醇购自上海国药集团。细胞培养瓶、6孔板和96孔板购自美国Corning公司。细胞培养箱和酶标检测仪购自美国Thermo公司。光学显微镜和倒置拍照显微镜购自日本OLYMPUS公司。超净工作台购自苏州安泰科技有限公司。离心机、低温冷冻离心机和移液器购自德国Eppendorf公司。反转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)仪购自美国ABI公司。
1.3 细胞培养将HT-29结肠癌细胞培养于含10%胎牛血清的DMEM完全培养液中(含青霉素1×105U/L和链霉素100 mg/L), 置于37℃的饱和湿度培养箱中培养(含5%CO2)。每2天换液1次, 融合度达约90%时传代。
1.4 质粒转染构建MACC1基因敲降的HT-29细胞根据Pubmed基因库中MACC1(Reference Sequence NM_182762)的序列, 设计合成干扰质粒shRNA-1(Clone ID:NM_182762.3-6266s21c1)序列为5'-CCGGGCGTGACTTAGGATAAGATTTCTCGAGAAATCTTATCCTAAGTCACGCTTTTTG-3'; shRNA-2(Clone ID:NM_182762.3-466s21c1)序列为5'-CCGGTTCACCCTTCGTGGTAATAATCTCGAGATTATTACCACGAAGGGTGAATTTTTG-3'; shRNA-3(Clone ID:NM_182762.3-794s21c1)序列为5'-CCGGAGATCCTACTACACGACTTAGCTCGAGCTAAGTCGTGTAGTAGGATCTTTTTTG-3';对照质粒shRNA-NC序列为5'-CCGGTCAAGGAGGGTCAGTACAATTCTCGAGAATTGTACTGACCCTCCTTGATTTTTG-3'。采用PLKO.1载体, 制备转染复合物shRNA-Lipofectamine, 将MACC1干扰质粒shRNA-1、shRNA-2、shRNA-3及对照质粒shRNA-NC用100 μL无血清培养液稀释后混匀得A液; 用100 μL无血清培养液稀释7.5 μLLipofectamine 2000, 轻轻混匀, 室温孵育5 min后得B液; 将A和B的液体加在一起, 轻轻混匀, 室温孵育20 min, 得shRNA-Lipofectamine的复合物。
调整HT-29细胞浓度为1×105/mL接种于6孔板, 每孔2 mL, 细胞培养箱内培养24 h, 观察细胞铺满约80%面积时, 将上清液弃去, 预冷的PBS清洗细胞, 每孔分别加入200 μL的shRNA-1、shRNA-2、shRNA-3或shRNA-NC转染复合物, 轻轻前后摇匀, 再在培养箱内培养4 h后, 弃去上清液, 加入3 mL的完全培养液, 置于培养箱内再培养48 h后分别得到HT-29+shRNA-1细胞、HT- 29+shRNA-2细胞、HT-29+shRNA-3细胞和HT- 29+shRNA-NC细胞, 收样后进行相关检测。
1.5 RT-PCR检测MACC1的mRNA表达水平调整HT-29细胞浓度为1×105/mL接种于6孔板, 每孔2 mL, 细胞培养箱内培养24 h后, 用胰蛋白酶消化离心收集细胞后用Trizol提取试剂盒提取总RNA, 按照Thermo反转录试剂盒K1622说明书将所提取的总RNA反转录为cDNA后再进行荧光定量PCR反应。引物由上海生工公司设计并合成, 所用引物序列见表 1。采用管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参。采用2-△△ CT法分析目的基因在各组之间的表达差异。
| 引物 | 序列 |
| MACC1 (人)-正向序列 | 5'-TTGCGGAGGTCACCATAGC-3' |
| MACC1 (人)-反向序列 | 5'-ATTTCCAACAACGGGCTCA-3' |
| GAPDH (人')-正向序列 | 5'-AGAAGGCTGGGGCTCATTTG-3' |
| GAPDH (人)-反向序列 | 5'-AGGGGCCATCCACAGTCTTC-3' |
调整HT-29细胞浓度为1×105/mL接种于6孔板, 每孔2 mL, 细胞培养箱内培养24 h后, 用预冷的PBS漂洗2次, 4%多聚甲醛固定后, 0.1%Triton室温下处理15 min, PBS清洗2次, 5%FBS封闭15 min, 4℃下孵育MACC1一抗过夜, PBS清洗后加二抗, 37℃孵育1 h, 室温避光孵育Hoechst 15 min对比染色, 荧光显微镜下拍照。
1.7 MTT法测定细胞增殖调整HT-29细胞浓度为5×104/mL接种于96孔板, 每孔200 μL, 细胞培养箱内培养48 h后, 每孔加入MTT溶液(5 mg/mL)20 μL, 继续孵育4 h后, 吸弃去孔内上清液, 每孔加入200 μL DMSO, 室温振荡5 min, 结晶物充分溶解后, 用酶标仪在490 nm波长处检测各孔吸光度(absorbance, A)值, 计算抑制率:抑制率=(1-A处理组/A对照组)×100%。
1.8 结肠癌裸鼠术后复发模型的建立裸鼠适应性饲养1周后, 随机分为HT-29裸鼠术后局部复发模型组(注射HT-29结肠癌细胞株)、HT-29+shRNA裸鼠术后局部复发模型组(注射1.4中制备的HT-29+shRNA-2细胞)和HT- 29+shRNA-NC裸鼠术后局部复发模型组(注射1.4中制备的HT-29+shRNA-NC细胞), 每组6只。三组裸鼠在腹皮下注射0.2 mL相应的瘤细胞悬液, 待肿块生长出现后轻柔推动肿块, 于距离肿块边缘>5 mm处切除肿瘤, 后缝合伤口, 继续饲养8周后, 记录各组原肿瘤切除部位出现局部复发肿瘤的直径及重量并统计分析。
1.9 结肠癌裸鼠肝转移模型的建立裸鼠适应性饲养1周后, 随机分为HT-29裸鼠结肠癌肝转移模型(注射HT-29结肠癌细胞株)、HT-29+shRNA裸鼠结肠癌肝转移模型(注射1.4中制备的HT-29+shRNA-2细胞)和HT- 29+shRNA-NC裸鼠结肠癌肝转移模型(注射1.4中制备的HT-29+shRNA-NC细胞), 每组6只。参照文献[11], 按照40 mg/kg体质量的标准, 分别用1%戊巴比妥钠腹腔内注射麻醉, 将裸鼠固定于手术台上, 皮肤消毒后, 于左上腹行纵行小切口约1 cm, 进腹后于左腹腔外侧找到脾, 切断胃短血管和胃脾韧带, 完全游离脾脏, 并将其小心搬出切口外; 由脾下极进针, 缓慢注入浓度为2×107/mL的三组结肠癌细胞株悬液0.2 mL, 注射后约5 min, 可见注射部位变红、肿胀后拔针, 用乙醇棉球按压注射针眼直至无活动性出血, 依次间断缝合腹膜和皮肤, 关腹。7周后处死裸鼠并剖腹观察肿瘤转移情况, 记录裸鼠的肝转移瘤直径、肝转移瘤质量、肝表面隆凸、病灶间融合及肝转移复发临床风险评分(clinical risk score, CRS)。
1.10 统计学分析采用SPSS22.0统计软件进行数据分析。数据采用均数±标准差(
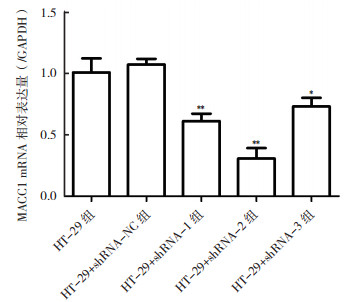
在HT-29细胞中转染不同靶序列的干扰质粒后, mRNA表达水平变化结果见图 1。结果显示, 与HT-29组比较, HT-29+shRNA-NC细胞中目的基因MACC1的表达无影响, HT-29+shRNA-1细胞、HT-29+shRNA-2细胞和HT-29+shRNA-3细胞中MACC1的表达水平均不同程度地降低(均P < 0.05), 其中shRNA-2敲降效果最为显著, MACC1的表达水平降低69.9%。
|
| 注 *与HT-29组比较,P < 0.05;**与HT-29组比较,P < 0.01 图 1 4种shRNA转染HT-29细胞后MACC1 mRNA的相对表达量 Fig.1 MACC1 mRNA level in HT-29 cells transfected with 4 different shRNAs |
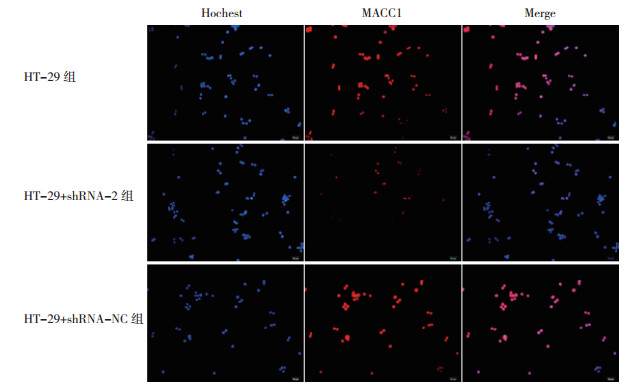
免疫荧光标记转染shRNA-2的HT-29细胞及其对照细胞显示, MACC1蛋白主要表达分布在HT-29细胞核内。HT-29细胞转染shRNA-2干扰质粒后MACC1蛋白表达减少, 转染shRNA-NC对MACC1蛋白的表达无影响(图 2)。
|
| 图 2 免疫荧光标记MACC1在HT-29细胞内表达(×100) Fig.2 Immunofluorescence labeled MACC1 expression in HT-29 cells (×100) |
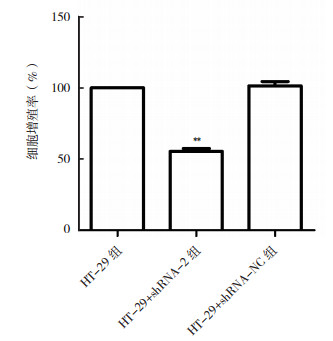
各处理组细胞增殖实验结果显示, 与HT-29组比较, 转染shRNA-2后抑制细胞增殖(P < 0.01), 转染48 h后细胞增殖率降低45.2%(图 3)。转染shRNA-NC 48 h后, 细胞增殖能力与HT-29组比较, 差异无统计学意义(P>0.05)。
|
| 注 **与HT-29组比较,P < 0.01 图 3 MACC1基因敲降抑制HT-29细胞增殖 Fig.3 Knocking-down MACC1 inhibited proliferation of HT- 29 cells |
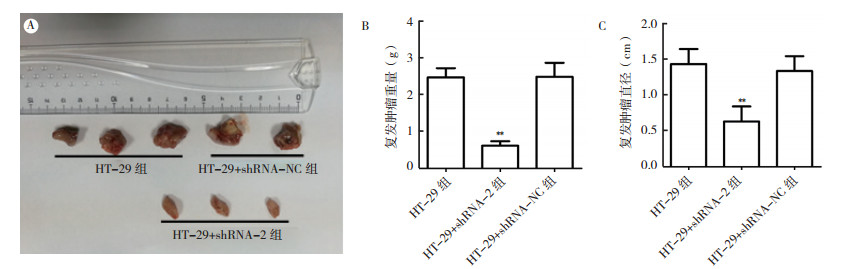
各处理组裸鼠的复发结肠癌结果显示, 三组均出现复发。与HT-29组比较, HT-29+shRNA-2组裸鼠的移植瘤切除8周后复发肿瘤直径及重量分别降低55.8%和75.3%(均P < 0.01, 图 4)。HT- 29+shRNA-NC组与HT-29组比较, 复发肿瘤直径和重量差异均无统计学意义(均P>0.05)。
|
| 注 A:肿瘤复发形态图;B:复发肿瘤重量直方图;C:复发肿瘤直径直方图;**和HT-29组比较,P < 0.01 图 4 MACC1基因敲降抑制HT-29细胞移植瘤切除8周后裸鼠体内肿瘤复发 Fig.4 Knocking-down MACC1 inhibited recurrence of HT-29 cells after 8 weeks of tumor resection in nude mice |
各处理组裸鼠的结肠癌肝转移表观情况显示, HT-29组和HT-29+shRNA-NC组肝脏转移的裸鼠肝表面能看到多发性的白色结节, 大小不一, 而HT-29+shRNA-2组肝脏质地柔软, 颜色鲜红, 只有少量结节(图 5)。对各处理组的肝转移情况进行统计结果显示, 移植7周后与HT-29组比较, HT-29+shRNA-2组裸鼠肝转移形成的肿瘤结节数量和直径均降低, 肝脏质量变大趋势被抑制, 形成的肿瘤融合面积降低(均P < 0.01, 表 2)。
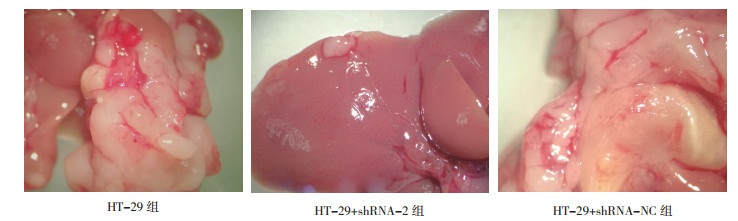
|
| 图 5 MACC1基因敲降的HT-29细胞移植7周后裸鼠体内肝转移病理形态图 Fig.5 Morphology and pathology of liver metastasis in nude mice after 7 weeks of injection with MACC1 knocked down HT-29 cells |
| 肝转移肿瘤形态学参数 | HT-29组 | HT-29+shRNA-2组 | HT-29+shRNA-NC组 |
| 肝转移肿瘤结节数量(个) | 16.83±1.47 | 2.50±1.05** | 16.67±1.75 |
| 肝转移肿瘤直径(mm) | 3.70±0.43 | 1.23±0.24** | 3.52±0.56 |
| 肝体质量(g) | 2.52±0.21 | 1.45±0.19** | 2.62±0.24 |
| 病灶间融合(%) | 80.67±4.89 | 6.83±1.94** | 77.67 ±6.25 |
| 注 **和HT-29组比较,P < 0.01 | |||
结直肠癌患者术后2年内复发转移率高达70%, 复发患者中约50%出现结直肠癌肝转移, 术后结直肠癌的复发和肝转移是导致患者死亡的主要原因[12]。患者术后无转移生存时间长短与MACC1的表达含量有关, MACC1高表达的患者无转移生存时间远低于低表达的患者, 是影响结肠癌术后无转移生存时间的独立危险因素[8]。研究表明, 红花多糖、大蒜素和丹参酮Ⅱ A等多种天然药物成分对体外培养的HT-29结肠癌细胞增殖和凋亡具有调节作用[13-14]。MACC1对HT-29结肠癌细胞的增殖和迁移的作用尚未见报道。研究MACC1对HT-29结肠癌细胞生物特性的影响, 对发现药物作用于MACC1靶点具有潜在意义。
本研究首先采用shRNA稳定转染方法建立敲降MACC1的HT-29结肠癌细胞, 结果显示当转染3种干扰质粒后, MACC1的mRNA表达水平均降低, 提示采用该方法可阻断HT-29结肠癌细胞MACC1的高表达, 干扰后的少量表达符合MACC1也在正常组织表达的特征[10]。采用对MACC1敲降效果最为显著的HT-29+shRNA-2细胞, 考察其在裸鼠体内复发和肝转移的影响。MACC1在正常组织中主要位于细胞核中, 而发生转移的肿瘤中的MACC1主要位于细胞核中[15]。本实验采用的HT-29结肠癌细胞, 经免疫荧光标记显示MACC1主要存在于细胞核, 转染shRNA-2后可见MACC1的表达减少。
目前肿瘤细胞学研究表明, 肿瘤细胞发生转移是一个由多种因素调控和多阶段发展的持续过程。在此过程中, 凡是能影响肿瘤细胞增殖速度和转移潜能的因素对最终形成肿瘤的转移都至关重要, 而肿瘤细胞自身所具有的增殖和迁移能力是最基本的条件[16]。本研究的结果显示, 敲降MACC1后, HT-29结肠癌细胞的增殖能力下降, 该结果与减少MACC1表达可抑制恶性黑色素瘤细胞和肺腺癌细胞的增殖一致[17-18]。进一步进行体内研究, 将人结肠癌细胞株HT-29移植到裸鼠体内, 此种模型为异种移植模型。异种移植模型能够很好体现肿瘤肝转移的发生和发展过程, 移植人源细胞可以反映人结肠癌患者癌转移的生物学特性, 宿主是缺乏免疫功能的裸鼠, 因此异种移植瘤模型发生肝转移时间短且成功率高, 对于临床前期药物的评估存在非常重要的意义[19]。本实验结果显示, 敲降MACC1的HT-29结肠癌细胞在裸鼠复发结肠癌模型中生长变慢, 同时可抑制裸鼠术后结肠癌肝转移过程, 降低形成肝转移瘤的数量、直径和病灶间融合, 进一步证实降低MACC1的表达可抑制HT-29结肠癌细胞的增殖和迁移能力, 进而可抑制结肠癌的复发和转移。
综上所述, 本研究发现, 敲降结肠癌细胞的MACC1可抑制HT-29结肠癌细胞的增殖能力, 减少结肠癌的复发和转移。虽然该过程的机制仍需深入研究, 但本实验为揭示MACC1在结直肠癌中的作用及今后药物治疗新靶点提供了参考。
| [1] |
黄春妍, 陆艳, 王临池, 等. 苏州市结直肠癌死亡时空分布特征分析[J]. 实用肿瘤杂志, 2019, 34(4): 362-366. |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. Ca Cancer J Clin, 2016, 66(2): 115-132. |
| [4] |
Vermeer NCA, Snijders HS, Holman FA, et al. Colorectal cancer screening:Systematic review of screen-related morbidity and mortality[J]. Cancer Treatment Rev, 2017, 54(2): 87-98. |
| [5] |
周冰川.结直肠癌根治术后复发病例的回顾性分析[D].南宁: 广西医科大学肿瘤医学院, 2017.
|
| [6] |
陈佳琦, 董彩霞, 袁瑛. 2018年结直肠癌治疗研究进展[J]. 实用肿瘤杂志, 2019, 34(1): 6-11. |
| [7] |
桑蝶, 马飞, 王佳玉, 等. 结肠癌肝转移患者行肝移植术的临床探索[J]. 临床药物治疗杂志, 2015, 13(2): 62-64. |
| [8] |
Stein U, Walther W, Arlt F, et al. a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J]. Nat Med, 2009, 15(1): 59-67. |
| [9] |
Shimokawa H, Uramoto H, Onitsuka T, et al. Overexpression of MACC1 mRNA in lung adenocarcinoma is associated with postoperative recurrence[J]. J Thorac Cardiovasc Surg, 2011, 141(4): 895-898. |
| [10] |
廖小春, 曹友德. 结肠癌转移相关基因-1在肿瘤中的研究进展[J]. 实用预防医学, 2017, 24(4): 510-512. |
| [11] |
李华驰, 熊治国, 谢敏, 等. 结肠癌肝转移裸鼠模型的建立[J]. 中国比较医学杂志, 2019, 29(5): 63-68. |
| [12] |
Van Cutsem E, Nordlinger B, Cervantes A. Advanced colorectal cancer:ESMO Clinical Practice Guidelines for treatment[J]. Ann Oncol, 2010, 21(Suppl 5): v93-97. |
| [13] |
艾亮, 程俊, 李晓清, 等. 红花多糖可显著抑制HT29结直肠癌细胞增殖[J]. 基因组学与应用生物学, 2019, 38(6): 2781-2786. |
| [14] |
李喜霞, 石文娟, 胡邱宇, 等. 丹参酮Ⅱ A对人结肠癌HT29细胞TGF-β1、Bcl-2表达和细胞生长的影响[J]. 西安交通大学学报:医学版, 2019, 40(4): 653-657. |
| [15] |
Yang JJ, Yang JH, Kim J, et al. Soluble c-Met protein as a susceptible biomarker for gastric cancer risk:A nested case-control study within the Korean Multicenter Cancer Cohort[J]. Int J Cancer, 2013, 132(9): 2148-2156. |
| [16] |
Poutahidis T, Erdman SE. Commensal bacteria modulate the tumor microenvironment[J]. Cancer Lett, 2016, 380(1): 356-358. |
| [17] |
Zhang C, Li H, Wang J, et al. MicroRNA-338-3p suppresses cell proliferation, migration and invasion in human malignant melanoma by targeting MACC1[J]. Exp Ther Med, 2019, 18(2): 997-1004. |
| [18] |
Li Z, Guo T, Fang L, et al. MACC1 overexpression in carcinoma associated fibroblasts induces the invasion of lung adenocarcinoma cells via paracrine signaling[J]. Int J Oncol, 2019, 54(4): 1367-1375. |
| [19] |
欧阳国庆, 潘光栋, 吴永融, 等. 小鼠结直肠癌肝转移原位瘤模型[J]. 世界华人消化杂志, 2018, 26(8): 512-517. |
 2020, Vol. 35
2020, Vol. 35


