文章信息
- 黄雅菁, 洪波, 陈丽荣, 许晶虹
- 5例结直肠颗粒细胞瘤临床病理学分析
- 实用肿瘤杂志, 2020, 35(3): 208-210
-
作者简介
- 黄雅菁(1989-), 女, 安徽亳州人, 住院医师, 硕士, 从事肿瘤分型及靶点识别研究.
-
通信作者
- 黄雅菁, E-mail:hyj0087@zju.edu.cn
-
文章历史
- 收稿日期:2019-12-31
颗粒细胞瘤(granular cell tumor, GCT)是一种来源于外周神经, 具有施万细胞(Schwann's cell)分化特点的罕见软组织肿瘤, 免疫组织化学显示为S-100阳性, 绝大多数为良性, 由Abrikossof[1]于1926年首次报道。颗粒细胞瘤可发生于身体的任何部位, 但好发于头颈部、躯干和四肢及外阴的皮肤及皮下组织, 发生于消化道者仅占全部GCT的8%, 部位以食管最为常见, 其次是胃和结肠[2-4]。笔者对5例结直肠GCT进行分析研究, 并复习相关文献, 以探讨其临床病理特征。
1 资料与方法 1.1 一般资料收集2015年12月至2018年2月浙江大学医学院附属第二医院病理科诊断为GCT的发生于结直肠的病例5例, 所有病例均重新复习组织学、免疫组织化学及内镜检查资料, 确诊依据2013年版WHO骨与软组织肿瘤分类诊断标准[5]。
1.2 方法所有标本均为内镜切除标本, 经4%甲醛固定, 常规石蜡包埋、切片, HE染色。免疫组织化学染色采用EnVision两步法, 一抗购自北京中杉公司, 二抗购自瑞士罗氏Ventana公司。选用抗体包括S-100、vimentin、CgA、Syn、desmin、SMA、DOG-1、CD117、CD34、NF、P53和Ki-67等。
2 结果 2.1 临床特征5例结直肠GCT患者年龄18~56岁, 平均41.6岁; 其中男性2例, 女性3例, 男女比例为2:3。2例消化道GCT位于盲肠, 1例位于升结肠, 2例位于横结肠。所有患者均为行内镜检查时发现黏膜下隆起, 且黏膜表面光滑。肿瘤直径为0.3~1.0 cm。
2.2 病理学及免疫组织化学特征5例结直肠GCT均为内镜下切除标本。肿瘤直径0.3~1.0 cm, 均累及黏膜层和黏膜下层, 肿瘤界限不清, 无明显包膜, 呈侵袭性生长(图 1A)。瘤细胞体积大, 呈多边形或梭形, 胞质丰富且含多量嗜酸性颗粒, 核小, 核仁不明显, 核分裂相罕见, 瘤细胞呈巢状或片状分布(图 1B)。均符合非典型颗粒细胞瘤的特征。免疫组织化学检查示, 5例病例均呈弥漫强阳性表达S-100(图 1C), 均不表达SMA、desmin、CD117和DOG-1。CD34瘤细胞阴性表达, 但瘤细胞周围间质强阳性, 将肿瘤围成巢状(图 1D)。Ki-67增殖指数较低, 均 < 2%。PAS染色示阳性。
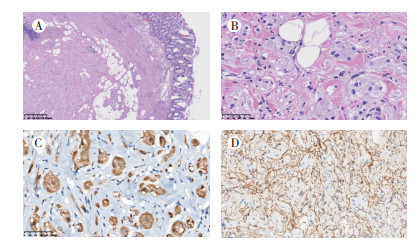
|
| 注 A:肿瘤界限不清,无明显包膜,侵袭性生长(HE×100);B:肿瘤细胞体积大,呈多边形及梭形, 胞质丰富且含多量嗜酸性颗粒, 核小, 核仁不明显,核分裂相罕见,呈巢片状分布(HE×200);C:肿瘤细胞弥漫强阳性表达S-100(EnVison×200);D:肿瘤细胞不表达CD34,但瘤细胞周围间质强阳性,将肿瘤围成巢状(EnVison×100) 图 1 GCT的形态学及免疫组织化学特征 |
GCT是一种罕见的软组织肿瘤, 免疫表型和超微结构分析提示其起源于周围神经系统。临床上好发于舌和全身皮下软组织, 也可发生于消化道等部位。发生于消化道时主要累及食管, 其次是胃, 发生于结直肠者最罕见。笔者总结3年来诊断为消化道GCT的发生于结直肠的病例5例并分析其临床病理特征、诊断及鉴别诊断要点, 以帮助病理及临床医师全面认识该肿瘤。
3.1 消化道GCT的临床特征GCT可发生于消化道的各段, 多见于30~60岁的患者。多数患者无明显临床表现, 肿瘤常于内镜检查时偶然发现。若患者出现明显的临床症状, 则由不同的发病部位而表现各异[6-7]。食管GCT可有胸骨后不适、吞咽困难、餐后上腹部不适及上消化道出血等; 胃GCT可有上腹部不适或疼痛、排空障碍及消化道出血; 结直肠和盲肠GCT可出现腹泻、梗阻和消化道出血; 阑尾部GCT则可出现急性阑尾炎样症状。
3.2 结直肠GCT的病理特征近年来, 免疫组织化学和电子显微镜研究证实, GCT来源于外周神经系统的施万细胞。光学显微镜下肿瘤细胞多呈多边形或卵圆形; 瘤细胞体积较大, 胞质丰富, 具有分布均匀的嗜酸性颗粒; 胞核较小, 居中, 大小较一致, 核分裂相罕见; 坏死罕见或缺乏; 瘤细胞间可见粗细不等的纤维组织分隔。瘤细胞常呈巢状或片状排列, 多位于黏膜下层, 边界不清, 常浸润临近黏膜层和肌层。免疫组织化学显示肿瘤细胞S-100和vimentin强阳性表达, desmin、SMA、EMA、NF及keratin呈阴性表达[8]。消化道GCT的诊断标准[9]:(1)肿瘤主要由体积较大和胞质内有嗜酸性颗粒的瘤细胞构成, 瘤细胞密集排列呈巢状或条索状结构; (2)瘤细胞质内嗜酸性颗粒PAS染色阳性; (3)瘤细胞S-100阳性表达。结肠的GCT瘤细胞多呈梭形, 符合非典型GCT, 其分子机制有待进一步探究。
3.3 结直肠GCT的良恶性及非典型的鉴别良恶性GCT在组织学上的差异不明显, 恶性GCT少见, 且少数病例组织学上呈良性GCT样表现, 而临床上已发生转移。所以, 良恶性GCT的鉴别要点在于其有无临床上的恶性表现, 包括有无转移和是否侵犯肌层等。GCT良恶性的诊断要点[10]:肿瘤性坏死、梭形细胞、空泡状核和大核仁、核分裂相(>2个/10 HPF或5个/50 HPF)、多形性及高核浆比等。上述6项特征满足≥ 3项者, 诊断为恶性; 满足1项或2项者, 诊断为非典型性; 若无上述特征, 则诊断为良性。总之, 肿瘤有无发生转移及肌层浸润对鉴别其良恶性具有重要意义。本组5例消化道GCT位于黏膜层和黏膜下层, 且均有梭形细胞改变, 符合非典型GCT。
3.4 结直肠GCT的鉴别诊断消化道多无明显的临床症状, 常于内镜检查时偶然发现, 且内镜下缺乏特征性的表现, 难以与其他黏膜下肿瘤鉴别, 故消化道GCT需由病理活检来确诊[2-4]。组织学上, 发生于结直肠的GCT需与如下肿瘤相鉴别:(1)胃肠道间质瘤, 常由特征性的梭形细胞构成, 胞质两端可见空泡, 胞质内无GCT的特征性嗜酸性颗粒状改变, 且免疫组织化学标志物CD117、DOG-1和CD34阳性, 不表达神经标志物; (2)神经鞘瘤, 细胞较大, 胞质淡伊红色, 核染色质疏松均匀, 瘤细胞排列紧密, 细胞间界限不清或融合成合体细胞样, 瘤细胞弥漫性表达S-100蛋白, 但常无嗜酸性颗粒状细胞质; (3)平滑肌瘤, 消化道平滑肌瘤细胞分界清楚, 结节状排列, 胞质常嗜伊红淡染, 无嗜酸性颗粒状胞质, 瘤细胞表达SMA和desmin蛋白, 而不表达神经源性的S-100。
结直肠GCT是一种罕见的外周神经系统来源的软组织肿瘤, 生物学行为常表现为惰性, 临床经过常为良性, 其特征性的组织学和免疫组织化学表型可帮助鉴别诊断。其分子机制及药物治疗有待进一步探究。创伤性较小的经内镜切除常为首选的治疗方式[11], 对内镜提示肿瘤已侵及肌层的病变, 则应采取手术治疗。
| [1] |
Abrikossoff A. Uber Myome' ausgehend von der uergestreiften will-kurlichen Muskulatur[J]. Virchows Arch Pathol Anat, 1926, 260(1): 215-233. DOI:10.1007/BF02078314 |
| [2] |
Narra SL, Tombazzi C, Datta V, et al. Granular cell tumor of the esophagus:report of five cases and review of the literature[J]. Am J Med Sci, 2008, 335(5): 338-341. DOI:10.1097/MAJ.0b013e3181568197 |
| [3] |
刘素丽, 邢国璋. 消化系统颗粒细胞瘤的研究进展[J]. 中国肿瘤临床, 2009, 36(14): 838-840. DOI:10.3969/j.issn.1000-8179.2009.14.017 |
| [4] |
Sohn DK, Choi HS, Chang YS, et al. Granular cell tumor of colon:report of a case and review of literature[J]. World J Gastroenterol, 2004, 10(16): 2452-2454. DOI:10.3748/wjg.v10.i16.2452 |
| [5] |
Fletcher CD, Bridge JA, Hogendoorn PC, et al. WHO classifi-cation of tumours of soft tissue and bone[M]. 4th ed. Lyon: IARC Press, 2013: 178-179.
|
| [6] |
Johnston J, Helwing EB. Granular cell tumors of the gastrointestinal tract and perianal region:a study of 74 cases[J]. Dis Dis Sci, 1981, 26(9): 807-816. DOI:10.1007/BF01309613 |
| [7] |
Yasuda A, Yasuda T, Imamoto H, et al. A case of a gastric granular cell tumor preoperatively diagnosed and successfully treated by single-incision laparoscopic surgery[J]. Surg Case Rep, 2020, 44(6): 1-7. |
| [8] |
Parfitt JR, McLean CA, Joseph MG, et al. Granular cell tumors of the gastrointestinal tract:expression of nestin and clinicopathological evaluation of 11 patients[J]. Histopathology, 2006, 48(4): 424-430. DOI:10.1111/j.1365-2559.2006.02352.x |
| [9] |
王坚, 朱雄增.软组织肿瘤病理学[M].北京: 人民卫生出版社, 2008: 421-430.
|
| [10] |
David O, Jakate S. Multifocal granular cell tumor of the esophagus and proximal stomach with infiltrative pattern:a case report and review of the literature[J]. Arch Pathol Lab Med, 1999, 123(10): 967-973. |
| [11] |
Yasuda I, Tomita E, Nagura K, et al. Endoscopic removal of granular cell tumors[J]. Gastrointest Endosc, 1995, 41(2): 163-167. DOI:10.1016/S0016-5107(05)80604-2 |
 2020, Vol. 35
2020, Vol. 35


