文章信息
- 潘理会, 李育庄, 李春辉
- Pan Lihui, Li Yuzhuang, Li Chunhui
- 结直肠癌中C-erbB-2基因扩增与KRAS基因突变的意义
- Significance of C-erbB-2 gene amplification and KRAS gene mutation in colorectal cancer
- 实用肿瘤杂志, 2020, 35(1): 48-52
- Journal of Practical Oncology, 2020, 35(1): 48-52
基金项目
- 河北省医学适用技术跟踪资助项目(G2018070)
-
作者简介
- 潘理会(1965-), 女, 满族, 河北承德人, 副教授, 硕士, 从事结肠癌基础与临床研究.
-
通信作者
- 李春辉, E-mail:chli612@126.com
-
文章历史
- 收稿日期:2018-08-22
2. 承德医学院附属医院病理科, 河北 承德 067000
2. Pathology Department, Affiliated Hospital of Chengde Medical College, Chengde 067000, China
结直肠癌(colorectal cancer, CRC)是一种常见的恶性肿瘤,据我国最新恶性肿瘤流行病学数据表明,CRC发病率和死亡率呈逐年上升趋势,男性和女性发病率分别居于第4位及第3位, 死亡率分别居于第5位及第4位, 严重威胁人类的健康[1]。近年研究表明,CRC的发生、发展与多种基因突变及其所构成的信号转导通路的调控异常密切相关,其中表皮生长因子受体(epidermal growth factor receptor, EGFR)介导的RAS/RAF/MAPK是一条重要的信号通路[2]。表皮生长因子受体-2(human epidermal growth factor receptor 2, HER-2, 又为C-erbB-2)与EGFR同源,二者具有高度相似的生物学特性;鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene, KRAS)是癌基因RAS家族中与人类肿瘤关系最为密切的一种表现形式,为C-erbB-2信号通路下游的重要效应分子。目前,作为同一信号通路上的C-erbB-2与KRAS对肿瘤生物学行为的影响倍受关注。本研究分别采用荧光原位杂交(fluorescence in situ hybridization, FISH)法和荧光实时定量聚合酶链式反应(real time quantity polymerase chain reaction,qRT-PCR)法检测CRC组织中C-erbB-2基因扩增和KRAS基因突变状况,为临床诊断和治疗提供理论指导。
1 资料与方法 1.1 一般资料收集2012年12月至2016年12月间承德医学院附属医院胃肠外科行结直肠癌根治术并经病理证实的结直肠癌蜡块标本238例。所有病例术前均未经任何放化疗治疗且临床资料完整。其中,男性124例,女性114例;≤58岁89例,>58岁149例,年龄22~76岁,中位年龄58岁;右半结肠癌39例,左半结肠癌52例,直肠癌147例;非黏液腺癌201例,黏液腺癌37例;高分化52例,中分化154例,低分化32例;有淋巴结转移175例,无淋巴结转移63例;Duke′s分期A期47例,B期82例,C期71例,D期38例;浸润黏膜层及黏膜下层17例,浸润肌层74例,浸润浆膜层147例。
1.2 实验方法 1.2.1 FISH检测方法与判断标准方法:切取石蜡切片3 μm厚3张,置65℃烤箱中过夜,常规脱蜡至水化;50℃下30%酸性亚硫酸钠处理切片30 min;200 μg/mL蛋白酶K 37℃消化30 min;-20℃预冷的70%、85%和100%乙醇梯度脱水2 min,再丙酮浸泡脱脂2 min;探针混合液73℃预热5 min,滴加10 μL于玻片上42℃杂交过夜,甲酰胺洗涤,自然干燥;滴加15 μL DAPI对比染色,静置20 min,荧光镜下计数。
判断标准:肿瘤细胞核呈蓝色荧光信号,C-erbB-2基因位于核内,呈红色荧光信号;17号染色体着丝粒位于核内,呈绿色荧光信号。随机计数30个肿瘤细胞,计算红绿比值。比值≥2.2判断为(+),C-erbB-2基因扩增;比值≤1.8判断为(-),C-erbB-2基因未扩增,比值介于1.8~2.2,增加计数细胞数目或重作实验确定最终结果。
1.2.2 RT-PCR检测方法与判断标准方法:切取石蜡切片10 μm厚5张,常规脱蜡水化,1张用于HE染色镜下观察形态,其余用于DNA提取,显微镜下观察HE切片选取肿瘤成分>70%区域刮入裂解液,充分混匀1 300 r/min离心10 min,吸取上清。紫外分光光度计测量DNA质量和浓度。从试剂盒中取出阳性质控品和Tag酶室温融化,混均后2 000 r/min离心15 s;分别向45 μL待测样品DNA(浓度约2 ng/μL)、阳性对照、阴性对照中加入2.25 μL Tag酶,混均后2 000 r/min离心15 s,放在PCR管架上,轻轻揭开反应条管盖,将混好的DNA样品依次取5 μL加入PCR反应条中,盖紧管盖,移至PCR仪检测。反应循环参数为:预变性95℃ 5 min,1个循环;95℃ 25 s、64℃ 20 s、72℃ 20 s,15个循环;93℃ 25 s、60℃ 35 s、72℃ 20 s,31个循环。反应体系为25 μL。在第3个阶段60℃时收集信号。
判断标准:以无模板对照扩增曲线的最高点为准设定阈值。没出现扩增曲线或Ct值为0的标本为(-);出现扩增曲线且Ct ≤26.0的标本为(+);26.0<Ct<28.0的标本为可疑阳性,重复检测。
1.3 试剂与仪器石蜡组织DNA提取试剂盒、C-erbB-2基因扩增检测试剂盒和KRAS基因突变检测试剂盒由福建厦门艾德生物医药科技有限公司生产。Mx3000P实时荧光定量PCR仪为美国Stratagene公司产品。
1.4 统计学分析采用SPSS 16.0统计学软件进行数据处理。计数资料采用频数(百分比)表示,组间比较采用χ2检验。相关性分析采用Spearman等级相关分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 CRC中C-erbB-2扩增及与病理特征的关系238例CRC中4例发生C-erbB-2扩增,总扩增率为1.7%。C-erbB-2扩增在年龄、性别、肿瘤位置、组织学分类、分化程度、淋巴结转移、Duke′s分期及浸润深度等病理特征方面比较,差异均无统计学意义(均P>0.05,表 1,图 1~2)。
| 临床病理特征 | 例数 | C-erbB-2扩增 | KRAS突变 | |||||
| 例数(%) | χ2值 | P值 | 例数(%) | χ2值 | P值 | |||
| 年龄 | 1.441 | 0.077 | 0.142 | 0.722 | ||||
| ≤58岁 | 89 | 2(2.2) | 33(37.1) | |||||
| >58岁 | 149 | 2(1.3) | 53(35.6) | |||||
| 性别 | - | 0.099* | 1.179 | 0.236 | ||||
| 男 | 124 | 1(0.8) | 47(37.9) | |||||
| 女 | 114 | 3(2.6) | 39(34.2) | |||||
| 肿瘤位置 | 2.379 | 0.671 | 1.457 | 0.503 | ||||
| 右半结肠 | 39 | 1(2.6) | 12(30.8) | |||||
| 左半结肠 | 52 | 0(0.0) | 17(32.7) | |||||
| 直肠 | 147 | 3(2.0) | 57(38.8) | |||||
| 组织学分型 | - | 0.099* | 1.339 | 0.197 | ||||
| 非黏液腺癌 | 201 | 4(2.0) | 69(34.3) | |||||
| 黏液腺癌 | 37 | 0(0.0) | 17(45.9) | |||||
| 分化程度 | - | 0.099* | 2.976 | 0.089 | ||||
| 高分化 | 52 | 0(0.0) | 14(26.9) | |||||
| 中分化 | 154 | 4(2.6) | 60(39.0) | |||||
| 低分化 | 32 | 0(0.0) | 12(37.5) | |||||
| 淋巴结转移 | - | 0.099* | 4.011 | 0.043 | ||||
| 有 | 175 | 4(2.3) | 83(47.4) | |||||
| 无 | 63 | 0(0.0) | 23(36.5) | |||||
| Duke′s分期 | 2.133 | 0.443 | 4.372 | 0.019 | ||||
| A期 | 47 | 1(2.1) | 11(23.4) | |||||
| B期 | 82 | 2(2.4) | 26(31.7) | |||||
| C期 | 71 | 0(0.0) | 30(42.3) | |||||
| D期 | 38 | 1(2.6) | 19(50.0) | |||||
| 浸润深度 | 1.912 | 0.098 | 3.271 | 0.064 | ||||
| 黏膜+黏膜下层 | 17 | 1(5.9) | 2(11.8) | |||||
| 肌层 | 74 | 0(0.0) | 23(31.1) | |||||
| 浆膜层 | 147 | 3(2.0) | 61(41.5) | |||||
| *Fisher精确检验 | ||||||||
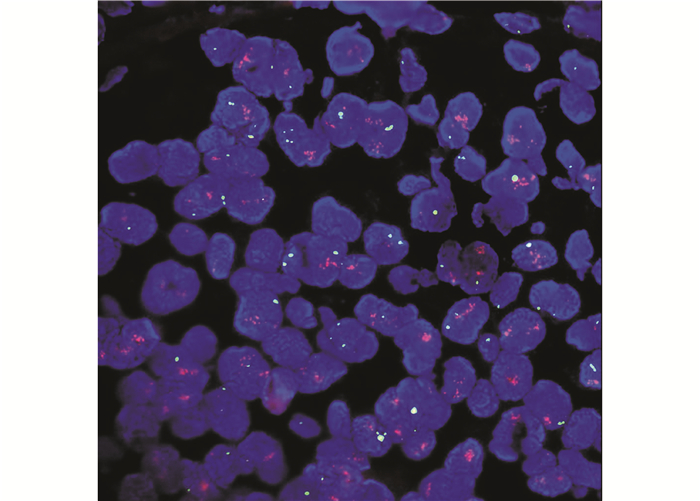
|
| 图 1 结直肠癌组织中C-erbB-2基因FISH检测发生扩增 Fig.1 Amplification of C-erbB-2 in FISH of colorectal cancer |
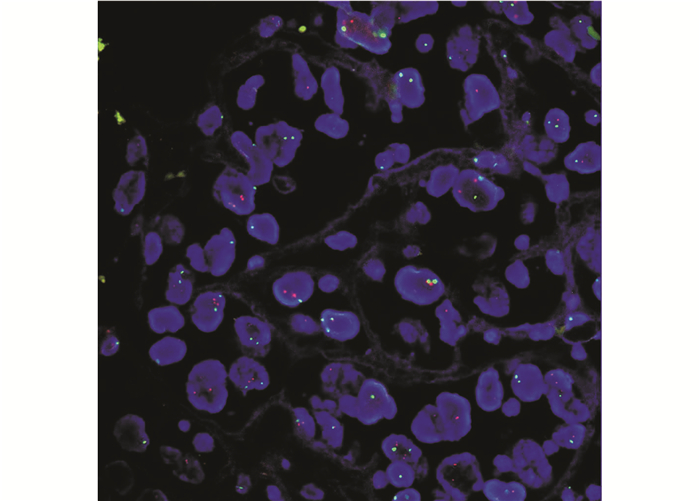
|
| 图 2 结直肠癌组织中C-erbB-2基因FISH检测未发生扩增 Fig.2 Non-amplification of C-erbB-2 in FISH of colorectal cancer |
238例CRC中88例发生KRAS突变,总突变率为36.9%。淋巴结转移和无淋巴结转移患者KRAS突变率分别为47.4%(83/175)和36.5%(23/63),差异具有统计学意义(P=0.043)。Duke′s分期A、B、C和D期患者KRAS突变率分别为23.4%(11/47)、31.7%(26/82)、42.3%(30/71)和50.0%(19/38),差异具有统计学意义(P=0.019,表 1,图 3)。
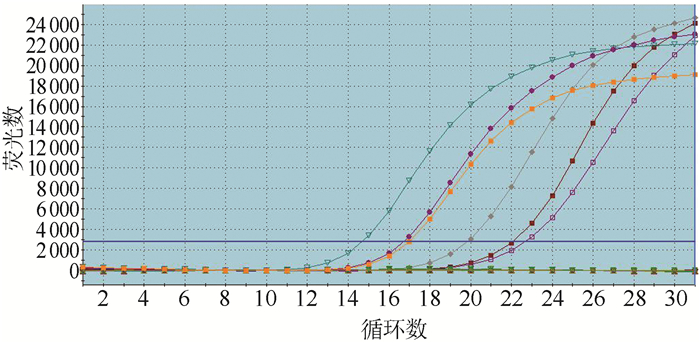
|
| 图 3 结直肠癌组织中KRAS基因突变的扩增曲线 Fig.3 Amplification curve of KRAS gene mutation in colorectal cancer tissue |
相关分析显示,C-erbB-2扩增与KRAS突变没有相关性(r=0.086,P=0.184),但238例结直肠癌中有4例发生C-erbB-2扩增, 在4例C-erbB-2扩增中有1例KRAS突变,3例未发生突变,在234例C-erbB-2扩增中有85例KRAS突变,149例未发生突变。
3 讨论C-erbB-2是一种细胞来源的原癌基因,激活后可通过不同信号转导途径参与调控细胞的生长、增殖、分裂及凋亡[2]。C-erbB-2基因的扩增程度在结直肠癌组织中比正常大肠黏膜组织高,并且C-erbB-2基因的扩增程度在CRC中随着癌组织学分级程度的加重也逐渐的向高拷贝转移,组织学分级越低的CRC组织C-erbB-2基因扩增越强,由此说明C-erbB-2基因扩增可以在一定程度上反映CRC的恶性转化以及其生物学的行为,也就是说CRC的恶性转化以及其生物学的行为有赖于C-erbB-2基因的活化[2-3],也有学者研究证实,CRC组织中C-erbB-2基因扩增在有淋巴结转移者中强于无淋巴结转移者,也就是说CRC淋巴结转移与C-erbB-2基因扩增有密切关系,CRC中C-erbB-2基因扩增使CRC的侵袭和转移能力增强,提示CRC患者预后不良,这也揭示C-erbB-2基因扩增有可能成为CRC患者预后参考指标,具有重要的理论意义和实际意义[3-4]。本研究结果显示,C-erbB-2基因扩增在CRC患者的性别、年龄、肿瘤的部位、分期、分化程度、组织学类型、是否有淋巴结转移以及Duke′s分期方面比较,差异均无统计学意义(均P>0.05),提示C-erbB-2基因扩增并不能直接对CRC的分化、侵袭、转移和预后等指标进行预测,必须结合KRAS基因突变等多个因素进行分析,因此C-erbB-2基因扩增是应用分子靶向治疗的依据之一,但不能作为分子靶向治疗的独立指标,也不能作为判断CRC预后的单一指标。
KRAS是RAS家族成员之一,是C-erbB-2信号通路的重要调控因子。研究报道,KRAS是肿瘤中最常见的突变基因之一,但在CRC中KRAS基因突变与肿瘤生物学行为的关系尚未有定论。有研究报道,CRC中KRAS突变率分别为37.8%和36.6%,与所有临床病理指标均无明显相关[5-6]。也有研究报道,CRC中KRAS突变率为39.6%,与年龄、性别、肿瘤部位和分化程度相关[7];CRC中KRAS突变率为38.8%,与性别及淋巴结转移有关[8]。Mannan等[9]和Goel等[10]报道CRC中KRAS突变率>50%,与淋巴结转移和肿瘤分期相关。本研究显示,CRC中KRAS总突变率为36.9%,与淋巴结转移和Duke′s分期相关,在有淋巴结转移和无淋巴结转移组患者中KRAS突变率分别为47.4%和32.3%,表明KRAS在肿瘤细胞向癌旁及系膜组织的局部浸润及转移中发挥重要作用;在Duke′s分期为A、B、C和D期的患者中KRAS突变率为23.4%、31.7%、42.3%和50.0%,随着突变率的增高,浸润程度随之加深,表明KRAS在肿瘤细胞向肠壁浸润的过程中发挥重要作用,KRAS突变率的高低可作为临床评估肿瘤侵袭、转移及患者预后的有效参考指标。
C-erbB-2和KRAS同为RAS/RAF/MAPK信号通路中的上下游调控因子,C-erbB-2通过与家族中其他受体酪氨酸激酶形成异源二聚体发生磷酸化,募集下游信号蛋白肉瘤同源区段2(sarcomatous homologous segment 2, SH2和生长因子受体结合蛋白2(growth factor receptor-bound protein 2, Grb2),活化调控分子鸟嘌呤核苷交换因子(son of sevenless, SOS),依次活化RAS和RAF,最后级联激活MAPK,将细胞外信号转入核内启动转录因子,导致细胞过度增殖、异常分化和恶性癌变[11-12],从理论上讲C-erbB-2和KRAS具有协同作用。目前,关于CRC中C-erbB-2和KRAS表达相关性的研究鲜见报道, 本研究对CRC中C-erbB-2扩增和KRAS突变的相关性进行分析,发现二者表达并无相关关系;然而在本研究中检出的4例C-erbB-2扩增中有发生1例KRAS突变,随着样本量的增大,二者过表达量也会随之增加,由此推测C-erbB-2扩增和KRAS突变不仅可同时发生在肿瘤组织中,且可能存在正相关关系。本研究分析认为C-erbB-2自身作用可能对CRC的发生和发展影响不大,其促癌作用可能是通过激活下游信号分子KRAS导致转导通路持续活化,也说明C-erbB-2和KRAS两者通过同一条信号转导通路在肿瘤的发生和发展中起协同作用。对C-erbB-2和KRAS的具体调控机制还需临床大数据综合资料的进一步研究论证。
| [1] |
陈佳琦, 董彩霞, 袁瑛. 2018年结直肠癌治疗研究进展[J]. 实用肿瘤杂志, 2019, 34(1): 1-6. |
| [2] |
Shadfan A, Hellebust A, Richards-Kortum R, et al. Confocal foveated endomicroscope for the detection of esophageal carcinoma[J]. Biomed Opt Express, 2015, 6(7): 2311-2324. |
| [3] |
Orr MS, O'Connor PM, Kohn KW. Effects of c-erbB2 overexpression on the drug sensitivities of normal human mammary epithelial cells[J]. J Natl Cancer Inst, 2000, 92(12): 987-994. |
| [4] |
Wu QB, Sun GP. Expression of COX-2 and HER2 in colorectal cancer and their correlation[J]. World J Gastroenterol, 2015, 21(20): 6202-6214. |
| [5] |
沙如拉, 李文新. 结直肠癌KRAS和NRAS及BRAF基因突变状态分析[J]. 内蒙古医学杂志, 2017, 49(1): 4-8. |
| [6] |
常江, 王颖. 结直肠癌KRAS、BRAF及PIK3CA基因突与临床病理的关系[J]. 山西医药杂志, 2015, 44(5): 562-565. |
| [7] |
Chang YY, Lin PC, Lin HH, et al. Mutation spectra of RAS gene fanily in colorectal cancer[J]. Am J Surg, 2016, 212(3): 537-544. |
| [8] |
王璇, 王建东, 罗春英, 等. 结直肠癌中KRAS基因突变的检测及其临床病理意义[J]. 医学研究生学报, 2013, 26(1): 19-22. |
| [9] |
Mannan A, Hahn S, Tromberg V. KRAS mutations are correlated to lymph node metastasis and tumor stage, but not to the growth patten of colon carcinoma[J]. APMIS, 2012, 120(6): 459-468. |
| [10] |
Goel S, Huang J, Klampfer L. K-Ras, intestinal homeostasis and colon cancer[J]. Curr Clin Pharmacol, 2015, 10(1): 73-81. |
| [11] |
鲍晨, 王一理, 柳俊, 等. EGFR和KRAS在上皮性卵巢癌组织中的表达及临床意义[J]. 现代生物医学进展, 2017, 17(5): 892-894. |
| [12] |
李陈婕, 羊志辉, 陈森林, 等. HER2与KRAS在结直肠癌中的表达及意义[J]. 解放军医学杂志, 2007, 32(6): 598-600. |
 2020, Vol. 35
2020, Vol. 35


