文章信息
- 于娇, 金龙, 唐春卉, 闵智乾
- Yu Jiao, Jin Long, Tang Chunhui, Min Zhiqian
- 治疗前NLR和肌肉减少症对局部晚期子宫颈鳞癌患者预后的影响
- Effect of pre-treatment NLR and sarcopenia on prognosis of patients with locally advanced cervical squamous cell carcinoma
- 实用肿瘤杂志, 2020, 35(1): 37-41
- Journal of Practical Oncology, 2020, 35(1): 37-41
基金项目
- 陕西省重点研发计划项目(2017SF-146);陕西省自然科学基金项目(2017JM145);西安市科技计划项目[2017117SF/YX011(5)]
-
作者简介
- 于娇(1983-), 女, 辽宁辽阳人, 副主任医师, 硕士, 从事胸部及盆腔恶性肿瘤放疗相关研究.
-
通信作者
- 金龙, E-mail:admorking@sohu.com
-
文章历史
- 收稿日期:2018-11-06
2. 陕西省人民医院肿瘤内科, 陕西 西安 710068;
3. 陕西省人民医院肿瘤内科, 陕西 西安 710068
2. Department of Medical Oncology, Shaanxi Provincial People's Hospital, Xi'an 710068, China;
3. MRI Room, Shaanxi Provincial People's Hospital, Xi'an 710068, China
子宫颈癌是最常见的妇科肿瘤之一。2012年全世界约53万例子宫颈癌新发病例,占所有女性肿瘤的12%,死亡病例约27.5万例[1-2]。我国为子宫颈癌高发地区,2011年的发病率和死亡率分别为13.40/10万和3.86/10万[3]。同步放化疗虽然可提高局部晚期子宫颈癌的预后,但是仍有部分患者由于肿瘤未控或远处转移5年总生存率较低,仅为10%和11%[4]。国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期系统是目前指导子宫颈鳞癌治疗方式的重要依据,但在评估预后方面存在较大不足[1, 5]。肌肉减少症及系统炎性反应是多种肿瘤预后不良的指标[6],其在子宫颈癌方面的研究较少。肌肉减少症定义为正常或偏低体质量患者骨骼肌指数(skeletal muscle index, SMI;SMI=第3腰椎处肌肉面积÷身高2) < 38 cm2/m2,肥胖患者SMI < 47 cm2/m2。以中性粒细胞与淋巴细胞比例(neutrophil to lymphocyte ratio,NLR)=3为临界值,NLR < 3提示轻度或无系统炎性反应,NLR≥3提示存在系统炎性反应。本研究回顾性分析107例子宫颈鳞癌患者的临床资料,评价治疗前肌肉减少症与临床特征之间的关系,并评估肌肉减少症合并系统炎性反应与局部晚期子宫颈鳞癌预后的关系。
1 资料与方法 1.1 一般资料收集2010年1月1日至2014年6月30日于陕西省人民医院初治的子宫颈鳞癌患者107例。患者年龄33~71岁,中位年龄52岁。FIGO分期为ⅠB2~ⅢB期。所有病例均经病理检查证实为子宫颈鳞状细胞癌,临床资料完整。所有患者均知情同意。排除标准:(1)合并有免疫性疾病以及其他恶性肿瘤的患者;(2)治疗前合并有急性或慢性感染;(3)合并有血液系统疾病、血栓或出血性疾病;(4)合并有严重的肝和肾疾病;(5)治疗前曾接受过放疗或化疗;(6)远处转移。
1.2 治疗入选患者均给予根治性同步放化疗。外照射采用美国瓦里安21-EX直线加速器6 MV-X线调强放射治疗(intensity modulated radiotherapy,IMRT)9野照射,剂量50.4 Gy/28 f,5.5周,腔内近距离照射A点剂量为5~6 Gy/f,共4~5次。同步化疗方案,顺铂40 mg/m2每周1次,或者TP方案(多西他赛75 mg/m2+顺铂75 mg/m2)化疗,每3周重复。
1.3 随访随访截止时间2017年6月30日,中位随访时间为49个月(36~86个月),随访方式为患者门诊随访及电话随访,失访0例。患者从第1次入院确诊时间至死亡时间或者随访截止时间定义为总生存期(overall survival, OS)。
1.4 统计学分析采用SPSS 21.0软件对数据进行统计学分析。利用χ2检验比较分类变量。采用Kaplan-Meier法比较不同特征患者的总生存率。Cox多因素分析晚期子宫颈鳞癌预后独立危险因素。以P<0.05为差异具有统计学意义。
2 结果 2.1 子宫颈鳞癌患者临床病理特征资料对子宫颈鳞癌患者肌肉减少症发生情况和临床病理特征的关系进行分析显示,肌肉减少症发生率在≥60岁和 < 60岁的患者以及NLR < 3和NLR≥3的患者之间比较,差异均具有统计学意义(均P < 0.05,表 1)。
| 临床病理特征 | 总例数 | 肌肉减少症 发生率 |
P值 |
| 年龄 | 0.021 | ||
| < 60岁 | 64(59.8) | 16(44.4) | |
| ≥60岁 | 43(40.2) | 20(55.6) | |
| FIGO分期 | 0.836 | ||
| ⅠB2期 | 4(3.7) | 1(2.8) | |
| ⅡA1期 | 12(11.2) | 4(11.1) | |
| ⅡA2期 | 6(5.7) | 2(5.5) | |
| ⅡB期 | 63(58.9) | 19(52.8) | |
| ⅢA期 | 12(11.2) | 6(16.7) | |
| ⅢB期 | 10(9.3) | 4(11.1) | |
| 病理分级 | 0.612 | ||
| 高分化 | 12(11.2) | 3(8.3) | |
| 中分化 | 76(71.0) | 25(69.5) | |
| 低分化 | 19(17.8) | 8(22.2) | |
| 淋巴结转移 | 0.730 | ||
| 阴性 | 39(36.4) | 13(36.1) | |
| 阳性 | 68(63.6) | 23(63.9) | |
| 肿瘤最大直径 | 0.635 | ||
| < 4 cm | 51(47.7) | 16(44.4) | |
| ≥4 cm | 56(52.3) | 20(55.6) | |
| 体质量指数 | 0.687 | ||
| < 18.5 kg/m2 | 90(84.1) | 31(86.1) | |
| (正常或低体质量) | |||
| ≥18.5 kg/m2(肥胖) | 17(15.9) | 5(13.9) | |
| NLR | 0.001 | ||
| < 3 | 52(48.6) | 9(25.0) | |
| ≥3 | 55(51.4) | 27(75.0) | |
| 注 kFIGO:国际妇产科联盟(International Federation of Gynecology and Obstetrics);NLR:中性粒细胞与淋巴细胞比例(neutrophil to lymphocyte ratio) | |||
107例患者中20例死亡。患者的1、3和5年总生存率分别为98.3%、87.8%和81.3%。根据肌肉减少症及是否存在系统炎性反应分为A、B、C和D共4组。A组:无肌肉减少症,NLR < 3;B组:无肌肉减少症,NLR≥3;C组:有肌肉减少症,NLR < 3;D组:有肌肉减少症,NLR≥3。各组间年龄、FIGO分期、病理分级、淋巴结转移情况和肿瘤最大直径等临床特征方面比较,差异均无统计学差异(均P>0.05, 表 2)。A组死亡1例,5年生存率97.7%;B组死亡5例,5年生存率81.5%;C组死亡2例,5年生存率80.0%;D组患者死亡15例,5年生存率55.6%;各组比较差异具有统计学意义(P=0.040,图 1)。
| 临床病理特征 | A组 (n=43) |
B组 (n=27) |
C组 (n=10) |
D组 (n=27) |
P值 |
| 年龄 | 0.365 | ||||
| < 60岁 | 24 | 20 | 5 | 15 | |
| ≥60岁 | 19 | 7 | 5 | 12 | |
| FIGO分期 | 0.054 | ||||
| ⅠB2期 | 1 | 2 | 1 | 0 | |
| ⅡA1期 | 2 | 1 | 1 | 8 | |
| ⅡA2期 | 1 | 3 | 1 | 1 | |
| ⅡB期 | 26 | 17 | 4 | 16 | |
| ⅢA期 | 8 | 1 | 2 | 1 | |
| ⅢB期 | 5 | 3 | 1 | 1 | |
| 病理分级 | |||||
| 高分化 | 5 | 3 | 3 | 1 | 0.080 |
| 中分化 | 32 | 21 | 3 | 20 | |
| 低分化 | 6 | 3 | 4 | 6 | |
| 淋巴结转移 | |||||
| 阴性 | 13 | 13 | 5 | 8 | 0.302 |
| 阳性 | 30 | 14 | 5 | 19 | |
| 肿瘤最大直径 | |||||
| < 4 cm | 21 | 13 | 4 | 13 | 1.967 |
| ≥4 cm | 22 | 14 | 6 | 14 | |
| 注 FIGO:国际妇产科联盟(International Federation of Gynecology and Obstetrics) | |||||
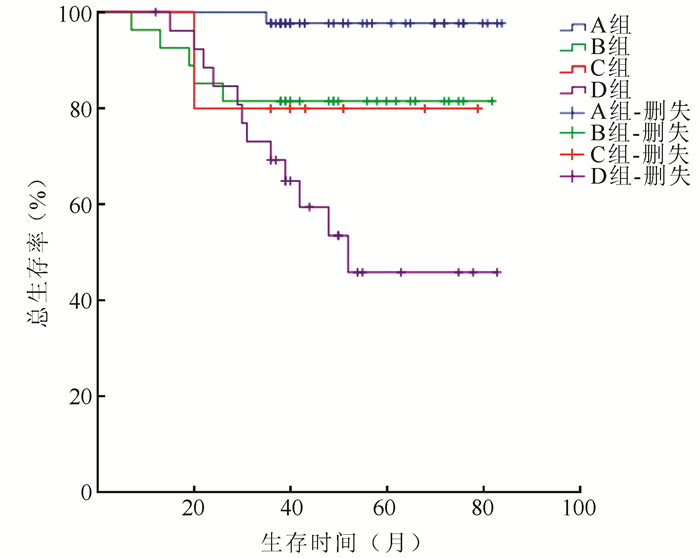
|
| 图 1 Kaplan-Meier曲线评估肌肉减少症与NLR状态对患者总生存的影响 Fig.1 Kaplan-Meier curve of overall survival affected by sarcopenia and neutrophil-to-lymphocyte ratio (NLR) |
Cox多因素分析显示,肌肉减少症(HR=3.335,95%CI:1.184~9.394,P=0.023)和NLR≥3(RR=3.736,95%CI:1.020~13.687,P=0.047)是子宫颈鳞癌患者OS的独立危险因素(表 3)。
| 变量 | 总生存 | |
| HR(95%CI) | P值 | |
| 年龄(<60岁vs ≥60岁) | 3.476(1.096~8.132) | 0.068 |
| FIGO分期(Ⅰ~Ⅱ期vs Ⅲ期) | 1.486(0.948~5.416) | 0.058 |
| 肌肉减少症(是vs否) | 3.335(1.184~9.394) | 0.023 |
| NLR(≥3 vs < 3) | 3.736(1.020~13.687) | 0.047 |
| 淋巴结转移(阴性vs阳性) | 1.051(0.407~2.712) | 0.919 |
| 肿瘤最大直径(≥4 cm vs < 4 cm) | 1.198(0.456~3.148) | 0.714 |
| 病理学分级(高分化vs中分化 vs低分化) |
0.783(0.094~6.539) | 0.821 |
| 注 FIGO:国际妇产科联盟(International Federation of Gynecology and Obstetrics) | ||
流行病学证据表明,炎性反应能够刺激血管生成和细胞增殖,炎性反应与肿瘤的发生和发展密切相关并且影响肿瘤患者的预后[7-8]。另外,在多种肿瘤中,肌肉减少症常提示预后不良,是晚期癌症死亡的独立预测因子[9]。系统炎性反应在与癌症恶病质相关的骨骼肌衰竭中也起重要作用,其特征是骨骼肌持续丢失合并或不合并脂肪组织丢失[10]。同步放化疗使子宫颈鳞癌局部控制、无进展生存率和总生存率得到改善。子宫颈鳞癌患者预后与众多因素有关,包括患者FIGO分期、淋巴结转移、人乳头状瘤病毒(human papilloma virus,HPV)感染和卡氏行为状态(Karnofsky performance status,KPS)评分。此外,患者自身的营养与免疫状态与肿瘤的预后关系逐渐被研究者所重视,多项研究证实,较差的营养状态和持续系统炎性反应可能导致更差的预后[11-13]。肌肉质量是营养状态的客观指标,对于健康人群,40岁时肌肉质量开始下降,70岁以前,每10年损失率为8%[14]。>70岁下降加速至25%~40%[15]。肌肉的大量流失是在衰老过程中发生的,在癌症患者中也是如此。年龄较大的恶性肿瘤患者,肌肉减少症直接与预后相关[16-17]。本研究中,≥60岁患者的肌肉减少症发生率高于 < 60岁的患者(P=0.021)。然而,肌肉减少症的发生同体质量并无直接相关性。肥胖患者肌肉减少症发生率并不会比体质量小或者正常的患者更低。这是由于肥胖患者自身的激素变化、久坐的生活方式和营养均衡情况导致肌肉减少症性肥胖。此外,脂肪组织分泌促炎性细胞因子和脂肪因子促进胰岛素抵抗,也会引起肌肉质量下降[18-19]。本研究也显示,低和正常体质量患者肌肉减少症发生率与肥胖患者比较,差异无统计学意义(P>0.05)。
NLR是反映机体免疫状态的重要炎性指标。对于肿瘤患者,肌肉减少症的出现可能预示着更差的手术治疗效果、更高的毒性反应以及更短的生存期[9]。诊断前NLR较高,诊断时更易出现肌肉减少症。系统炎性反应使蛋白质的周转率和细胞生长失衡,从而损害骨骼肌的质量[16]。系统炎性反应会使机体产生多种炎性细胞因子,如白细胞介素-1(interleukin-1,IL-1)、IL-6和肿瘤坏死因子-α。肿瘤坏死因子等是骨骼肌蛋白水解的调节剂,肿瘤和宿主之间的营养竞争导致加速分解代谢状态,促进宿主中的严重代谢紊乱,导致肌肉质量的降低[20]。本研究结果表明,治疗前高NLR水平子宫颈鳞癌患者肌肉减少症发生率较高,高NLR合并肌肉减少症患者总生存较差,肌肉减少症和高NLR是影响子宫颈癌预后的独立危险因素。这种标志物获取具有简便、经济的优点,可以作为子宫颈鳞癌患者病情评估的一个有益补充。同时,锻炼和饮食干预已被证实对老年人的合成代谢抵抗是有益的[21],改善肌肉质量和功能,降低系统炎性反应指标,可能改善患者的预后。但由于本研究是一个相对小样本的回顾性研究,入组患者FIGO分期较晚,未纳入早期病例,存在一定的局限性,因此需要进行多中心、大样本的前瞻性研究来进一步证实。
| [1] |
庹菲, 蔡红兵, 王志强. 影响ⅠB-ⅡB期子宫颈癌预后的相关因素分析[J]. 实用肿瘤杂志, 2019, 34(1): 31-34. |
| [2] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. |
| [3] |
Chen W, Zheng R, Zeng H, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015, 27(1): 2-12. |
| [4] |
Hong JH, Tsai CS, Lai CH, et al. Recurrent squamous cell carcinoma of cervix after definitive radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 60(1): 249-257. |
| [5] |
唐宏, 孔为民. pTNM分期在早期宫颈癌治疗中的地位探讨[J]. 内蒙古中医药, 2014, 33(30): 84-85. |
| [6] |
Feliciano EMC, Kroenke CH, Meyerhardt JA, et al. Association of systemic inflammation and sarcopenia with survival in nonmetastatic colorectal cancer:results from the C scans study[J]. JAMA Oncol, 2017, 3(12): 2319. |
| [7] |
Lu H, Ouyang W, Huang C. Inflammation, a key event in cancer development[J]. Mol Cancer Res, 2006, 4(4): 221-233. |
| [8] |
张剑华, 费洪江, 潘群雄, 等. 比较各炎性反应预后评分系统对结直肠癌根治术后患者的预后价值[J]. 实用肿瘤杂志, 2019, 34(3): 231-238. |
| [9] |
Rier HN, Jager A, Sleijfer S, et al. The prevalence and prognostic value of low muscle mass in cancer patients:a review of the literature[J]. Oncologist, 2016, 21(11): 1396-1409. |
| [10] |
Kim EY, Kim YS, Seo JY, et al. The Relationship between sarcopenia and systemic inflammatory response for cancer cachexia in small cell lung cancer[J]. PLoS One, 2016, 11(8): 1125. |
| [11] |
Kiss NK, Krishnasamy M, Isenring EA. The effect of nutrition intervention in lung cancer patients undergoing chemotherapy and/or radiotherapy:a systematic review[J]. Nutr Cancer, 2014, 66(1): 47-56. |
| [12] |
He J, Pan H, Liang W, et al. Prognostic effect of albumin-to-globulin ratio in patients with solid tumors:a systematic review and meta-analysis[J]. J Cancer, 2017, 8(19): 4002-4010. |
| [13] |
Kitamura I, Koda M, Otsuka R, et al. Six-year longitudinal changes in body composition of middle-aged and elderly japanese:age and sex differences in appendicular skeletal muscle mass[J]. Geriatr Gerontol Int, 2014, 14(2): 354-361. |
| [14] |
Martin L, Birdsell L, Macdonald N, et al. Cancer cachexia in the age of obesity:skeletal muscle depletion is a powerful prognostic factor, independent of body mass index[J]. J Clin Oncol, 2013, 31(12): 1539-1547. |
| [15] |
Goodpaster BH, Park SW, Harris TB, et al. The loss of skeletal muscle strength, mass, and quality in older adults:the health, aging and body composition study[J]. J Gerontol A Biol Sci Med Sc, 2006, 61(10): 1059-1064. |
| [16] |
Pérez-Baos S, Prieto-Potin I, Roman-Blas JA, et al. Mediators and patterns of muscle loss in chronic systemic inflammation[J]. Front Physiol, 2018, 9: 409. |
| [17] |
Landi F, Cruz-Jentoft AJ, Liperoti R, et al. Sarcopenia and mortality risk in frail older persons aged 80 years and older:results from ilSIRENTE study[J]. Age Ageing, 2013, 42(2): 203-209. |
| [18] |
Yip C, Dinkel C, Mahajan A, et al. Imaging body composition in cancer patients:visceral obesity, sarcopenia and sarcopenic obesity may impact on clinical outcome[J]. Insights imaging, 2015, 6(4): 489-497. |
| [19] |
Kalinkovich A, Livshits G. Sarcopenic obesity or obese sarcopenia:a cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis[J]. Ageing Res Rev, 2017, 35: 200-221. |
| [20] |
Argilés JM, Busquets S, López-Soriano FJ. The pivotal role of cytokines in muscle wasting during cancer[J]. Int J Biochem Cell Biol, 2005, 37(10): 2036-2046. |
| [21] |
Dalle S, Rossmeislova L, Koppo K. The role of inflammation in age-related sarcopenia[J]. Front Physiol, 2017, 8: 1045. |
 2020, Vol. 35
2020, Vol. 35


