文章信息
- 程晓龙, 吕晓娟, 刘吉平, 王彬冰, 唐秋, 潘林飞, 张莉
- Cheng Xiaolong, Lv Xiaojuan, Liu Jiping, Wang Binbing, Tang Qiu, Pan Linfei, Zhang Li
- 子宫颈癌保留双侧卵巢功能的放疗方法研究
- Study on radiotherapy method of preserving bilateral ovarian function for cervical cancer
- 实用肿瘤杂志, 2019, 34(6): 540-549
- Journal of Practical Oncology, 2019, 34(6): 540-549
基金项目
- 浙江省医药卫生科技项目(2015PYB068)
-
作者简介
- 程晓龙(1987-), 男, 浙江杭州人, 工程师, 硕士, 从事螺旋断层放疗的质量控制及放疗计划设计研究.
-
通信作者
- 刘吉平, E-mail:m15211361861@163.com
-
文章历史
- 收稿日期:2018-11-13
2. 浙江省肿瘤医院妇瘤放疗科, 浙江 杭州 310022
2. Department of Gynecological Radiation Oncology, Zhejiang Cancer Hospital, Hangzhou 310022, China
年轻妇女子宫颈癌的发病率有逐年增加的趋势,约30%~40%发生在育龄期妇女,患者治疗后将有较长的生存期[1]。放疗为子宫颈癌的主要治疗手段之一,卵巢功能与女性生活质量密切相关,卵巢功能的保留是实施子宫颈癌放疗的关键之一。子宫颈癌放疗后卵巢功能与多种因素相关,如放疗剂量和方式、患者年龄、移位位置和同期化疗药物等[2]。卵巢是射线敏感器官,低剂量照射即可导致其功能不可逆损伤[3]。调强放疗(intensity modulated radiation therapy, IMRT)、容积旋转调强放疗(volume modulated arc therapy, VMAT)和螺旋断层放疗(helical tomotherapy, HT)是目前应用临床的主流放疗技术,其中VMAT和HT较为先进,在复杂靶区及正常组织剂量限值的计划设计上各有优势[4-5]。本文从降低卵巢剂量的角度,通过比较10例双侧卵巢移位的子宫颈癌IMRT、VMAT和HT三组放疗计划的剂量学差异,分别阐述各种计划的设计方法,为保留卵巢功能的子宫颈癌放疗的技术选择和计划设计提供技术支持。
1 资料与方法 1.1 一般资料收集2016年1月至2018年8月在浙江省肿瘤医院实施双侧卵巢保留放疗的10例年轻子宫颈癌患者临床资料。所有患者放疗前均行子宫颈癌根治术及双侧卵巢移位术,年龄26~38岁,中位年龄34岁。鳞癌8例,腺癌2例。按照国际妇产科协会(International Federation of Gynecology and Obstetrics, FIGO)2009年手术病理分期标准[6],ⅠA期2例,ⅠB期1例,ⅡA期4例,ⅡB期3例。所有患者放疗前经激素检查卵巢内分泌功能均正常。
1.2 模拟定位患者均采用仰卧位,于CT扫描前制作腹盆腔体位固定模,并在扫描前1 h排空膀胱后饮用500 mL矿泉水,憋尿保证膀胱充盈。使用Philips BrillianceTM16排大孔径CT模拟机进行模拟定位,扫描层厚5 mm,范围从第2腰椎上缘到坐骨结节下缘下5 cm。CT图像经局域网以医学数字成像和通信(digital imaging and communications in medicine, DICOM)格式传输至三维治疗计划系统工作站上[7]。
1.3 靶区和危及器官勾画根据美国放射治疗肿瘤学组(Radiation Therapy Oncology Group, RTOG)子宫颈癌术后盆腔临床靶体积(clinical target volume, CTV)勾画指南勾画[8]。CTV包括阴道上段1/2及残端、阴道旁组织和盆腔淋巴引流区(髂总、髂内、髂外闭孔及骶前淋巴结区),淋巴结上界在腰椎4、5水平,下界为骨性闭合下缘。有子宫颈肌层受侵者,还包括骶前淋巴引流区。计划靶区体积(planning target volume,PTV)由CTV边界在三维上均匀外扩1 cm生成。勾画危及器官(organ at risk,OAR)包括直肠、膀胱、肠袋、骨髓、脊髓、卵巢及双侧股骨头,其中肠袋需从PTV上2 cm开始勾画并包括全部的小肠、结肠和乙状结肠,直肠上界为直乙交界处,下界为肛门,膀胱包括充盈状态下全部膀胱,骨髓包括第4、5腰椎椎体、骶骨及髂骨全部,卵巢包括银夹标记之间的软组织影,股骨头左、右侧分别勾画[9-10]。
1.4 保留双侧卵巢放疗计划设计对每例患者均制定IMRT、VMAT和HT 3种放疗计划,且处方剂量均设定为45 Gy,单次剂量1.8 Gy。IMRT和VMAT计划在RayStation 4.0v系统设计,HT计划在Tomo HelicalTM Version 2.0.5系统完成。IMRT计划采用10 MV的X线,等中心7野共面的step-and-shot IMRT技术,机架角度根据卵巢位置进行调整,设置原则是在射束方向观(beam′s eye view,BEV)方向卵巢不在射野范围内,共计70个子野(图 1)。VMAT计划采用10 MV的X线,根据卵巢位置分为3段双弧,角度设置原则依照在BEV方向卵巢与射野重叠最少,间隔2°(图 2)。HT计划中射野宽度(field width,FW)为2.5 cm,螺距Pitch为0.43,调制因子(modulation factor,MF)为2,剂量计算网格(dose grid)选择精细(fine),卵巢设定半挡(directional block)模式。由于本研究为回顾性研究,实际治疗情况为7例患者接受IMRT治疗,3例患者接受HT治疗。所有计划的剂量学限值如下:均以PTV为参考体积,要求95%的PTV达到处方剂量45 Gy,>115%的区域 < 0.03 cm3;99%的CTV达到处方剂量45 Gy;脊髓最大剂量(Dmax) < 45 Gy;膀胱、直肠和肠袋的D2cc(2 cm3受到的最低照射剂量) < 50 Gy,膀胱40%处方剂量包绕的照射体积百分比V40 < 70%,直肠V40 < 100%,肠袋V40 < 70%且接受处方剂量45 Gy照射的绝对体积V45 < 195 cm3(如肠袋与PTV重叠体积>195 cm3,则不作为强制要求);骨髓接受10 Gy和20 Gy剂量照射的体积百分比V10 < 85%、V20 < 70%;股骨头平均剂量(Dmean) < 14 Gy;卵巢Dmax < 5 Gy(尽量控制在4 Gy以内)、Dmean在3 Gy左右(尽量 < 3 Gy)。
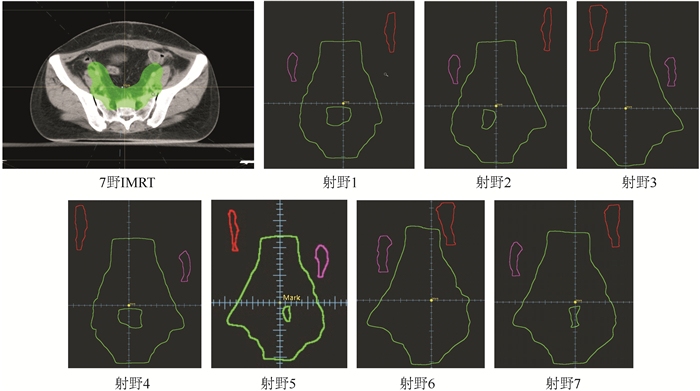
|
| 图 1 IMRT射野布置 Fig.1 Beam layout of intensity modulated radiation therapy (IMRT) |
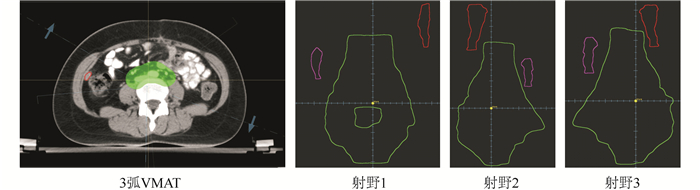
|
| 图 2 VMAT射野布置 Fig.2 Beam layout of volume modulated arc therapy (VMAT) |
10例患者的左右卵巢由于位置关系经计划设计得出的剂量参数差别较大,与临床沟通当一侧卵巢Dmax>4 Gy、Dmean>3 Gy时,考虑到该侧卵巢放疗后功能丧失可能性较大,建议尝试放弃该侧卵巢只保留另一侧卵巢来进行计划设计,以期降低保留侧卵巢的剂量并实现PTV和其他OAR更好的剂量学分布。对10例患者分别进行IMRT、VMAT和HT的保留右侧卵巢的计划设计。
1.6 三维适形放疗(three dimensional conformal radiation therapy, 3D-CRT)计划设计子宫颈癌放疗中3D-CRT是常用技术之一。3D-CRT的常规方式是采用盒式照射,0°、90°、180°和270°设置照射野,利用多叶准直器(mutileaf collimator, MLC)适形并通过调整各个射野权重来实现临床目标[11]。4野照射的缺点是,靶区两端及内部会有较多欠量(< 处方剂量),PTV处方剂量的范围一般在90%左右[12]。本院采取6野照射,即在靶区上下两端增加90°和270°的小照射野,单次剂量在0.1 Gy左右,同时利用小野来补充靶区中间的欠量,基本可实现PTV处方剂量95%左右覆盖。对于利用3D-CRT技术保留卵巢,从射野角度分析0°和180°的射野内卵巢位于PTV外,90°和270°的射野内卵巢与靶区重叠。为了降低卵巢剂量,可将90°和270°射野的上缘拉直至卵巢下缘≥2.5 cm处,这样造成PTV上部分欠量,通过增加0°和180°的7、8野来弥补。7、8野的下缘与90°和270°野上缘重合,设置单次剂量0.65~0.75 Gy,再次调整射野权重来完成计划。对10例病例进行3D-CRT保卵巢计划设计,计划在Pinnacle3 version8系统完成,采用10 MV的X线,相关射野设置图如图 3。

|
| 图 3 3D-CRT射野布置 Fig.3 Beam layout of three dimensional conformal radiation therapy (3D-CRT) |
分别在Raystation和Tomotherapy系统中,利用等剂量曲线及剂量体积直方图(dose volume histogram,DVH)对IMRT、VMAT及HT治疗计划进行评估和剂量学比较。比较评估以下数据:PTV的最大剂量(Dmax)、最小剂量(Dmin)和平均剂量(Dmean);适形指数(conformity index,CI),CI=(Vt, ref)2/(Vt×Vref),Vt,ref为处方剂量覆盖的PTV体积,Vt为PTV体积,Vref为处方剂量的全部体积;均匀性指数(homogeneity index,HI),HI=100×(D2-D98)/Dp,D2和D98为2%和98%的PTV接受的最低剂量,Dp为处方剂量[13];左、右双侧卵巢的Dmax和Dmean;脊髓的Dmax;膀胱、直肠和肠袋接受10、20、30和40 Gy照射的体积百分比V10、V20、V30和V40以及D2cc;肠袋V45;骨髓V10和V20;左、右股骨头的Dmean。
1.8 统计学分析应用SPSS 22软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,采用独立样本非参数检验的Kruskal-Wallis(K-W)法和Wilcoxn配对符号秩和检验法检查分析PTV及OAR的剂量学参数。以P<0. 05为差异具有统计学意义。
2 结果 2.1 治疗参数子宫颈癌放疗卵巢受照剂量与移位位置和距PTV边缘的最近距离相关[14-16]。10例患者的PTV和OAR的几何参数及卵巢与PTV和髂嵴的位置数据如表 1。
| 病例 | 体积(cm3) | 距PTV最近距离(cm) | 卵巢末端距髂嵴距离(cm) | ||||||
| PTV | Ovary-L | Ovary-R | Ovary-L | Ovary-R | Ovary-L | Ovary-R | |||
| 1 | 1 291.52 | 12.84 | 12.47 | 3.31 | 2.89 | 2.61 | 5.09 | ||
| 2 | 1 199.96 | 20.40 | 13.78 | 6.03 | 4.02 | 2.16 | -0.50 | ||
| 3 | 1 168.22 | 9.90 | 13.41 | 2.83 | 4.98 | -0.50 | 4.31 | ||
| 4 | 1 172.87 | 11.67 | 17.32 | 3.60 | 3.30 | -1.01 | 3.09 | ||
| 5 | 914.81 | 9.81 | 25.58 | 2.23 | 3.32 | -3.69 | -1.47 | ||
| 6 | 880.81 | 6.98 | 5.49 | 2.42 | 3.16 | -2.75 | -1.53 | ||
| 7 | 1046.53 | 10.41 | 14.27 | 4.91 | 3.87 | 0.35 | -0.47 | ||
| 8 | 975.64 | 4.70 | 8.69 | 2.89 | 4.76 | -1.95 | 0.11 | ||
| 9 | 1 111.71 | 25.74 | 5.98 | 3.53 | 4.28 | -0.21 | 2.32 | ||
| 10 | 888.16 | 18.71 | 18.24 | 2.20 | 2.42 | -3.71 | 0.12 | ||
| 均值±标准差 (x±s) |
1 065.02±145.33 | 13.12±6.52 | 13.52±6.04 | 3.40±1.23 | 3.70±0.83 | -0.87±2.21 | 1.11±2.41 | ||
| 注 PTV:计划靶区(planning target volume);Ovary-L:左卵巢;Ovary-R:右卵巢;卵巢末端在髂嵴上侧距离为正值,在髂嵴下侧为负值 | |||||||||
所有的放疗计划均依照剂量学限值进行设计,三组计划中PTV的剂量学参数见表 2。三组Dmean和HI比较,差异均无统计学意义(均P>0.05);Dmax(H=9.626,P=0.008)、Dmin(H=22.4,P < 0.01)和CI(H=7.176,P=0.028)比较,差异均具有统计学意义。HT的Dmax最低(47.74~50.89 Gy)且与IMRT和VMAT两两比较差异均具有统计学意义(均P < 0.05);IMRT的Dmin最高(43.51~44.18 Gy),与HT和VMAT两两比较,差异均具有统计学意义(均P < 0.05);IMRT的CI最大(0.787~0.900),与HT相近,IMRT与VMAT在CI方面比较,差异具有统计学意义(P < 0.05)。
| 放疗计划 | 例数 | Dmax(Gy) | Dmean(Gy) | Dmin(Gy) | HI | CI |
| IMRT | 10 | 50.39±0.96# | 46.59±0.33 | 43.74±0.30# | 0.094±0.017 | 0.850±0.037* |
| VMAT | 10 | 50.38±0.91# | 46.68±0.34 | 42.85±0.62# | 0.103±0.018 | 0.791±0.054 |
| HT | 10 | 49.01±0.91 | 46.91±0.74 | 40.23±0.57 | 0.092±0.028 | 0.848±0.038 |
| H值 | 9.626 | 0.601 | 22.400 | 0.985 | 7.176 | |
| P值 | 0.008 | 0.741 | < 0.01 | 0.611 | 0.028 | |
| 注 IMRT:调强放疗(intensity modulated radiation therapy);VMAT:容积旋转调强放疗(volume modulated arc therapy);HT:螺旋断层放疗(helical tomotherapy);Dmax:最大剂量;Dmean:平均剂量;Dmin:最小剂量;HI:均匀性指数(homogeneity index);CI:适形指数(conformity index);H值和P值为IMRT、VMAT和HT三者的非参数检验;*与VMAT比较,P < 0.05;#与HT比较,P < 0.05 | ||||||
危及器官的剂量学参数见表 3。三组计划仅右侧卵巢的Dmax比较,差异具有统计学意义(H=11.372,P=0.003)。HT的Dmax最低(2.33~4.30 Gy),与VMAT比较,差异具有统计学意义(P < 0.05)。三组计划膀胱的V20(H=7.879, P=0.019)、V30(H=12.943, P=0.002)和V40(H=15.012, P=0.001)比较,差异均具有统计学意义;HT与IMRT和VMAT两两比较,差异均具有统计学意义(均P < 0.05),且HT计划最低,V20、V30和V40分别为89.22%~100%、43.35%~100%和19.59%~69.54%。三组计划肠袋V40(H=7.837, P=0.002)和骨髓V20(H=6.720, P=0.035)比较,差异均具有统计学意义,均为HT最低(13.06%~35.64%,46.1%~63.1%)。三组计划的股骨头剂量学参数比较,差异均无统计学意义(均P>0.05)。三组计划脊髓Dmax比较,差异具有统计学意义(H=15.037, P=0.001),HT最低(31.05~39.05 Gy),HT与IMRT和VMAT两两比较,差异均具有统计学意义(均P < 0.05)。
| OAR剂量学参数 | IMRT | VMAT | HT | H值 | P值 |
| 左卵巢 | |||||
| Dmax(Gy) | 4.02±0.57 | 4.45±0.69 | 3.84±0.69 | 5.546 | 0.062 |
| Dmean(Gy) | 2.44±0.67 | 2.73±0.71 | 2.47±0.51 | 1.680 | 0.432 |
| 右卵巢 | |||||
| Dmax(Gy) | 3.74±0.71 | 4.20±0.39* | 3.10±0.66 | 11.372 | 0.003 |
| Dmean(Gy) | 2.16±0.71 | 2.49±0.58 | 1.97±0.52 | 4.544 | 0.103 |
| 直肠 | |||||
| D2cc(Gy) | 46.74±1.10 | 46.86±1.15 | 47.93±1.20 | 5.933 | 0.051 |
| V10(%) | 98.65±2.58 | 99.08±1.70 | 100.00 | 3.590 | 0.166 |
| V20(%) | 98.08±3.56 | 97.49±3.51 | 98.84±1.7 | 1.236 | 0.539 |
| V30(%) | 94.43±4.75 | 93.32±5.71 | 96.30±5.51 | 2.246 | 0.325 |
| V40(%) | 74.49±15.46 | 78.15±16.67 | 83.25±13.42 | 1.712 | 0.425 |
| 膀胱 | |||||
| D2cc(Gy) | 47.85±0.59 | 47.85±0.89 | 48.21±1.19 | 1.175 | 0.556 |
| V10(%) | 100.00 | 100.00 | 100.00 | 0.000 | 1.000 |
| V20(%) | 99.79±0.66* | 99.06±1.98 | 94.03±8.83 | 7.879 | 0.019 |
| V30(%) | 88.61±8.45* | 91.03±11.99* | 65.85±15.33 | 12.943 | 0.002 |
| V40(%) | 50.17±7.35* | 62.22±14.96* | 36.65±12.83 | 15.012 | 0.001 |
| 肠袋 | |||||
| D2cc(Gy) | 4 814.20±59.23 | 4 835.10±62.77 | 4 819.10±88.55 | 0.320 | 0.852 |
| V10(%) | 68.27±8.94 | 64.46±9.01 | 73.36±9.09 | 4.910 | 0.086 |
| V20(%) | 59.23±9.48 | 13.42±27.31 | 59.83±9.87 | 0.008 | 0.961 |
| V30(%) | 50.79±8.42 | 50.27±8.21 | 46.16±9.33 | 2.141 | 0.343 |
| V40(%) | 29.55±5.92 | 35.12±9.15* | 25.38±6.41 | 7.837 | 0.020 |
| V45(cm3) | 145.80±37.98 | 178.39±36.41 | 155.15±44.67 | 3.229 | 0.199 |
| 骨髓 | |||||
| V10(%) | 69.45±8.12 | 67.75±6.48 | 69.97±3.64 | 0.844 | 0.656 |
| V20(%) | 58.95±7.17* | 58.41±6.38 | 51.51±4.96 | 6.720 | 0.035 |
| 左股骨头Dmean(Gy) | 6.32±2.82 | 5.86±1.85* | 8.50±0.69 | 8.596 | 0.076 |
| 右股骨头Dmean(Gy) | 7.06±2.50 | 6.90±1.44 | 8.37±0.82 | 5.144 | 0.656 |
| 脊髓Dmax(Gy) | 39.17±1.41* | 40.41±1.58* | 36.05±3.04 | 15.037 | 0.001 |
| 注 OAR:危及器官(organ at risk);IMRT:调强放疗(intensity modulated radiation therapy);VMAT:容积旋转调强放疗(volume modulated arc therapy);HT:螺旋断层放疗(helical tomotherapy); D2cc:2 cm3受到的最低照射剂量;H值和P值为IMRT、VMAT和HT三者的非参数检验;*与HT比较,P < 0.05 | |||||
对结果综合分析,HT可以在保证靶区剂量覆盖的情况下有更好的PTV均匀度并可控制PTV高量,最大程度降低双侧卵巢Dmax和Dmean以及其他正常组织的体积剂量;IMRT在PTV低剂量控制具有优势,在其他剂量学参数上次于HT但优于VMAT。
2.3 保留单侧卵巢计划剂量学参数对10例患者分别进行IMRT、VMAT和HT的保留右侧卵巢的计划设计(表 4~5)。HT在PTV的Dmax、右卵巢Dmax、膀胱V20、膀胱V30、膀胱V40和脊髓Dmax方面均具有剂量学优势(均P < 0.05)。IMRT在PTV的CI、直肠和肠袋的V10和左、右股骨头Dmean方面均具有剂量学优势(均P < 0.05)。进一步与保留双侧卵巢的IMRT、VMAT和HT进行对比分析(表 6)。保留双侧卵巢计划中,IMRT计划在PTV的Dmean和左右股骨头的Dmean方面均具有剂量学优势(均P < 0.05);VMAT组在PTV的CI、右卵巢的Dmax、脊髓Dmax、膀胱V40和肠袋的V10、V40和V45方面均具有剂量学优势(均P < 0.05);HT组在PTV的CI和肠袋V10方面均具有剂量学优势(均P < 0.05)。结果表明,保留单侧卵巢的放疗技术并没有实现更好地降低卵巢剂量和优化剂量分布的目的。
| 放疗计划 | 例数 | Dmax(Gy) | Dmean(Gy) | Dmin(Gy) | HI | CI |
| IMRT | 10 | 50.23±0.99* | 46.48±0.26 | 43.90±0.27* | 0.088±0.014 | 0.857±0.027* |
| VMAT | 10 | 49.95±0.67* | 46.67±0.36 | 42.16±4.42* | 0.096±0.019 | 0.838±0.072 |
| HT | 10 | 48.77±0.77 | 46.84±0.36 | 40.75±3.35 | 0.081±0.017 | 0.799±0.047 |
| H值 | 11.629 | 5.668 | 18.842 | 4.791 | 12.317 | |
| P值 | 0.003 | 0.059 | < 0.01 | 0.091 | 0.009 | |
| 注 IMRT:调强放疗(intensity modulated radiation therapy);VMAT:容积旋转调强放疗(volume modulated arc therapy);HT:螺旋断层放疗(helical tomotherapy);Dmax:最大剂量;Dmean:平均剂量;Dmin:最小剂量;HI:均匀性指数(homogeneity index);CI:适形指数(conformity index);H值和P值为IMRT、VMAT和HT三者的非参数检验;*与HT比较,P < 0.05 | ||||||
| OAR剂量学参数 | IMRT | VMAT | HT | H值 | P值 |
| 左卵巢 | |||||
| Dmax(Gy) | 5.21±1.88* | 7.34±2.33 | 12.37±5.30 | 12.317 | 0.002 |
| Dmean(Gy) | 2.64±0.88* | 3.63±1.01 | 6.33±2.74 | 12.839 | 0.002 |
| 右卵巢 | |||||
| Dmax(Gy) | 3.66±0.67 | 3.96±0.52* | 3.11±0.59 | 8.231 | 0.016 |
| Dmean(Gy) | 2.13±0.71 | 2.46±0.67 | 1.99±0.47 | 3.661 | 0.160 |
| 直肠 | |||||
| D2cc(Gy) | 46.76±1.08 | 47.19±1.12 | 47.68±0.52 | 3.679 | 0.159 |
| V10(%) | 98.49±2.38* | 99.64±0.61 | 100.00 | 6.492 | 0.039 |
| V20(%) | 96.81±3.88 | 98.54±2.51 | 98.77±1.86 | 1.815 | 0.403 |
| V30(%) | 94.59±5.02 | 94.29±5.96 | 96.47±5.48 | 1.834 | 0.400 |
| V40(%) | 74.71±13.97 | 78.02±11.83 | 84.77±12.21 | 3.107 | 0.211 |
| 膀胱 | |||||
| D2cc(Gy) | 47.85±0.59 | 48.09±0.63 | 47.89±0.57 | 0.822 | 0.663 |
| V10(%) | 100.00 | 100.00 | 100.00 | 0.000 | 1.000 |
| V20(%) | 99.86±0.45* | 99.85±0.47* | 92.03±7.27 | 13.217 | 0.001 |
| V30(%) | 91.32±7.13* | 91.66±8.79* | 61.59±16.1 | 12.715 | 0.002 |
| V40(%) | 50.54±7.19* | 55.80±11.25* | 35.69±12.81 | 13.319 | 0.001 |
| 肠袋 | |||||
| D2cc(Gy) | 48.01±0.60 | 48.28±0.47 | 47.97±0.63 | 1.582 | 0.453 |
| V10(%) | 69.19±7.79 | 67.79±8.06* | 78.24±11.5 | 6.235 | 0.044 |
| V20(%) | 59.53±8.79 | 58.14±8.36 | 61.34±10.09 | 1.610 | 0.447 |
| V30(%) | 50.86±8.91 | 50.37±8.43 | 45.41±7.6 | 4.106 | 0.128 |
| V40(%) | 30.88±10.62 | 31.11±7.30 | 25.57±5.56 | 3.469 | 0.177 |
| V45(cm3) | 147.97±44.79 | 159.34±38.58 | 161.11±41.71 | 0.756 | 0.685 |
| 骨髓 | |||||
| V10(%) | 67.77±7.99 | 67.85±5.30 | 70.82±4.72 | 1.541 | 0.463 |
| V20(%) | 57.31±6.83 | 56.84±6.36 | 51.60±5.11 | 4.501 | 0.105 |
| 左股骨头Dmean(Gy) | 5.60±2.45* | 5.97±1.63* | 8.45±0.92 | 10.189 | 0.006 |
| 右股骨头Dmean(Gy) | 6.14±2.22* | 6.49±0.97* | 8.46±1.06 | 10.931 | 0.004 |
| 脊髓Dmax(Gy) | 39.22±1.29* | 39.45±1.35* | 36.10±3.52 | 10.663 | 0.005 |
| 注 OAR:危及器官(organ at risk);IMRT:调强放疗(intensity modulated radiation therapy);VMAT:容积旋转调强放疗(volume modulated arc therapy);HT:螺旋断层放疗(helical tomotherapy);Dmax:最大剂量;Dmean:平均剂量;H值、P值为IMRT、VMAT和HT三者的非参数检验;*与HT比较, P < 0.05 | |||||
| PTV和OAR剂量学参数 | P值 | ||
| IMRT | VMAT | HT | |
| PTV | |||
| Dmax | 0.058 | 0.314 | 0.444 |
| Dmean | 0.046 | 0.906 | 0.721 |
| Dmin | 0.083 | 0.169 | 0.878 |
| HI | 0.066 | 0.507 | 0.153 |
| CI | 0.878 | 0.021 | 0.036 |
| 左卵巢 | |||
| Dmax | 0.047 | 0.009 | 0.005 |
| Dmean | 0.646 | 0.008 | 0.005 |
| 右卵巢 | |||
| Dmax | 0.169 | 0.074 | 0.076 |
| Dmean | 0.103 | 0.959 | 0.358 |
| 脊髓Dmax | 0.203 | 0.047 | 0.444 |
| 直肠 | |||
| D2cc | 0.683 | 0.575 | 0.515 |
| V10 | 0.465 | 0.180 | 0.100 |
| V20 | 0.115 | 0.345 | 0.715 |
| V30 | 0.889 | 0.484 | 0.345 |
| V40 | 0.610 | 0.333 | 0.236 |
| 膀胱 | |||
| D2cc | 0.919 | 0.202 | 0.386 |
| V10 | 1.000 | 1.000 | 1.000 |
| V20 | 0.317 | 0.180 | 0.612 |
| V30 | 0.214 | 0.203 | 0.139 |
| V40 | 0.646 | 0.022 | 0.386 |
| 肠袋 | |||
| D2cc | 0.333 | 0.878 | 0.610 |
| V10 | 0.169 | 0.007 | 0.017 |
| V20 | 0.386 | 0.721 | 0.028 |
| V30 | 0.959 | 0.720 | 0.386 |
| V40 | 0.799 | 0.007 | 0.721 |
| V45 | 0.374 | 0.028 | 0.594 |
| 骨髓 | |||
| V10 | 0.059 | 0.878 | 0.386 |
| V20 | 0.093 | 0.333 | 0.678 |
| 左股骨头Dmean | 0.007 | 0.285 | 0.760 |
| 右股骨头Dmean | 0.005 | 0.139 | 0.575 |
| 注 PTV:计划靶区体积(planning target volume);OAR:危及器官(organ at risk);IMRT:调强放疗(intensity modulated radiation therapy);VMAT:容积旋转调强放疗(volume modulated arc therapy);HT:螺旋断层放疗(helical tomotherapy);Dmax:最大剂量;Dmean:平均剂量;Dmin:最小剂量;HI:均匀性指数(homogeneity index);CI:适形指数(conformity index);表中数据为单侧卵巢IMRT、VMAT、HT计划与同一计划的双侧卵巢计划的非参数检验的P值 | |||
3D-CRT组在PTV的Dmax、Dmean、Dmin、CI和HI分别为(47.72±0.29)Gy、(46.07±0.07)Gy、(34.27±3.19)Gy、(0.452±0.046)和(0.086±0.007),除HI以外,其他参数与前3种计划比较,差异均具有统计学意义(均P < 0.05),且Dmax值最低,但CI值最小即均匀性最差;3D-CRT与前3种计划比较,左右卵巢的Dmax和Dmean值、左右股骨头Dmean和脊髓Dmax均最高,直肠、膀胱和肠袋的D2cc值均最低,膀胱V20、V30、V40和肠袋V10、V40、V45以及骨髓V10、V20均最高(均P < 0.05, 表 7)。由于7、8野的设置使脊髓Dmax>45 Gy,只有病例6由于其PTV上界位于第5腰椎(lumbar vertebrae 5,L5)下缘Dmax < 45 Gy。结果表明,3D-CRT在控制卵巢剂量整体上不如IMRT、VMAT和HT,但是对于部分靶区范围较小的病例,可以实现近似的剂量,并可控制OAR的D2cc值。
| OAR剂量学参数 | 3D-CRT | H值 | P值 |
| 左卵巢 | |||
| Dmax(Gy) | 4.48±0.71 | 8.641 | 0.034 |
| Dmean(Gy) | 3.24±0.63#△ | 11.292 | 0.010 |
| 右卵巢 | |||
| Dmax(Gy) | 3.81±0.43 | 13.412 | 0.004 |
| Dmean(Gy) | 2.77±0.58# | 9.597 | 0.022 |
| 直肠 | |||
| D2cc(Gy) | 46.78±0.39 | 8.162 | 0.043 |
| V10(%) | 99.05±1.80 | 3.723 | 0.293 |
| V20(%) | 97.98±3.30 | 1.361 | 0.715 |
| V30(%) | 96.33±5.28 | 3.206 | 0.361 |
| V40(%) | 90.55±6.34 | 6.335 | 0.096 |
| 膀胱 | |||
| D2cc(Gy) | 47.14±0.17# | 8.916 | 0.030 |
| V10(%) | 100.00 | 0.000 | 1.000 |
| V20(%) | 100.00# | 12.910 | 0.005 |
| V30(%) | 98.38±2.71# | 18.162 | < 0.01 |
| V40(%) | 79.55±11.35#△ | 26.221 | < 0.01 |
| 肠袋 | |||
| D2cc(Gy) | 47.57±0.31* | 9.264 | 0.026 |
| V10(%) | 59.93±7.97# | 10.255 | 0.017 |
| V20(%) | 54.32±7.91 | 2.865 | 0.413 |
| V30(%) | 50.70±8.27 | 2.503 | 0.475 |
| V40(%) | 43.80±7.45#△ | 21.080 | < 0.01 |
| V45(cm3) | 430.31±106.76*#△ | 23.784 | < 0.01 |
| 骨髓 | |||
| V10(%) | 83.01±8.49*△ | 13.291 | 0.004 |
| V20(%) | 76.00±9.21*# | 21.489 | < 0.01 |
| 左股骨头Dmean(Gy) | 18.21±3.25#△ | 26.826 | < 0.01 |
| 右股骨头Dmean(Gy) | 17.80±3.07*#△ | 24.870 | < 0.01 |
| 脊髓Dmax(Gy) | 46.89±0.65#△ | 30.479 | < 0.01 |
| 注 3D-CRT:三维适形(three dimensional conformal radiation therapy);OAR:危及器官(organ at risk);Dmax:最大剂量;Dmean:平均剂量;H值和P值为3D-CRT与IMRT、VMAT和HT的非参数检验;*与VMAT比较,P < 0.05;#与HT比较,P < 0.05;△与IMRT比较,P < 0.05 | |||
年轻子宫颈癌患者放疗时卵巢功能的保留与多种因素相关,放疗前手术卵巢移位位置和放疗时卵巢接受的照射剂量是其中2个关键点。目前卵巢移位术及卵巢固定术较为成熟,移位的卵巢带血管蒂,局部出血和坏死情况较少,卵巢的血供有保障[17-19]。卵巢移位位置不同其受照射剂量不同,如卵巢移位于髂嵴上,其保留正常功能概率达到70%~90%,如移位于髂嵴下则59%~100%的功能将会衰退或丧失,并建议将卵巢移位于髂嵴上≥1.5 cm[20]。Toman等[21]通过研究接受完放疗的卵巢不同移位点与其功能的关系,得出照射野边缘>2.5 cm的范围是安全区域,并建议将卵巢移位至髂前上脊≥3.5 cm处。目前临床上对于放疗中卵巢剂量限值也尚未统一,Wallace等[22]研究表明,单次剂量>8 Gy,或分割剂量>15 Gy可造成卵巢功能衰竭,但剂量 < 1.5 Gy时对卵巢功能影响较小。Husseinzadeh等[23]发现,卵巢接受1次4 Gy或15 Gy/10 F的照射将会导致其功能丧失。Wallace等[24]后续的研究发现,行双侧卵巢移位的患者接受 < 5 Gy的照射剂量后卵巢功能保留率可达64%。Chemaitilly等[25]报道称儿童患者接受10~20 Gy,成年患者接受4~6 Gy会导致卵巢功能永久性丧失。Wo等[26]研究发现,卵巢剂量 < 6 Gy,其功能不受影响,6~8 Gy可使卵巢暂时或永久丧失功能,>8 Gy时卵巢功能会完全丧失。
本研究统计双侧移位卵巢到PTV边缘的最短距离和卵巢末端距髂嵴距离,7例双侧卵巢距离PTV边缘均>2.5 cm,2例一侧卵巢距离>2.5 cm;1例双侧卵巢末端距髂嵴>1.5 cm,4例单侧卵巢距离>1.5 cm,2例单侧卵巢距离>3.5 cm,2例双侧卵巢末端在髂嵴下。分析卵巢受照剂量与位置关系,可得出当卵巢距离PTV边缘>2.23 cm且末端距离髂嵴>-3.69 cm的情况下,可满足Dmax < 5 Gy和Dmean < 3 Gy;卵巢距离PTV边缘>3.3 cm且末端距离髂嵴>-0.47 cm的情况下,可满足Dmax < 4 Gy和Dmean < 3 Gy。笔者前期初步研究通过对本院近10年的约300例保卵巢子宫颈癌患者资料进行分析表明,卵巢距离PTV边缘>2.5 cm且末端高于髂嵴的情况下,卵巢功能保留的可能性较大;卵巢剂量在Dmax < 4 Gy和Dmean < 3 Gy时功能保留概率最高,Dmax < 5 Gy、Dmean < 3.5 Gy时有一定比例保留成功,Dmax>5 Gy和Dmean>4 Gy时成功率很低,目前该项研究正在进行中,本院现行的卵巢推荐剂量限值为Dmax < 4 Gy和Dmean < 3 Gy,如剂量不满足则需要和临床沟通确定治疗方案。
10例均为术后患者,放疗方案不包括192Ir高剂量率后装治疗,因此不考虑后装对卵巢剂量的影响。国内外研究报道均表明,子宫颈癌放疗后卵巢内分泌功能成功保留的概率不高[27-29]。本研究为一项基于回顾性剂量学比较的方法研究,比较子宫颈癌放疗时行双侧卵巢保留时的剂量分布数据。由于双侧卵巢移位位置恰当并成功实施放疗的患者数量较少,多数是保留单侧卵巢功能放疗的病例。经调研也很少有对于双侧移位卵巢功能保留的研究报道,业内对于卵巢功能保留的剂量限值和计划设计还没有统一的规范。本研究仅从剂量学角度进行分析,8例完成放疗,且放疗结束后经激素检查有7例显示卵巢功能得到保留,后期患者随访正在进行中。因此,通过多中心合作,进一步扩大样本量,并将年龄和同期化疗纳入分析范围,完善跟踪随访,是未来的研究方向。
综上所述,在年轻子宫颈癌双侧移位卵巢功能保留的放疗计划设计中,HT与IMRT、VMAT和3D-CRT比较,可降低卵巢的最大量和平均量,并保证PTV和其他OAR有较好的剂量学分布。本研究初步提出子宫颈癌放疗时保留卵巢功能的卵巢剂量限值(Dmax < 4 Gy和Dmean < 3 Gy)和卵巢功能是否能保留的预判断方法(卵巢距离PTV边缘>2.5 cm、卵巢下缘高于髂嵴)。HT技术的治疗成本和设备要求较高,在条件不允许的情况下特殊布野的IMRT技术可作为推荐,3D-CRT技术对PTV范围有一定要求且其应用也有待进一步研究证实。
| [1] |
Shuang L, Ting H, Weiguo L, et al. Changes in prevalence and clinical characteristics of cervical cancer in the People's Republic of China:A study of 10, 012 cases from a nationwide working group[J]. Oncol, 2013, 18(10): 1101-1107. |
| [2] |
吕晓娟, 程晓龙, 俞华. 宫颈癌放疗时保留卵巢功能的研究进展[J]. 中华放射肿瘤学杂志, 2016, 25(6): 661-664. DOI:10.3760/cma.j.issn.1004-4221.2016.06.026 |
| [3] |
Du Z, Qu H. The relationship between ovarian function and ovarian limited dose in radiotherapy postoperation of ovarian transposition in young patients with cervical cancer[J]. Cancer Med, 2017, 6(3): 508-515. DOI:10.1002/cam4.924 |
| [4] |
Olmińska M, Piotrowski T, Litoborska J, et al. Conversion of the helical tomotherapy plans to the step-and-shoot IMRT plans for patients with hip prosthesis during radiotherapy for prostate cancer[J]. Physica Medica, 2016, 32(1): 260-265. DOI:10.1016/j.ejmp.2015.11.007 |
| [5] |
戴相昆, 蔡博宁, 葛瑞刚, 等. 胸上段食管癌螺旋断层放疗和容积旋转调强放疗的剂量学比较[J]. 中华放射医学与防护杂志, 2016, 36(1): 58-62. DOI:10.3760/cma.j.issn.0254-5098.2016.01.011 |
| [6] |
Tabbaa ZM, Gonzalez J, Sznurkowski JJ, et al. Impact of the new FIGO 2009 staging classification for vulvar cancer on prognosis and stage distribution[J]. Gynecol Oncol, 2012, 127(1): 147-152. DOI:10.1016/j.ygyno.2012.06.005 |
| [7] |
蒋军, 李莉, 张利文, 等. 宫颈癌术后旋转拉弧适形和调强及三维适形放疗计划对比研究[J]. 中华肿瘤防治杂志, 2014, 21(8): 620-625. DOI:10.3969/j.issn.1673-5269.2014.08.012 |
| [8] |
William Small J, Mell LK, Anderson P, et al. Consensus guidelines for the delineation of the clinical target volume for intensity modulated pelvic radiotherapy in the postoperative treatment of endometrial and cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(2): 428. DOI:10.1016/j.ijrobp.2007.09.042 |
| [9] |
周晖, 林仲秋. 子宫颈癌治疗进展和争议问题[J]. 实用肿瘤杂志, 2016, 6(31): 494-501. |
| [10] |
倪镌, 殷卓敏, 袁淑慧, 等. 妇科恶性肿瘤患者术后辅助不同方式放疗的对比研究[J]. 中华妇产科杂志, 2017, 52(3): 168-174. DOI:10.3760/cma.j.issn.0529-567x.2017.03.006 |
| [11] |
Lowrey N, Nilsson S, Moutrie Z, et al. Comparison of CT-based volumetric dosimetry with traditional prescription points in the treatment of cervical cancer with PDR brachytherapy[J]. J Med Imaging Radiat Oncol, 2015, 29(10): 1111-1117. |
| [12] |
Erpolat OP, Alco G, Caglar HB, et al. Comparison of hematologic toxicity between 3DCRT and IMRT planning in cervical cancer patients after concurrent chemoradiotherapy:a national multi-center study[J]. Eur J Gynaecol Oncol, 2014, 35(1): 62-66. |
| [13] |
邵琰, 王昊, 陈华, 等. 适形指数和均匀性指数的临床应用[J]. 中华放射医学与防护杂志, 2017, 37(9): 717-721. DOI:10.3760/cma.j.issn.0254-5098.2017.09.016 |
| [14] |
Han SS, Kim YH, Lee SH, et al. Underuse of ovarian transposition in reproductive-aged cancer patients treated by primary or adjuvant pelvic irradiation[J]. Obstetr Gynaecol Res, 2011, 37(7): 825-829. DOI:10.1111/j.1447-0756.2010.01443.x |
| [15] |
Kumar G, Alex L, Ioannis G, et al. Outcomes of ovarian transposition in gynecological cancer; a systematic review and meta-analysis[J]. J Ovar Res, 2014, 7(69): 1-10. |
| [16] |
Mossa B, Schimberni M, Di Benedetto L, et al. Ovarian transposition in young women and fertility sparing[J]. Eur Rev Med Pharmacol Sci, 2015, 19(18): 3418. |
| [17] |
Tamar P, Gilad BB, Tima D, et al. Use of titanium spiral tacks for long-term oophoropexy before pelvic irradiation[J]. Int J Gynecol Cancer, 2014, 24(6): 1133-1136. DOI:10.1097/IGC.0000000000000146 |
| [18] |
Samer B, Mahomoud A, Osama B, et al. Ovarian transposition before pelvic irradiation:Indications and functional outcome[J]. Obstetr Gynaecol Res, 2013, 39(11): 1533-1537. DOI:10.1111/jog.12096 |
| [19] |
Seung SH, Yun HK, Sang HL, et al. Underuse of ovarian transposition in reproductive-aged cancer patients treated by primary or adjuvant pelvic irradiation[J]. Obstetr Gynaecol Res, 2011, 37(7): 825-829. DOI:10.1111/j.1447-0756.2010.01443.x |
| [20] |
Barahmeh S, Al Masri M, Badran O, et al. Ovarian transposition before pelvic irradiation:Indications and functional outcome[J]. J Obstet Gynaecol Res, 2013, 39(11): 5-13. |
| [21] |
Toman J, Feyereisl J, Zámecník J, et al. A safe site for transposition of ovaries in radical hysterectomy for cervical carcinoma[J]. Ceská Gynekologie, 2001, 66(3): 184. |
| [22] |
Wallace WH, Shalet SM, Hendry JH, et al. Ovarian failure following abdominal irradiation in childhood:The radiosensitivity of the human oocyte[J]. Brit J Radiol, 1989, 62(743): 995-998. DOI:10.1259/0007-1285-62-743-995 |
| [23] |
Husseinzadeh N, van Aken ML, Aron B. Ovarian transposition in young patients with invasive cervical cancer receiving radiation therapy[J]. Int J Gynecol Cancer, 1994, 4(1): 61-65. DOI:10.1046/j.1525-1438.1994.04010061.x |
| [24] |
Wallace WH, Thomson AB, Saran F, et al. Predicting age of ovarian failure after radiation to a field that includes the ovaries[J]. Int J Radiat Oncol Biol Phys, 2005, 62(3): 738-744. DOI:10.1016/j.ijrobp.2004.11.038 |
| [25] |
Chemaitilly W, Mertens AC, Mitby P, et al. Acute ovarian failure in the childhood cancer survivor study[J]. J Clin Endocrinol Metab, 2006, 91(5): 1723-1728. DOI:10.1210/jc.2006-0020 |
| [26] |
Wo JY, Viswanathan AN. Impact of radiotherapy on fertility, pregnancy, and neonatal outcomes in female cancer patients[J]. Int J Radiat Oncol Biol Phys, 2009, 73(5): 1304-1312. DOI:10.1016/j.ijrobp.2008.12.016 |
| [27] |
王晋, 向淼, 黎雪梅, 等. 放疗科医师对子宫颈癌盆腔放疗患者性生活的态度及指导调查[J]. 实用肿瘤杂志, 2016, 31(5): 442-445. |
| [28] |
Stroud JS, Mutch D, Rader J, et al. Effects of cancer treatment on ovarian function[J]. Int J Fertil Steri, 2009, 92(2): 417-427. DOI:10.1016/j.fertnstert.2008.07.1714 |
| [29] |
Hwang JH, Yoo HJ, Park SH, et al. Association between the location of transposed ovary and ovarian function in patients with uterine cervical cancer treated with (postoperative or primary) pelvic radiotherapy[J]. Int J Fertil Steri, 2012, 97(6): 1387-1393. DOI:10.1016/j.fertnstert.2012.02.052 |
 2019, Vol. 34
2019, Vol. 34


