文章信息
- 罗宏涛, 魏世鸿, 康振朝, 刘锐锋, 孙世龙, 刘小锋, 祁月潇, 董玉梅, 魏玺仪, 宋海侠, 郭丽云, 徐丽君, 王小虎
- Luo Hongtao, Wei Shihong, Kang Zhenchao, Liu Ruifeng, Sun Shilong, Liu Xiaofeng, Qi Yuexiao, Dong Yumei, Wei Xiyi, Song Haixia, Guo Liyun, Xu Lijun, Wang Xiaohu
- 后程加速超分割放疗联合奈达铂治疗老年食管癌的临床观察
- Clinical observation of late course accelerated hyperfractionated radiotherapy combined with nedaplatin chemotherapy for elderly patients with esophageal cancer
- 实用肿瘤杂志, 2019, 34(6): 513-519
- Journal of Practical Oncology, 2019, 34(6): 513-519
基金项目
- 甘肃省科技支撑计划-社会发展类项目(1604FKCA109);兰州市人才创新创业项目(2017-RC-23)
-
作者简介
- 罗宏涛(1980-), 男, 甘肃定西人, 副主任医师, 博士生, 从事胸部肿瘤放化疗临床研究.
-
通信作者
- 王小虎, E-mail:fangliaocentre@163.com
-
文章历史
- 收稿日期:2018-11-16
2. 甘肃省肿瘤医院放疗科, 甘肃 兰州 730050;
3. 武威市凉州医院放疗科, 甘肃 武威 733000
2. Department of Radiotherapy, Gansu Tumor Hospital, Lanzhou 730050, China;
3. Department of Radiotherapy, Liangzhou Hospital, Wuwei 733000, China
食管癌(esophageal cancer)的发生与年龄呈正相关,随着我国城乡居民人均寿命的延长,老年食管癌的发病率呈逐年上升的趋势[1-2]。由于以往研究通常将≥70岁的患者列在排除的范围,因此,老年食管癌患者的治疗尚缺乏循证医学证据的支持[3]。实际临床工作中,这部分患者由于麻醉意外风险增加和(或)伴发内科疾病而往往无法行手术治疗,常选择放疗作为其治疗手段[4-5],但常规分割放疗受局部未控率和局部复发率高等因素的影响,对食管癌的疗效一直难以提高[6-7]。为此,笔者采用后程加速超分割放疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy, LCAHRT+C)治疗老年食管癌,临床效果较好,现报道如下。
1 资料与方法 1.1 一般资料收集2013年10月至2016年5月在甘肃省肿瘤医院(38例)和武威市凉州医院(8例)初治的食管鳞癌患者46例。纳入标准:经组织学病理证实为食管鳞癌的初治患者;年龄70~85岁;卡氏评分≥70分;至少能进流质饮食;预期生存期>6个月;食管病灶长度≤10 cm;无实质脏器转移;无食管穿孔征象;入组前血常规以及心脏、肝脏和肾脏等脏器功能评估可耐受临床治疗。排除标准:行手术切除或探查术后患者;8周内接受过化疗或放疗;食管完全梗阻不能进食流质饮食;食管有深溃疡、穿孔或呕血;伴有严重且控制不良的内科疾病,如高血压、糖尿病和慢性阻塞性肺疾病等;正在使用其他试验药物或参加其他临床试验的患者;有不可控制的癫痫发作或因精神病丧失自知能力者;研究者认为不宜参加本试验者。
按照随机数字表法将入组患者分为单纯LCAHRT组(n=23)和LCAHRT+C组(n=23)。LCAHRT组患者采用影像引导调强适形精确放疗治疗。LCAHRT+C组在放疗基础上行同步单药奈达铂周化疗。本研究分别在甘肃省肿瘤医院及武威市凉州医院伦理委员会备案,患者入组前均已签署知情同意书。两组患者基线情况具有可比性(表 1)。
| 临床特征 | LCAHRT+C组 (n=23) |
LCAHRT组 (n=23) |
χ2值 | P值 |
| 性别 | 0.890 | 0.345 | ||
| 男 | 17(73.9) | 14(60.9) | ||
| 女 | 6 (26.1) | 9 (39.1) | ||
| 年龄(中位值,范围,岁) | 74(70~85) | 75(70~82) | 0.037 | 0.841 |
| 病变部位 | 3.429 | 0.180 | ||
| 食管颈段及上段 | 6(26.1) | 8(34.8) | ||
| 食管中段 | 12(52.2) | 6(26.1) | ||
| 食管下段 | 5(21.7) | 9(39.1) | ||
| 病变长度 | 0.840 | 0.359 | ||
| < 5 cm | 7(30.4) | 10(43.5) | ||
| >5 cm | 16(69.6) | 13(56.5) | ||
| 临床分期* | 0.377 | 0.828 | ||
| Ⅰ期 | 4(17.4) | 3(13.0) | ||
| Ⅱ期 | 6(26.1) | 5(21.7) | ||
| Ⅲ期 | 13(56.5) | 15(65.2) | ||
| 组织学分级 | 0.989 | 0.610 | ||
| 高分化 | 5(21.7) | 8(34.8) | ||
| 中分化 | 14(60.9) | 12(5.2) | ||
| 低分化 | 4(17.4) | 3(13.0) | ||
| 基础疾病 | 0.383 | 0.536 | ||
| 有 | 16(69.6) | 14(60.9) | ||
| 无 | 7(30.4) | 9(39.1) | ||
| *临床分期采用中国非手术治疗食管癌临床分期专家小组提出的食管癌非手术分期标准[8] | ||||
采用影像引导调强适形放疗技术;6 MV-X线;CT模拟定位使用热塑体膜或头颈肩膜固定装置,CT扫描范围从环状软骨到膈肌以下,建议使用静脉造影剂(对确有使用造影剂禁忌者行CT平扫),扫描层厚5 mm。勾画靶区时参照MRI或PET-CT确定肿瘤靶区(gross target volume, GTV)或转移淋巴结靶区(gross target volume node, GTVnd)。按照ICRU62号报告[9]确定靶区,GTV包括所有通过CT、PET-CT、食管造影片和食管镜等检查发现的食管肿瘤。转移淋巴结的定义(≥1项):PET-CT阳性;CT影像上短径≥1 cm(气管食管淋巴结短径≥0.5 cm);穿刺证实为转移者。临床靶区(clinical target volume, CTV)包括GTV头脚方向外放3 cm,前后左右外放0.5 cm,勾画时注意避开椎体和心、肺脏器。计划靶区(plan target volume, PTV):CTV四周或上下均外放0.5 cm。前程GTV 2.0 Gy/F,处方剂量(dose of tumor, DT)40 Gy/20 F;CTV 1.8 Gy/F,总DT 36 Gy/20 F;后程改加速超分割2 F/d,2次间隔>6 h,GTV 1.5 Gy/F,总DT 18 Gy/12 F,CTV 1.2 Gy/F,总DT 14.4 Gy/12 F。将前后程计划融合,结合剂量体积直方图和靶区云图评价计划,要求处方剂量覆盖95%的GTV体积,同时GTV体积内不得存在≥110%的剂量热点,双肺平均剂量 < 14 Gy,V20 < 28%,V30 < 20%;心脏V40 < 30%;脊髓最大点剂量 < 40 Gy。
1.2.2 化疗周化疗药物采用奈达铂(先声药业,11-180507,规格10 mg)每周1次,40 mg/m2,药物最终剂量按实际计算量的70%给予;并给予止吐和保肝支持治疗。
1.2.3 不良反应处理治疗期间出现放射性食管炎者给予药物减轻黏膜水肿/糜烂对症治疗,疼痛影响进食者给予鼻饲饮食。>2级骨髓抑制者给予相应药物对症治疗。当出现>3级心、肺和>4级血液系统毒性时,暂停治疗。
1.3 观察指标及评价标准 1.3.1 观察指标主要观察指标为临床有效性及治疗相关不良反应发生率。次要观察指标是生存率及死亡原因。
1.3.2 评价标准近期疗效依据国内万钧教授提出的食管癌近期疗效评定标准评价为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)或疾病进展(progressive disease, PD)[10]。不良反应评估采用美国放射治疗肿瘤协作组(Radiation Therapy Oncology Group, RTOG)放射损伤分级标准进行评价[11]。
1.4 随访末次随访时间2018年9月1日,随访7~47个月,中位随访时间23个月,采用患者到医院复诊和电话随访方式,记录患者局部复发、远处转移时间,生存状态,死亡原因。两组各有1例失访,全组随访率95.7%。
1.5 统计学分析采用SPSS 21.0软件进行数据分析。计数资料组间比较采用χ2检验。计量资料采用非参数检验。生存分析采用Kaplan-Meier法和Log-rank检验。局部控制率采用Breslow检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 治疗情况LCAHRT组1例患者放疗剂量46 Gy时出现前胸后背疼痛,复查食管钡餐显示食管壁溃疡,存在穿孔风险,停止放疗,其余22例完成预定治疗计划。LCAHRT+C组2例患者分别在放疗剂量38 Gy和49 Gy时食管钡餐造影提示存在穿孔风险,中止治疗;2例患者出现3级粒细胞降低不良反应,完成3次周化疗,其余19例均完成预定化疗计划。
2.2 近期疗效治疗结束后3个月, 根据查体、食管造影片及CT检查进行疗效评价。LCAHRT+C组与LCAHRT组CR率分别为60.9%(14/23)和30.4%(7/23),两组比较,差异具有统计学意义(χ2=4.293, P=0.038)。两组总有效率(CR+PR)分别为87.0%(20/23)和60.9%(14/23), 差异具有统计学意义(χ2=4.059, P=0.044,表 2)。
| 近期疗效 | LCAHRT+C组 (n=23) |
LCAHRT组 (n=23) |
χ2值 | P值 |
| CR | 14(60.9) | 7(30.4) | 4.293 | 0.038 |
| PR | 6(26.1) | 7(30.4) | 0.107 | 0.743 |
| SD | 2(8.7) | 6(26.1) | 2.421 | 0.120 |
| PD | 1(4.3) | 3(13.0) | 1.095 | 0.295 |
| 总有效率 | 20(87.0) | 14(60.9) | 4.059 | 0.044 |
| 注 LCAHRT+C:后程加速超分割放射治疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy);LCAHRT:后程加速超分割放射治疗(late course accelerated hyperfractionated radiotherapy);CR:完全缓解(complete response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease) | ||||
LCAHRT+C组恶心/呕吐、放射性食管炎以及治疗后期体质量下降不良反应发生率高于LCAHRT组(均P < 0.05, 表 3)。
| 不良反应 | LCAHRT+C组 (n=23) |
LCAHRT组 (n=23) |
χ2值 | P值 |
| 恶心/呕吐 | 9.665 | 0.022 | ||
| 1级 | 4(17.4) | 14(60.9) | ||
| 2级 | 15(65.2) | 7(30.4) | ||
| 3级 | 3(13.0) | 2(8.7) | ||
| 4级 | 1(4.3) | 0(0.0) | ||
| 5级 | 0(0.0) | 0(0.0) | ||
| 食管炎 | 9.218 | 0.027 | ||
| 1级 | 8(34.8) | 18(78.3) | ||
| 2级 | 10(43.5) | 4(17.4) | ||
| 3级 | 4(17.4) | 1(4.3) | ||
| 4级 | 1(4.3) | 0(0.0) | ||
| 5级 | 0(0.0) | 0(0.0) | ||
| 食管穿孔/出血 | 2(8.7) | 1(4.3) | 0.357 | 0.550 |
| 放射性肺炎 | 2.711 | 0.607 | ||
| 1级 | 7(30.4) | 3(13.0) | ||
| 2级 | 8(34.8) | 12(53.25) | ||
| 3级 | 5(21.7) | 4(17.4) | ||
| 4级 | 2(8.7) | 3(13.0) | ||
| 5级 | 1(4.35) | 1(4.3) | ||
| 心律失常 | 3.023 | 0.221 | ||
| 1级 | 21(91.3) | 22(95.7) | ||
| 2级 | 2(8.7) | 0(0.0) | ||
| 3级 | 0(0.0) | 1(4.3) | ||
| 4级 | 0(0.0) | 0(0.0) | ||
| 5级 | 0(0.0) | 0(0.0) | ||
| 骨髓抑制 | 5.582 | 0.134 | ||
| 1级 | 3(13.0) | 9(39.1) | ||
| 2级 | 12(52.3) | 10(43.5) | ||
| 3级 | 6(26.1) | 4(17.4) | ||
| 4级 | 2(8.7) | 0(0.0) | ||
| 5级 | 0(0.0) | 0(0.0) | ||
| 体质量下降 | 6.348 | 0.042 | ||
| 1级 | 3(13.0) | 10(43.5) | ||
| 2级 | 7(30.4) | 7(30.4) | ||
| 3级 | 13(56.5) | 6(26.1) | ||
| 4级 | 0(0.0) | 0(0.0) | ||
| 5级 | 0(0.0) | 0(0.0) | ||
| 注 LCAHRT+C:后程加速超分割放射治疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy);LCAHRT:后程加速超分割放射治疗(late course accelerated hyperfractionated radiotherapy) | ||||
LCAHRT+C组与LCAHRT组中位局部控制时间分别为(23.5±10.2)个月和(18.0±10.6)个月(Z=4.022, P < 0.01);1、2和3年局部控制率分别为73.9%、60.8%、38.8%和56.2%、39.1%、17.4%(χ2=3.957, P=0.047);中位生存时间分别为(25.6±9.3)个月和(19.6±10.2)个月(Z=1.836, P=0.066);1、2和3年生存率分别为82.6%、60.9%、39.1%和65.2%、34.8%、21.7%(χ2=3.430, P=0.064;图 1~2)。
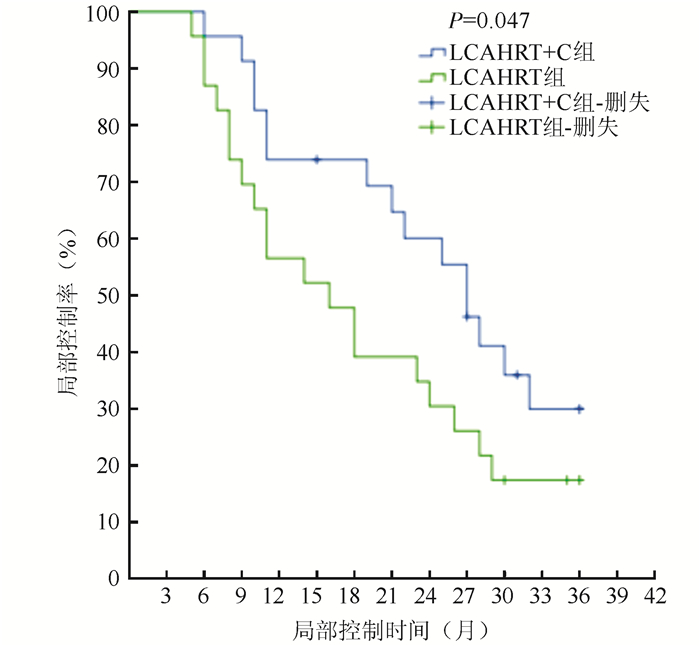
|
| 注 LCAHRT + C:后程加速超分割放射治疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy); LCAHRT:后程加速超分割放射治疗(late course accelerated hyperfractionated radiotherapy) 图 1 LCAHRT+C和LCAHRT组局部控制曲线分析 Fig.1 Local control curves of the LCAHRT+C and LCAHRT groups |
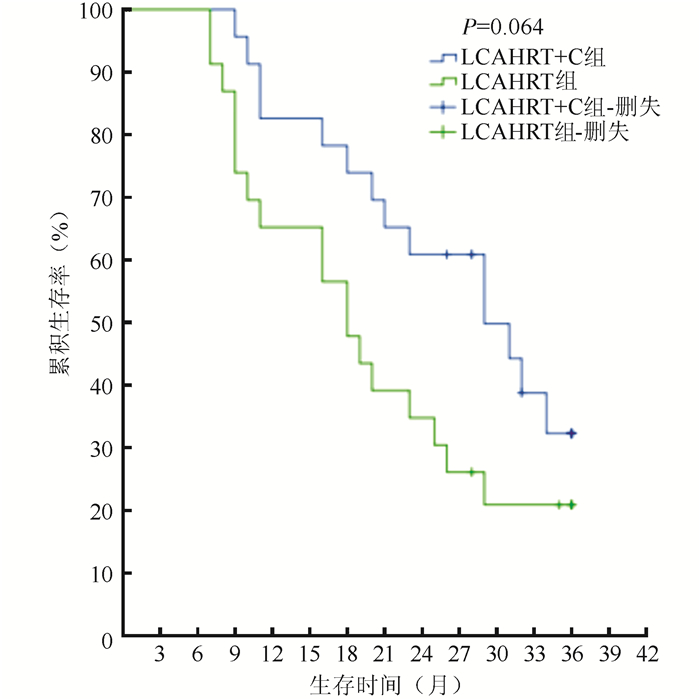
|
| 注 LCAHRT + C:后程加速超分割放射治疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy); LCAHRT:后程加速超分割放射治疗(late course accelerated hyperfractionated radiotherapy) 图 2 LCAHRT+C和LCAHRT组生存曲线分析 Fig.2 Overall survival curves of the LCAHRT+C and LCAHRT groups |
全组共死亡32例,肿瘤局部复发进展为LCAHRT组的主要死亡原因,相关病死率高于LCAHRT+C组(χ2=5.707,P=0.017)。治疗相关不良反应所致的病死率LCAHRT+C组高于LCAHRT组(χ2=4.134,P=0.042)。两组远处转移所致的病死率比较,差异无统计学意义(P>0.05),非肿瘤性疾病也是死因之一(表 4)。
| 死亡原因 | LACHRT+C组 (n=14) |
LACHRT组 (n=18) |
χ2值 | P值 |
| 肿瘤进展 | 4(28.6) | 12(66.7) | 5.707 | 0.017 |
| 远处转移 | 6(42.9) | 9(50.0) | 0.538 | 0.463 |
| 治疗不良反应 | 8(57.1) | 3(16.7) | 4.134 | 0.042 |
| 非肿瘤性疾病 | 5(35.7) | 4(22.2) | 0.334 | 0.563 |
| 注 LCAHRT+C:后程加速超分割放射治疗同步化疗(late course accelerated hyperfractionated radiotherapy plus concurrent chemotherapy);LCAHRT:后程加速超分割放射治疗(late course accelerated hyperfractionated radiotherapy) | ||||
食管鳞癌正随着老龄化社会的到来以及居民平均寿命的提高,逐渐成为威胁我国老年人群健康的常见恶性肿瘤之一[1]。老年食管癌患者由于发病时多伴发高血压和糖尿病等内科疾病而无法耐受手术治疗,而且食管鳞癌对手术之外的其他抗肿瘤治疗手段相对抗拒,使其成为临床治疗的难点[2]。
放疗是局部晚期和不可手术食管癌的最佳局部治疗手段,同期配合化疗,可提高放疗获益[12-13]。对老年患者更是避免麻醉意外和术后感染等风险[5, 7]。吕博等[14]回顾性分析53例≥70岁不能手术的食管鳞癌老年患者;29例采用单纯放疗,24例同期放化疗,全组1、2、3和5年生存率分别为62%、44%、33%和19%;≥2级急性放射性食管炎发生率为6%,2~3级放射性肺炎发生率9%,无≥4级放射性损伤出现。Zhao等[15]比较>75岁局部晚期食管癌患者根治性放化疗(n=52)与单纯放疗(n=70)疗效,根治性放化疗组行≥2个周期铂类+氟尿嘧啶化疗,放疗患者总剂量为54~66 Gy,常规分割;根治性放化疗组的无进展生存时间、总生存时间及2年生存率均优于单纯放疗组,但根治性放化疗组的急性不良反应(特别是Ⅲ~Ⅳ级急性不良反应)发生率高于单纯放疗组。
食管癌常规分割放疗5年生存率多年来未见提高, 失败的主要原因为局部肿瘤的残留及短期内局部复发。上世纪末及本世纪初国内临床广泛探索的后程加速超分割放疗,部分研究显示,局部控制率提高至50%~65%,5年生存率约为25%~34%,不良反应虽较常规放疗增加,但多能耐受[16-17]。许明君等[18]对46例采用后程加速超分割放疗联合TP同期化疗(后超组)或常规分割放疗联合TP同期化疗(对照组)的食管癌患者进行回顾性比较显示,后超组较对照组有提高局部控制率和远期生存率的趋势,不良反应较常规分割放疗有所增加,但可耐受。
老年肿瘤患者往往由于肝、肾功能减退,无法耐受两药联合化疗方案,临床上多采用铂类单药周化疗。由于顺铂具有明显的消化道症状以及肾毒性,常因其不良反应而延长放疗疗程或影响治疗计划的完成。奈达铂是第二代铂类抗肿瘤制剂,主要通过抑制DNA的复制达到抗肿瘤作用,与顺铂的抗癌作用机制相同,临床研究显示两者疗效相同,但其胃肠道毒性及肾毒性均减少[19]。岳亚军等[20]采用每周低剂量奈达铂同步放疗治疗老年性局部中晚期食管癌。结果显示,同步放化疗组总有效率(83.3%)、2年生存率(43.3%)和3年生存率(36.7%)均高于单纯放疗组,且3年中两组患者死亡原因构成比无差异,显示低剂量奈达铂与放疗具有较好的协同作用,治疗老年性局部中晚期食管癌有显著效果,可提高生存率。
以往临床研究在制定纳入和排除标准时常排除>70岁患者,因此目前临床上尚无后程加速超分割放疗治疗老年食管癌患者的疗效及安全性数据可供参考。本研究采用影像引导调强适形后程加速超分割放疗治疗老年食管癌患者,LCAHRT组和LCAHRT+C组在近期总有效率、1~3年局部控制率和1~3年生存率方面与鲁广等[21]报道相似,甚至生存率略有增加,这可能得益于研究中均采用影像引导的调强适形放疗,保证放疗靶区的精确照射。本研究显示,LCAHRT+C组近期有效率达87.0%,优于LCAHRT组的60.9%(P=0.044);1、2和3年局部控制率也高于LCAHRT组(P=0.047)。死因分析也显示同步放化疗对患者带来获益,肿瘤进展导致患者死亡的比例低于LCAHRT组(P=0.017)。LCAHRT+C组1、2和3年生存率略高于LCAHRT组,但差异无统计学意义(P=0.064),考虑是由于多数患者伴有不同程度基础疾病,死因分析显示,非肿瘤性死亡在两组分别占21.7%和17.4%。同步化疗增加恶心/呕吐胃肠道反应及食管黏膜炎性反应,患者治疗期间由于进食不适而减少进食量,导致体质量下降较单纯放疗增加。
综上所述,影像引导调强适形后程加速超分割放疗同步奈达铂化疗治疗老年食管鳞癌,近期疗效肯定,不良反应可耐受,局部控制率较单纯放疗组提高;长期生存率有待进一步观察。
| [1] |
Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol, 2013, 19(34): 5598-5606. DOI:10.3748/wjg.v19.i34.5598 |
| [2] |
Arnold M, Soerjomataram I, Ferlay J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64(3): 381-387. DOI:10.1136/gutjnl-2014-308124 |
| [3] |
Balducci L. Studying cancer treatment in the elderly patient population[J]. Cancer Control, 2014, 21(3): 215-220. DOI:10.1177/107327481402100306 |
| [4] |
Sher DJ, Yan J, Day A, et al. Comparative effectiveness of primary radiotherapy versus surgery in elderly patients with locally advanced oropharyngeal squamous cell carcinoma[J]. Oral Oncol, 2019, 88: 18-26. DOI:10.1016/j.oraloncology.2018.11.004 |
| [5] |
周超, 杨海华, 周丽珍, 等. 局部晚期食管鳞癌新辅助同期放化疗患者生活质量与手术可行性研究[J]. 实用肿瘤杂志, 2018, 33(2): 139-145. |
| [6] |
沈文斌, 祝淑钗, 高红梅, 等. 可手术切除食管癌单纯三维适形放疗失败原因分析[J]. 中华放射肿瘤学杂志, 2013, 22(3): 205-208. DOI:10.3760/cma.j.issn.1004-4221.2013.03.009 |
| [7] |
孔雁, 高红梅. 食管癌放射治疗10年生存分析及不同治疗方式的疗效比较[J]. 肿瘤防治研究, 2015, 42(1): 56-61. DOI:10.3971/j.issn.1000-8578.2015.01.014 |
| [8] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.1004-4221.2010.03.001 |
| [9] |
Wambersie A, Landberg T.ICRU report 62: prescribing, recording and reporting photon beam therapy(supplement to ICRU report 50)[R].Washington: International Commission on Radiation Units and Measurements, Inc.1999: 1-7.
|
| [10] |
万钧, 肖爱勤, 高淑珍, 等. 食管癌放疗后近期疗效评价标准-附1000例分析[J]. 中华放射肿瘤学杂志, 1989, 3(4): 205-207. |
| [11] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 北京: 中国协和医科大学出社, 2008: 1350.
|
| [12] |
Deng W, Lin SH. Advances in radiotherapy for esophageal cancer[J]. Ann Transl Med, 2018, 6(4): 1-10. |
| [13] |
Sasaki K, Uchikado Y, Omoto I, et al. Neoadjuvant chemoradiotherapy with docetaxel, cisplatin, and 5-fluorouracil (DCF-RT) for locally advanced esophageal squamous cell carcinoma.[J]. Cancer Chemother Pharmacol, 2019, 83(3): 581-587. DOI:10.1007/s00280-018-03764-4 |
| [14] |
吕博, 陈赞, 李云海, 等. 老年食管鳞癌根治性放化疗疗效观察及预后分析[J]. 中国癌症杂志, 2015, 25(3): 217-221. DOI:10.3969/j.issn.1007-3639.2015.03.012 |
| [15] |
Zhao Q, Hu G, Xiao W, et al. Comparison of definitive chemoradiotherapy and radiotherapy alone in patients older than 75 years with locally advanced esophageal carcinoma:a retrospective cohort study[J]. Medicine(Baltimore), 2017, 96(35): e7920. |
| [16] |
陈敬彬, 孙健泳, 黄伟驹, 等. 后程加速超分割放疗联合同期化疗治疗食管癌的Ⅱ期临床试验[J]. 医疗装备, 2017, 30(8): 26-27. DOI:10.3969/j.issn.1002-2376.2017.08.019 |
| [17] |
王敏, 李基胜, 张汉雄, 等. 后程加速超分割三维适形放疗同步化疗治疗中晚期食管癌的临床研究[J]. 中国癌症防治杂志, 2016, 8(3): 250-253. |
| [18] |
许明君, 王钇力, 郭海亮, 等. 食管癌后程加速超分割放疗联合同期化疗的临床研究[J]. 实用肿瘤杂志, 2013, 28(4): 405-407. |
| [19] |
覃烨. 紫杉醇联合顺铂或奈达铂新辅助化疗治疗局部晚期子宫颈癌的近远期疗效观察[J]. 实用肿瘤杂志, 2013, 28(4): 414-416. |
| [20] |
岳亚军, 刘汉山, 蔡炜, 等. 每周低剂量奈达铂同步放化疗治疗老年性局部中晚期食管癌[J]. 实用肿瘤杂志, 2012, 27(2): 185-188. |
| [21] |
鲁广, 何美文, 张永伟. 老年食管癌患者化疗联合后程加速超分割放疗的疗效分析[J]. 中国癌症杂志, 2010, 20(4): 285-289. DOI:10.3969/j.issn.1007-3639.2010.04.010 |
 2019, Vol. 34
2019, Vol. 34


