文章信息
- 张丽, 王虹, 万毅新
- 以肺部阴影就诊的心脏恶性肿瘤二例并文献复习
- 实用肿瘤杂志, 2019, 34(5): 457-460
-
作者简介
- 张丽(1985-), 女, 甘肃会宁人, 主治医师, 硕士, 从事肺部肿瘤相关研究.
-
通信作者
- 万毅新, E-mail:gladgw@sohu.com
-
文章历史
- 收稿日期:2018-08-16
原发性心脏恶性肿瘤是一种临床罕见、恶性程度很高且预后很差的心脏肿瘤,确诊时多数已发生远处转移,多数病程在1年之内,肺是最常见的转移部位[1]。现将本院近期以双肺多发阴影入院、最终临床诊断为原发性心脏恶性肿瘤伴双肺转移的2例患者的临床特征报道如下。
1 病例资料病例1:患者男性,51岁,汉族,农民,主因间断胸闷、气短伴咳嗽半年于2017年12月20日就诊于兰州大学第二医院,门诊以肺部阴影收住呼吸科。患者于入院前半年无明显诱因出现胸闷、气短、咳嗽症状,并呈进行性加重,于入院前1个月出现咯血症状,半年内体质量减轻10 kg。患者既往体健,否认慢性病史、家族肿瘤病史及遗传病史。入院后2017年12月21日查肺癌肿瘤标志物正常,血沉14 mm/h,其余实验室指标无明显异常。胸部CT平扫示,双肺多发大小不等结节影,双侧胸腔积液、心包积液,纵隔淋巴结肿大。2017年12月22日超声心动图示,右心房右侧探及大小约6.1 cm×4.9 cm的略高回声,右心房受压(图 1)。2017年12月21日电子气管镜检查示,双上叶支气管弥漫性渗血,刷检脱落细胞未查见癌细胞。2017年12月24日PET/CT显像如图 2所示。行超声引导下经皮肺穿刺活检,病理检查提示,少量肺间质,伴纤维组织增生,部分组织坏死,坏死周边未见明确异型组织。建议患者再次活检或手术进一步明确病理。患者拒绝进一步诊治。根据患者临床表现及影像学检查结果,临床诊断为原发性心脏恶性肿瘤并双肺、心包和胸膜转移。患者已发生远处转移,建议患者行心脏肿瘤活检及进一步治疗,患者及其家属放弃进一步诊疗。随访患者至死亡,死亡原因为心力衰竭,总生存时间为15个月。
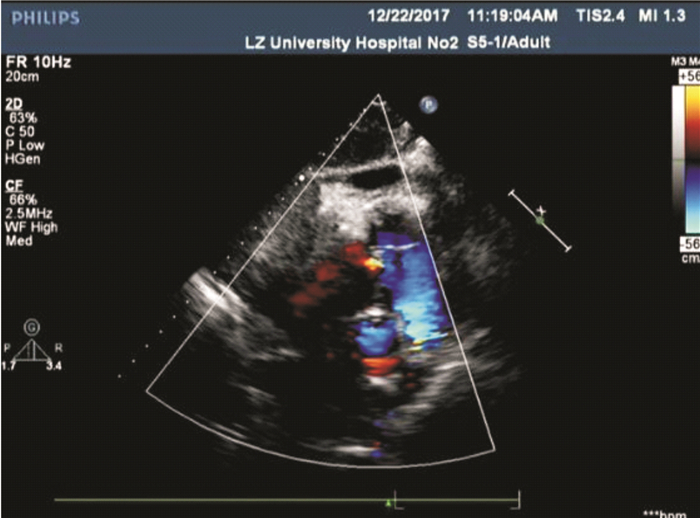
|
| 图 1 病例1超声心动图 |
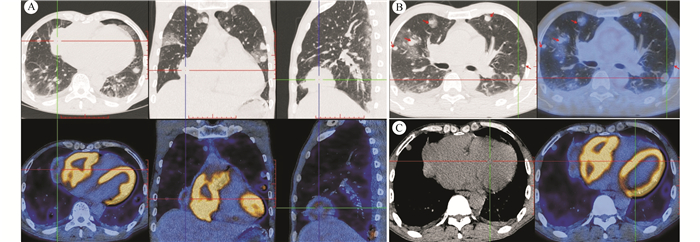
|
| 注 A:右心房旁软组织肿块,代谢异常增高,SUVmax=13.7;B:双肺多发大小不等结节,代谢不同程度增高,SUVmax=2.8~6.6;C:心包腔及双侧少量积液 图 2 病例1患者静脉注射18F-FDG静息60 min后PET/CT显像 |
病例2:患者男性,36岁,回族,中学教师,主因心悸和胸闷2个月、加重伴胸痛和咯血1周于2018年1月28日就诊于兰州大学第二医院,门诊以肺部阴影收住呼吸科。患者于入院前2个月无明显诱因出现心悸和胸闷,入院前1周出现胸痛、咯血和低热症状,2个月内体质量减轻6 kg。患者既往体健,否认慢性病史、家族肿瘤病史及遗传病史。入院后查肺癌肿瘤标志物正常,血沉35 mm/h,血红蛋白92 g/L,其余实验室指标无明显异常。胸部CT平扫示,双肺多发斑片样、结节样阴影,右心房密度不均,心包少量积液。2018年1月29日电子气管镜检查示,支气管黏膜急性炎性反应改变,支气管黏膜渗血(右上叶、左舌叶)。2018年2月14日超声心动图示,右心房探及大小约8.5 cm×8.3 cm的低回声团块,团块表面不平,基底较宽,右心房及右心室受压向心腔膨入(图 3)。2018年2月13日PET/CT显像如图 4所示。行超声引导下经皮肺穿刺活检,病理检查提示,少量肺间质,伴纤维组织增生,部分组织坏死,坏死周边未见明确异型组织。建议患者再次活检或手术进一步明确病理,患者拒绝进一步诊治。根据患者临床表现及影像学检查结果,临床诊断为原发性心脏恶性肿瘤并双肺、心包、胸膜和骨转移。患者已发生远处转移,建议患者行心脏肿瘤活检及进一步治疗,患者及其家属放弃进一步诊疗。随访患者至死亡,死亡原因为大咯血窒息,总生存时间为4.8个月。
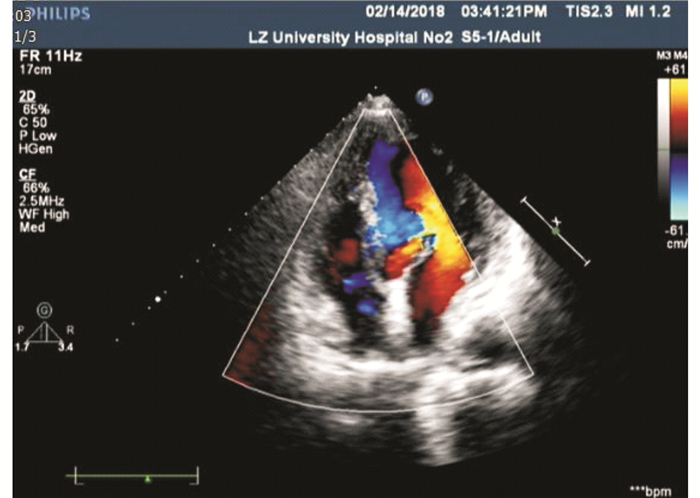
|
| 图 3 病例2超声心动图 |
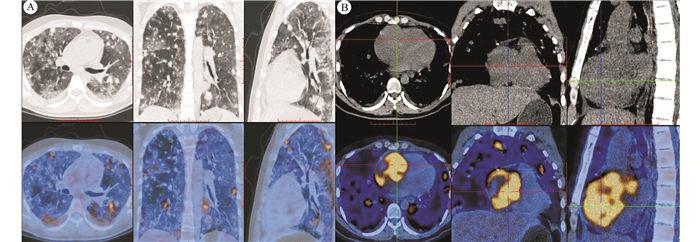
|
| 注 A:双肺多发不等大小结节影及磨玻璃影,代谢不同程度增高,SUVmax=2.8~9.6,多考虑转移瘤合并肺出血;B:右心房增大,代谢不均匀团块状增高,早期相SUVmax=13.2,延迟显像SUVmax=16.6,滞留指数26% 图 4 病例2静脉注射18F-FDG静息60 min后PET/CT显像 |
心脏肿瘤包括原发性心脏肿瘤和转移性心脏肿瘤,而原发性心脏肿瘤是较少见的肿瘤,发病率为0.002%~0.300%[2],其中恶性肿瘤占25%。研究证实,肉瘤是最常见的原发性心脏恶性肿瘤[3],包括血管肉瘤、横纹肌肉瘤、纤维肉瘤、平滑肌肉瘤和脂肪肉瘤等。其他罕见的还有淋巴瘤(多数为非霍奇金淋巴瘤)、恶性间叶瘤、恶性间皮瘤和恶性纤维组织细胞瘤。转移性心脏肿瘤占所有心脏肿瘤的15.8%[4],如黑色素瘤、肺癌、结肠癌、肾癌以及子宫起源的肉瘤。原发性心脏肉瘤占所有心脏肿瘤的15%~35%[5],其中儿童以横纹肌肉瘤多见,而血管肉瘤多发生于30~50岁的成人,男女比例为(2~3) :1[6]。心房是心脏血管肉瘤最好发部位,并多累及心包。据报道,89%的心脏血管肉瘤起源于右心房[7],常伴心包积液,约半数患者病程后期表现为心包填塞,肿瘤多起自右心房侧壁,房间隔受累常见。原发性血管肉瘤患者的早期症状及体征表现不明显,且无特异性,明显临床表现出现较晚,66%~89%的患者初次就诊时已发生转移,最常见的转移部位包括肺、纵隔淋巴结和脊椎[1]。复习以上文献,综合判断本次报道的2例患者临床表现及影像学特征更符合心脏原发性血管肉瘤的特点。
原发性心脏恶性肿瘤患者的临床表现取决于肿瘤的位置、大小、局部浸润及有无远处转移。主要症状表现为心肺相关症状,而呼吸困难是最常见的症状[8]。常见症状还包括肿瘤侵犯心包所致心包积液或心包填塞引起胸闷和气短等症状;肿瘤侵犯心脏瓣膜及大血管出入口所致的进行性和顽固性心力衰竭;肿瘤脱落所致栓塞相关症状;肿瘤累及窦房结、房室传导系统及心肌所致恶性心律失常;远处转移所致多器官症状,如转移至肺则可出现咳嗽、咯血和气短等症状。
原发性心脏恶性肿瘤的临床症状和体征无特异性,影像学检查是主要的检出手段。而心外继发性改变尤其要受到重视,恶性肿瘤比良性肿瘤有更多且严重的心外继发改变,包括肺血改变、肺部结节、单侧或双侧胸腔积液、纵隔淋巴结肿大、肋骨及椎骨密度异常可以是恶性肿瘤的唯一阳性征象[9]。因此,对于临床症状明显,高度怀疑心脏恶性肿瘤的患者不管其胸部胸片及胸部CT结果如何,进行进一步影像学检查是必须的,诊断需采用多种方法联合,而在本病诊断中起着核心作用的是临床医师对该病的基本认识[10]。
研究证实,超声心动图是首选的影像学检查方法[11],可以明确肿瘤与心内结构的关系,经胸超声心动图与经食管超声心动图的敏感度分别为93%和97%[12],但其空间分辨力和软组织分辨力较低,而检查准确性受限于操作者经验,对肿瘤侵犯程度及纵隔、心外转移等方面的评价与诊断存在一定局限性。
CT成像快速,空间分辨力高,对钙化敏感,可明确肿瘤与纵隔、大血管的关系,但是通过CT平扫发现肿瘤较困难,需结合增强扫描,在心脏肿瘤的诊断中受到限制。心脏MRI是心脏肿瘤诊断的最佳影像学方法之一[13],其组织特异性好,可对心脏超声结果进行重要的补充,并提供原发肿瘤的细节信息及其与毗邻器官组织(如纵隔、肺和膈肌等)的解剖关系。结合心脏一站式成像,能进行心功能分析、心肌灌注及心肌活性的检查。有些情况下还能对肿瘤进行进一步定性诊断,具有更大的诊断优势。PET/CT的特点为扫描时间短,能克服心脏的运动伪影,缺点是价格较高,临床应用受到一定限制,PET/CT检查对诊断困难的肿瘤及肿瘤分期有更重要的临床意义。PET/CT及MRI可以提高心脏肿块的非侵入性诊断率和随访率[14]。对于此2例患者均未行心脏MRI检查而率先行PET/CT检查的原因如下:病例1超声心动图提示右房右侧略高回声,从而判断肿瘤原发病灶在心脏,为进一步评估肿瘤性质及有无远处转移,遂行PET/CT检查;病例2胸部CT平扫未发现心脏肿块,而双肺多发阴影有转移性肿瘤的可能性,行PET/CT检查的目的在于寻找肺部多发阴影的病因。2例患者PET/CT结果均提示,右心房不规则不均质肿块,代谢增高,并累及心包致心包积液,延迟显像滞留指数明显增高,与相关报道结果一致[15]。结合PET/CT分析此2例患者的心脏肿块及全身情况,提示双肺多发阴影可能为原发性心脏恶性肿瘤所致的双肺多发转移病灶。
影像学检查为诊断提供重要支持,而确诊须依赖病理检查。本文2例患者气管镜刷检及经皮肺穿刺活检均未取得阳性病理结果,原因考虑为2例患者的肺转移病灶均为多发且较小的周围型病灶,气管镜下无可视病灶,气管镜下活检可行性低。此外,从影像学及气管镜检查结果分析2例患者的肺部多发病灶均伴有不同程度的出血,而非完全的实性组织,导致经皮穿刺阳性率减低。此类患者明确诊断的最佳方法为心脏原发病灶的穿刺活检或手术活检。针对肺部较大的周围型病灶也可尝试支气管超声导向鞘(endobronchial ultrasonography with a guide sheath, EBUS-GS)引导下的经支气管肺活检术(transbronchus lung biopsy, TBLB),但2例患者均有不同程度的支气管出血,经支气管肺活检术出血风险较大,不建议行TBLB。
目前,心脏恶性肿瘤尚无理想治疗方法,一般认为多种方法联合优于单一方法,多数学者推荐手术切除联合放化疗的综合治疗法[16]。心脏恶性肿瘤一旦明确诊断,若无远处转移,原则上应尽早手术切除肿瘤。这不仅能缓解心脏肿瘤所致的循环阻塞症状,也可为术后放疗和化疗及提高远期生存率创造条件。如遇瘤体基底宽大,呈浸润性生长而累及大量心肌组织时,只能切除大部分肿瘤,以解除血流梗阻、消除症状,必要时可电刀灼烧肿瘤基底部,术后酌情给予化疗和放疗。研究显示,通过仔细规划的手术治疗和多种方法的联合治疗,包括辅助化疗和放疗,可以改善患者预后[17]。另有研究显示,接受心脏移植的心脏血管肉瘤患者与接受姑息疗法的患者的平均生存时间没有差异,新辅助化疗或辅助化疗在心脏移植后并没有延长患者生存期[18]。
总之,原发性心脏恶性肿瘤虽罕见,但任何年龄均可发生,诊断困难,多因其他部位的转移病灶而确诊,无特异性治疗方法,预后差。常见的影像学检查各具特点。超声心动图是心脏恶性肿瘤的首选检查方法,MRI及PET/CT可以对超声结果进行重要补充,包括进一步准确定位、明确与周围组织的毗邻关系及全身转移情况等。确诊依赖于病理检查。提高对本病临床及影像学表现的认识,有助于早期发现及改善预后。
| [1] |
Shapiro S, Scott J, Kaufman K. Metastatic cardiac angiosarcoma of the cervical spine. Case report[J]. Spine(Phila Pa 1976), 1999, 24(11): 1156-1158. DOI:10.1097/00007632-199906010-00018 |
| [2] |
Lam KY, Dickens P, Chan AC. Tumors of the heart.A 20-year experience with a review of 12, 485 consecutive autopsies[J]. Arch Pathol Lab Med, 1993, 117(10): 1027-1031. |
| [3] |
Barreiro M, Renilla A, Jimenez JM, et al. Primary cardiac tumors:32 years of experience from a Spanish tertiary surgical center[J]. Cardiovasc Pathol, 2013, 22(6): 424-427. DOI:10.1016/j.carpath.2013.04.006 |
| [4] |
Burazor I, Aviel-Ronen S, Imazio M, et al. Metastatic cardiac tumors:from clinical presentation through diagnosis to treatment[J]. BMC Cancer, 2018, 18(1): 202-234. DOI:10.1186/s12885-018-4070-x |
| [5] |
Randhawa JS, Budd GT, Randhawa M, et al. Primary cardiac sarcoma:25-year cleveland clinic experience[J]. Am J Clin Oncol, 2016, 39(6): 593-599. DOI:10.1097/COC.0000000000000106 |
| [6] |
Reardon MJ, Walkes JC, Benjamin R. Therapy insight:malignant primary cardiac tumors[J]. Nat Clin Pract Cardiovasc Med, 2006, 3(10): 548-553. DOI:10.1038/ncpcardio0653 |
| [7] |
Bouma W, Lexis CP, Willems TP, et al. Successful surgical excision of primary right atrial angiosarcoma[J]. J Cardiothorac Surg, 2011, 6(9): 47-58. |
| [8] |
Burke A. Primary malignant cardiac tumors[J]. Sem Diagn Pathol, 2008, 25(1): 39-46. DOI:10.1053/j.semdp.2007.10.006 |
| [9] |
Burazor I, Aviel-Ronen S, Imazio M, et al. Primary malignancies of the heart and pericardium[J]. Clin Cardiol, 2014, 37(9): 582-588. |
| [10] |
赵世华, 蒋烈夫, 蒋世良, 等. 原发性非黏液瘤性心脏心包肿瘤影像学诊断(附30例手术病理对照)[J]. 中华放射学杂志, 2001, 35(1): 37-40. DOI:10.3760/j.issn:1005-1201.2001.01.012 |
| [11] |
Palaskas N, Thompson K, Gladish G, et al. Evaluation and management of cardiac tumors[J]. Curr Treat Options Cardiovasc Med, 2018, 20(4): 29-43. DOI:10.1007/s11936-018-0625-z |
| [12] |
Meng Q, Lai H, Lima J, et al. Echocardiographic and pathologic characteristics of primary cardiac tumors:a study of 149 cases[J]. Int J Cardiol, 2002, 84(1): 69-75. |
| [13] |
Jeong D, Patel A, Francois CJ, et al. Cardiac magnetic resonance imaging in oncology[J]. Cancer Control, 2017, 24(2): 147-160. DOI:10.1177/107327481702400207 |
| [14] |
Nensa F, Tezgah E, Poeppel TD, et al. Integrated 18F-FDG PET/MR imaging in the assessment of cardiac masses:a pilot study[J]. J Nucl Med, 2015, 56(2): 255-260. DOI:10.2967/jnumed.114.147744 |
| [15] |
Yi JE, Yoon HJ, O JH. Cardiac and pericardial F-FDG uptake on oncologic PET/CT:Comparison with echocardiographic findings[J]. J Cardiovasc Imaging, 2018, 26(2): 93-102. DOI:10.4250/jcvi.2018.26.e10 |
| [16] |
Reardon MJ, Walkes JC, Benjamin R. Therapy insight:malignant primary cardiac tumors[J]. Nat Clin Pract Cardiovasc Med, 2006, 3(10): 548-553. DOI:10.1038/ncpcardio0653 |
| [17] |
Nakamura-Horigome M, Koyama J, Eizawa T, et al. Successful treatment of primary cardiac angiosarcoma with docetaxel and radiotherapy[J]. Angiology, 2008, 59(3): 368-371. DOI:10.1177/0003319707308212 |
| [18] |
Li H, Yang S, Chen H, et al. Survival after heart transplantation for non-metastatic primary cardiac sarcoma[J]. J Cardiothorac Surg, 2016, 11(1): 145-151. DOI:10.1186/s13019-016-0540-x |
 2019, Vol. 34
2019, Vol. 34


