文章信息
- 林凌, 陈振岗, 史学军
- Lin Ling, Chen Zhengang, Shi Xuejun
- 预后营养指数对接受靶向治疗的晚期肺腺癌患者的预后评估研究
- Prognostic nutritional index in advanced lung adenocarcinoma patients receiving targeted therapy
- 实用肿瘤杂志, 2019, 34(5): 444-448
- Journal of Practical Oncology, 2019, 34(5): 444-448
-
作者简介
- 林凌(1979-), 女, 天津人, 副主任医师, 硕士, 从事肺癌的外科及靶向治疗.
-
通信作者
- 史学军, E-mail:drsxj888@sina.com
-
文章历史
- 收稿日期:2018-08-11
非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占肺癌的80%,肺腺癌是其主要的病理类型之一[1]。目前,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)由于其确切的疗效、轻微的不良反应和口服给药的便利等特点,突破传统化疗的瓶颈,已成为晚期NSCLC尤其是肺腺癌的重要治疗手段[2]。如何精准评估肺腺癌靶向治疗的疗效及预后具有重要的临床价值。近期研究显示,机体免疫及营养状态与肿瘤患者的远期预后密切相关[3]。预后营养指数(prognostic nutritional index,PNI)作为一项营养-免疫指标,目前已被证实可作为多种恶性肿瘤的预后指标,如食管癌、胃癌、直肠癌及胰腺癌等[4-6]。但国内外关于PNI用于肺癌治疗(尤其是靶向治疗)预后评估的相关研究甚少。本研究回顾性分析晚期肺腺癌临床资料,探讨PNI在评估晚期肺腺癌靶向治疗预后中的临床意义。
1 资料与方法 1.1 一般资料回顾性分析2013年1月至2017年1月天津市宝坻区人民医院收治的77例肺腺癌患者。纳入标准:(1)年龄≥18岁;(2)经组织学或细胞学确诊为腺癌,EGFR基因应用突变扩增系统(amplification refractory mutation system, ARMS)法检测证实为阳性;(3)根据UICC第7版[7]肺癌TNM分期为ⅢB~ Ⅳ期,有≥1个可测量的肿瘤病灶;(4)具有靶向治疗前1周内血清白蛋白及外周血淋巴细胞计数;(5)临床资料齐全且获得随访。排除标准:(1)存在血液系统或免疫系统疾病;(2)继发第二肿瘤者;(3)近期有输血者;(4)严重的心、肺、肝和肾功能异常者。
收集患者的临床病理资料,包括性别、年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分、吸烟史(累积吸烟>100支)、EGFR突变情况、临床分期、治疗方式、治疗前1周内的血常规、生化及肿瘤标志物指标等。计算PNI值,依据公式PNI=血清白蛋白(g/L)+5×外周血淋巴细胞计数(×109/L),Kolmogorov-Smirnov检验显示PNI值为正态分布(46.17±8.83,P=0.530)并将其分为低PNI组(< 46.17)和高PNI组(≥46.17)。
1.2 治疗方法所有患者均接受口服盐酸厄洛替尼(150 mg/次,1次/d)或盐酸埃克替尼(125 mg/次,3次/d)治疗,每4周为1个周期,直至出现肿瘤进展或不可耐受的不良反应。服药期间不能同时进行其他抗肿瘤治疗,但允许脑转移灶放疗。
1.3 疗效评价及随访进行≥2个周期治疗后评价疗效,根据实体瘤疗效评价标准(RECIST 1.1)[8]分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/例数×100%。
随访时间截止到2017年10月,根据电话或末次住院记录及门诊复查结果获取随访资料,无进展生存时间(progression free survival,PFS)指从靶向治疗开始至肿瘤进展或任何原因死亡之间的时间;总生存时间(overall survival,OS)指从靶向治疗开始至任何原因死亡或末次随访的时间。
1.4 统计学分析采用SPSS 20.0软件统计分析数据。计量资料采用均数±标准差(x±s)表示,组间比较采用两样本均数t检验。计数资料用频数(百分比)表示,组间比较采用Pearson χ2检验。生存分析采用Kaplan-Meier法及Log-rank检验。多因素分析采用Cox比例风险回归模型。以P<0.05为差异具有统计学意义。
2 结果 2.1 临床特征全组77例患者中,男性30例(39.0%),女性47例(61.0%),男女之比为0.64 :1。中位年龄为64岁(42~81岁),年龄 < 65岁者45例(58.4%)。吸烟26例(33.8%),吸烟史>30年11例,其中男性7例。ECOG PS评分≥2分者17例(22.1%)。临床分期ⅢB期13例(16.9%),Ⅳ期64例(83.1%)。EGFR突变情况:外显子19缺失(19del)有43例(55.8%),外显子21 L858R突变34例(44.2%)。接受EGFR-TKIs一线治疗42例,二线治疗32例,三线治疗3例。11例患者出现脑转移,其中10例接受全脑放疗或伽马刀治疗,1例接受手术治疗。初诊时血红蛋白降低43例(55.8%),癌胚抗原(carcinoembryonic antigen,CEA)水平升高48例(62.3%)。
2.2 PNI与晚期肺腺癌患者临床病理特征的关系根据PNI值,将77例患者分为低PNI组39例(50.6%)和高PNI组38例(49.4%)。两组在患者的年龄、PS评分和吸烟状况方面比较,差异均具有统计学意义(均P<0.05),而在性别、TNM分期、EGFR突变类型、淋巴结转移、脑转移、血红蛋白水平和CEA水平等方面比较,差异均无统计学意义(均P>0.05,表 1)。
| 临床特征 | 总例数 | 低PNI组 | 高PNI组 | χ2值 | P值 |
| 年龄 | 4.913 | 0.027 | |||
| <65岁 | 45(58.4) | 18(46.2) | 27(71.1) | ||
| ≥65岁 | 32(41.5) | 21(53.8) | 11(28.9) | ||
| 性别 | 0.312 | 0.577 | |||
| 男 | 30(39.0) | 14(35.9) | 16(42.1) | ||
| 女 | 47(61.0) | 25(64.1) | 22(57.9) | ||
| 吸烟状态 | 5.422 | 0.020 | |||
| 吸烟 | 26(33.8) | 18(46.2) | 10(21.1) | ||
| 不吸烟 | 51(66.2) | 21(53.8) | 28(78.9) | ||
| ECOG评分 | 5.819 | 0.016 | |||
| 0~1分 | 60(77.9) | 26(66.7) | 34(89.5) | ||
| ≥2分 | 17(22.1) | 13(33.3) | 4(10.5) | ||
| TNM分期 | |||||
| ⅢB期 | 13(16.9) | 6(15.4) | 7(18.4) | 0.126 | 0.722 |
| Ⅳ期 | 64(83.1) | 33(84.6) | 31(81.6) | ||
| EGFR突变 | 1.628 | 0.202 | |||
| 21号染色体 | 34(44.2) | 20(51.3) | 14(36.8) | ||
| 19号染色体 | 43(55.8) | 19(48.7) | 24(63.2) | ||
| 淋巴结转移 | 0.109 | 0.742 | |||
| 有 | 58(75.3) | 30(76.9) | 28(73.7) | ||
| 无 | 19(24.7) | 9(21.3) | 10(26.3) | ||
| 脑转移 | 0.866 | 0.352 | |||
| 有 | 11(14.3) | 7(17.9) | 4(10.5) | ||
| 无 | 66(85.7) | 32(82.1) | 34(89.5) | ||
| 治疗方式 | 0.111 | 0.739 | |||
| 一线治疗 | 42(54.5) | 22(56.4) | 20(52.6) | ||
| 二线及以上治疗 | 35(45.5) | 17(43.6) | 18(47.4) | ||
| TKI药物 | 0.160 | 0.689 | |||
| 厄洛替尼 | 26(33.8) | 14(35.9) | 12(31.6) | ||
| 埃克替尼 | 51(66.2) | 25(64.1) | 26(68.4) | ||
| 放疗 | 0.521 | 0.470 | |||
| 有 | 10(13.0) | 4(10.3) | 6(15.8) | ||
| 无 | 66(87.0) | 35(89.7) | 32(84.2) | ||
| CEA | 3.011 | 0.083 | |||
| <5.0 ng/mL | 29(37.7) | 11(28.2) | 18(47.4) | ||
| ≥5.0 ng/mL | 48(62.3) | 28(71.8) | 20(52.6) | ||
| 血红蛋白 | 3.754 | 0.053 | |||
| <110 g/L | 43(55.8) | 26(66.7) | 17(44.7) | ||
| ≥110 g/L | 34(44.2) | 13(33.3) | 21(55.3) | ||
| 注 PNI:预后营养指数(prognostic nutritional index,PNI);EGFR:表皮生长因子受体(epidermal growth factor receptor);TKI:酪氨酸激酶抑制剂(tyrosine kinase inhibitor);CEA:癌胚抗原(carcinoembryonic antigen) | |||||
所有患者均可评价近期疗效,其中CR 0例,PR 26例(33.7%),SD 30例(38.9%),PD 21例(27.3%),DCR为72.7%(56/77)。高PNI组患者DCR为82.6%(31/38),其中PR为42.1%(16/38);低PNI组患者DCR为64.1%(25/39),其中PR为25.6%(10/39);两组DCR比较,差异无统计学意义(χ2=2.964,P=0.085)。
2.4 生存分析截止随访日期,全组患者中位PFS为11.6个月(95%CI:10.2~12.9),中位OS为21.5个月(95%CI:19.3~25.5),1、2和3年OS分别为75.6%、46.4%和14.6%。高PNI组患者中位OS为25.7个月(95%CI:21.5~29.1),低PNI组患者中位OS为19.1个月(95%CI: 16.7~22.9),差异具有统计学意义(P=0.011,图 1)。
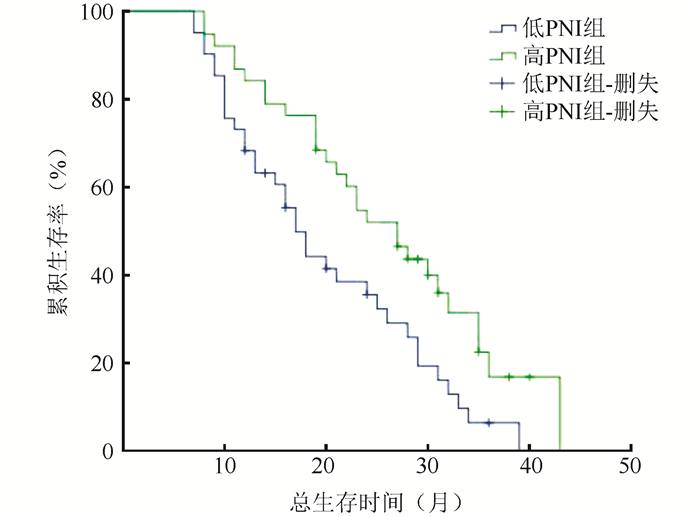
|
| 图 1 不同PNI水平患者总生存曲线 Fig.1 Overall survival curve of advanced lung adenocarcinoma patients with different PNI values |
单因素分析显示,患者PNI值、PS评分、吸烟史与预后相关(均P<0.05,表 2),将上述因素纳入Cox比例风险回归模型作多因素分析显示,PNI值和PS评分为独立预后不良因素(均P<0.05, 表 3)。
| 变量 | 3年生存率(%) | χ2值 | P值 |
| 年龄 | 2.129 | 0.145 | |
| <65岁 | 17.1 | ||
| ≥65岁 | 10.9 | ||
| 性别 | 0.156 | 0.694 | |
| 男 | 12.2 | ||
| 女 | 16.5 | ||
| 吸烟史 | 3.983 | 0.046 | |
| 吸烟 | 8.1 | ||
| 不吸烟 | 16.3 | ||
| ECOG PS评分 | 16.713 | < 0.01 | |
| 0~1分 | 15.2 | ||
| ≥2分 | 0.0 | ||
| TNM分期 | 1.021 | 0.312 | |
| ⅢB期 | 16.3 | ||
| Ⅳ期 | 13.6 | ||
| EGFR突变 | 0.588 | 0.402 | |
| 21号染色体 | 13.0 | ||
| 19号染色体 | 17.8 | ||
| 脑转移 | 0.915 | 0.339 | |
| 有 | 10.5 | ||
| 无 | 17.6 | ||
| 治疗方式 | 1.407 | 0.236 | |
| 一线治疗 | 18.2 | ||
| 二线及以上治疗 | 11.5 | ||
| TKI药物 | 0.670 | 0.553 | |
| 厄洛替尼 | 13.2 | ||
| 埃克替尼 | 16.3 | ||
| 放射治疗 | 0.844 | 0.358 | |
| 有 | 19.3 | ||
| 无 | 14.2 | ||
| CEA | 2.876 | 0.093 | |
| <5.0 ng/mL | 17.7 | ||
| ≥5.0 ng/mL | 11.4 | ||
| 血红蛋白 | 1.711 | 0.191 | |
| <110 g/L | 12.5 | ||
| ≥110 g/L | 16.3 | ||
| PNI值 | 7.148 | 0.011 | |
| <46.17 | 6.5 | ||
| ≥46.17 | 16.9 |
| 临床特征 | 回归系数 | Wald χ2 | HR(95% CI) | P值 |
| 有吸烟史 | 0.765 | 2.529 | 0.584(0.314~1.087) | 0.090 |
| ECOG PS≥2分 | 2.176 | 9.597 | 5.621(2.553~7.287) | < 0.01 |
| PNI值< 46.17 | 1.531 | 4.106 | 2.394(1.228~3.716) | 0.002 |
研究显示,恶性肿瘤患者营养不良的发生率高达40%~80%,约30%的肿瘤患者死于营养不良及其相关并发症,而非肿瘤本身[9]。PNI是Smale等[10]提出的,由血清白蛋白和外周血淋巴细胞数目计算得来,最初用于术前患者的营养状况和术后并发症的评估。血清蛋白是临床评估患者营养状态最常用的指标,其降低多提示营养不良和免疫功能下降。Cavallin等[11]发现,低蛋白血症可作为非小细胞肺癌术后早期复发和预后的独立影响因素。而外周血淋巴细胞是机体抗肿瘤重要的免疫细胞,且与淋巴瘤、肺癌和乳腺癌等多种肿瘤预后密切相关。作为一项反映患者营养-免疫状态的指标,PNI在评估肿瘤治疗疗效及预后方面的作用日益显现。
目前,探讨PNI与晚期NSCLC的相关研究较少。林晓明等[12]报道不同PNI水平与晚期NSCLC化疗后患者的年龄、是否吸烟和KPS评分有关,且为影响患者预后的独立因素。Mori等[13]也得到相似的结果。本研究纳入经EGFR-TKIs治疗后肺腺癌患者,结果显示,低PNI水平与患者的年龄、PS评分和吸烟史有关。PS评分是用于评估患者体质状况的指标,其分值越高,表明体质状况越差,相应地营养状况也较差。本研究还发现,不同PNI水平与患者EGFR基因突变情况无关(P>0.05),这与Sheng等[14]研究结果相似。此外Sheng等[14]指出,PNI降低与C反应蛋白升高密切相关,这说明PNI也可反映肿瘤患者的炎性反应状态。
近期疗效方面,高PNI组患者DCR为82.6%,低于高PNI组的64.1%,但差异无统计学意义(P>0.05)。这与Sheng等[14]不同,其研究表明高PNI水平肺腺癌患者靶向治疗近期有效率高于低PNI组,提示患者营养状态可能影响EGFR-TKIs靶向治疗的疗效。这可能与本研究样本量小有关。预后方面,本研究显示高PNI组患者中位OS高于低PNI组(25.7个月vs 19.1个月),且差异具有统计学意义(P=0.011);多因素分析显示PNI水平为影响该组患者的独立预后因素。而Park等[15]研究显示,高PNI组患者靶向治疗后中位OS高达28.5个月(26.2~31.5个月),高于本组研究结果,这可能与其入组患者一线治疗比例较高有关。此外,高惜惜等[16]也证实不同PNI水平在中晚期NSCLC患者铂类化疗后中的预后评估价值。因此,笔者认为不同PNI水平可为晚期NSCLC患者的预后评估提供一定参考。
综上所述,预后营养指数作为一项简易、便捷且有效的指标,反映机体营养免疫状态对肺癌患者靶向治疗预后的重要影响,值得临床推广应用。然而,本研究仅限于小样本单中心的回顾性分析,存在一定的选择偏倚,仍需进一步前瞻性多中心研究加以证实。
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-2388. DOI:10.1056/NEJMoa0909530 |
| [3] |
Bemeur C, Butterworth RF. Nutrition in the management of cirrhosis and its neurological complications[J]. J Clin Exp Hepatol, 2014, 4(2): 141-150. DOI:10.1016/j.jceh.2013.05.008 |
| [4] |
Ikeguchi M, Kouno Y, Kihara K, et al. Evaluation of prognostic markers for patients with curatively resected thoracic esophageal squamous cell carcinomas[J]. Mol Clin Oncol, 2016, 5(6): 767-772. DOI:10.3892/mco.2016.1073 |
| [5] |
Eo WK, Chang HJ, Suh J, et al. The prognostic nutritional index predicts survival and identifies aggressiveness of gastric cancer[J]. Nutr Cancer, 2015, 67(8): 1260-1267. |
| [6] |
Galizia G, Lieto E, Auricchio A, et al. Naples prognostic score, based on nutritional and inflammatory status, is an independent predictor of long-term outcome in patients undergoing surgery for colorectal cancer[J]. Dis Colon Rectum, 2017, 60(12): 1273-1284. DOI:10.1097/DCR.0000000000000961 |
| [7] |
Detterbeck FC, Boffa DJ, Tanoue LT. The new lung cancer staging system[J]. Chest, 2009, 136(1): 260-271. DOI:10.1378/chest.08-0978 |
| [8] |
Watanabe H, Okada M, Kaji Y, et al. New response evaluation criteria in solid tumours-revised RECIST guideline (version 1.1)[J]. Gan To Kagaku Ryoho, 2009, 36(13): 2495-2501. |
| [9] |
孙开宇, 何裕隆. 胃肠道恶性肿瘤患者预后营养指数的研究进展[J]. 消化肿瘤杂志:电子版, 2015, 7(2): 112-114. |
| [10] |
Smale BF, Mullen JL, Buzby GP, et al. The efficacy of nutritional assessment and support in cancer surgery[J]. Cancer, 1981, 47(10): 2375-2381. DOI:10.1002/1097-0142(19810515)47:10<2375::AID-CNCR2820471009>3.0.CO;2-I |
| [11] |
Cavallin F, Scarpa M, Cagol M, et al. Low perioperative serum prealbumin predicts early recurrence after curative pulmonary resection for non-small-cell lung cancer[J]. World J Surg, 2013, 37(8): 2005-2010. DOI:10.1007/s00268-013-1937-5 |
| [12] |
林晓明, 梁荣, 李淑慧, 等. 预后营养指数对非小细胞肺癌化疗患者的预后价值研究[J]. 中国医师杂志, 2017, 19(6): 876-878, 882. DOI:10.3760/cma.j.issn.1008-1372.2017.06.021 |
| [13] |
Mori S, Usami N, Fukumoto K, et al. The significance of the prognostic nutritional index in patients with completely resected non-small cell lung cancer[J]. PLoS One, 2015, 10(9): e136897. |
| [14] |
Sheng J, Yang YP, Ma YX, et al. Low prognostic nutritional index correlates with worse survival in patients with advanced NSCLC following EGFR-TKIs[J]. PLoS One, 2016, 11(1): e147226. |
| [15] |
Park S, Park S, Lee SH, et al. Nutritional status in the era of target therapy:poor nutrition is a prognostic factor in non-small cell lung cancer with activating epidermal growth factor receptor mutations[J]. Korean J Intern Med, 2016, 31(6): 1140-1149. DOI:10.3904/kjim.2015.062 |
| [16] |
高惜惜, 尤青海, 孙耕耘. 中性-淋巴比和预后营养指数与非小细胞肺癌患者预后的相关性研究[J]. 中华肺部疾病杂志:电子版, 2016, 9(2): 125-130. |
 2019, Vol. 34
2019, Vol. 34


