文章信息
- 于鹏途, 蒋葵
- Yu Pengtu, Jiang Kui
- 阿比特龙联合恩度对人激素敏感性前列腺癌细胞增殖及VEGF-A和PSA水平的影响
- Effect of abiraterone and Endostar on proliferation of human hormone-sensitive prostate cancer cells and levels of VEGF-A and PSA
- 实用肿瘤杂志, 2019, 34(5): 417-423
- Journal of Practical Oncology, 2019, 34(5): 417-423
-
作者简介
- 于鹏途(1990-), 男, 黑龙江鸡西人, 住院医师, 硕士, 从事泌尿生殖系统肿瘤基础与临床研究.
-
通信作者
- 蒋葵, E-mail:jk0411@163.com
-
文章历史
- 收稿日期:2018-06-30
前列腺癌是影响男性生命健康最常见的恶性肿瘤之一,是西方男性癌症相关死亡的第二大原因[1]。随着我国国民预期寿命增加等原因,我国前列腺癌的发病率及死亡率也呈现明显的上升趋势,近50%的患者确诊时已为晚期[2],错过根治性治疗的机会,内分泌治疗可以延长此类患者生存时间[3]。尽管比卡鲁胺(商品名:康士得)是抗雄治疗的重要药物,但近年2项随机Ⅲ期临床研究均证实,醋酸阿比特龙可改善激素敏感性转移性前列腺癌患者总生存期(overall survival,OS)、影像学无进展生存期或无失败生存[4-5],故醋酸阿比特龙也逐渐被用于晚期前列腺癌的一线治疗。
恶性肿瘤抗血管生成治疗是基于Folkman提出的理论:肿瘤的生长和转移依赖于血管生成,肿瘤血管生成是肿瘤血管生成因子和抑制因子之间的平衡状态被打破的结果[6]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是重要的促血管生成因子。研究证实,前列腺癌细胞VEGF的分泌部分源于雄激素促进VEGF的生成,另一部分是通过前列腺癌细胞自分泌VEGF作用于肿瘤细胞自身的血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)后形成正反馈调节而促进VEGF的表达[7]。在前列腺癌中,VEGF既可促进新生血管的形成,又能稳定新生血管。在其他肿瘤中VEGF可促进血管内皮细胞的有丝分裂活性,特异性引起血管内皮细胞增殖,在体内诱导血管生成,也能直接促进肿瘤细胞增殖,对调节肿瘤血管生成及血管通透性的增加有重要作用[8]。
恩度通过下调VEGF及VEGFR的表达、阻断VEGF诱导VEGFR酪氨酸磷酸化的活性而发挥抑制血管生成的作用。在乳腺癌研究中已发现,抗血管生成治疗联合内分泌治疗对VEGF水平的抑制作用较单药更强[9],但在前列腺癌中少有关于抗血管生成药物联合内分泌治疗药物对VEGF水平影响的研究。本研究将通过测定药物干预后前列腺癌LNCaP细胞的增殖抑制率及培养液上清中VEGF-A及前列腺特异性抗原(prostate specific antigen,PSA)的水平变化,探讨两药对LNCaP细胞VEGF的影响,为进一步探讨前列腺癌抗血管生成治疗提供新的理论基础。
1 材料与方法 1.1 细胞及主要试剂人激素依赖性前列腺癌LNCaP细胞株购于中国科学院上海细胞库,由大连医科大学附属第二医院科研中心保存。RPMI-1640培养液购自美国Gibico公司,胎牛血清购自杭州四季青生物制品公司,阿比特龙购自日本东京Chemical industry公司,恩度购自南京先声药业,噻唑蓝及二甲基亚砜均购自美国Sigma公司,人VEGF-A及PSA ELISA检测试剂盒购自英国Abcam公司。
1.2 细胞培养激素敏感性前列腺癌LNCaP细胞株以RPMI-1640培养液为基础进行培养,加入10%胎牛血清,并置于37℃含5% CO2饱和湿度的细胞培养箱中培养,每48 h更换培养液,待细胞融合率约达70%~80%时以0.25%胰蛋白酶消化传代,取对数生长期的细胞进行实验。
1.3 噻唑蓝比色法检测LNCaP细胞增殖抑制率实验分为调零组、空白对照组、阿比特龙组(分别加入终浓度为0.1、1、10和100 μmol/L的阿比特龙)、恩度组(分别避光加入终浓度为0.1、1、10和100 μL/mL的恩度)和联合组(10 μmol/L阿比特龙与10 μL/mL恩度组合),每组设6个复孔。将细胞置于37℃含5%CO2饱和湿度的细胞培养箱中培养48 h后,吸弃孔内液体,立即加入5 g/L的噻唑蓝溶液20 μL/孔,继续培养4 h,吸弃孔内液体,每孔加入150 μL二甲基亚砜,振荡10 min,酶标仪测其吸光度(absorbance, A)值,测量波长490 nm。增殖抑制率计算公式:抑制率=(1-实验孔平均A值/对照孔平均A值)×100%。
1.4 ELISA法检测LNCaP细胞培养液上清中VEGF-A及PSA的水平实验分为不含任何药物的对照组、阿比特龙组(分别加入终浓度为0.1、1、10和100 μmol/L的阿比特龙)、恩度组(分别避光加入终浓度为0.1、1、10和100 μL/mL的恩度)和联合组(10 μL/mL恩度分别与0.1、1、10和100 μmol/L不同浓度阿比特龙联合干预LNCaP细胞),培养48 h后收集上清液到标记好的1.5 mL EP管中,2 000 r/min室温离心20 min,实验重复3次。严格按试剂盒说明操作,将不同组细胞上清液于酶标仪中检测450 nm A值和上清液中VEGF-A及PSA水平的数值。
1.5 统计学分析采用SPSS 17.0统计学软件分析数据。实验数据以均数±标准差(x ±s)表示,药物剂量与增殖抑制率之间的关系采用直线相关分析,多组间均数比较采用多因素方差分析。以P < 0.05为差异具有统计学意义。
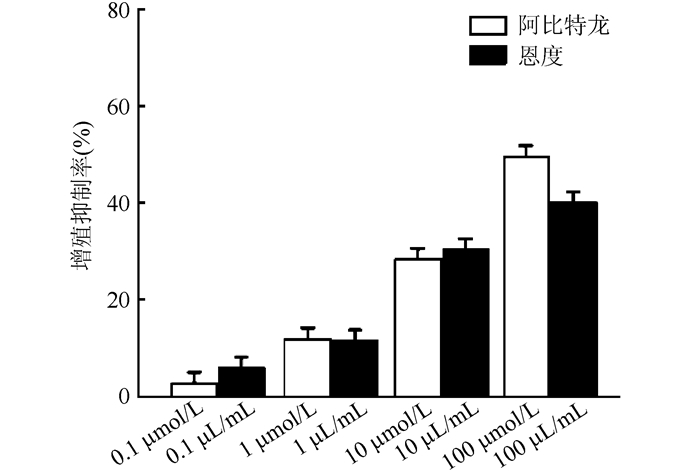
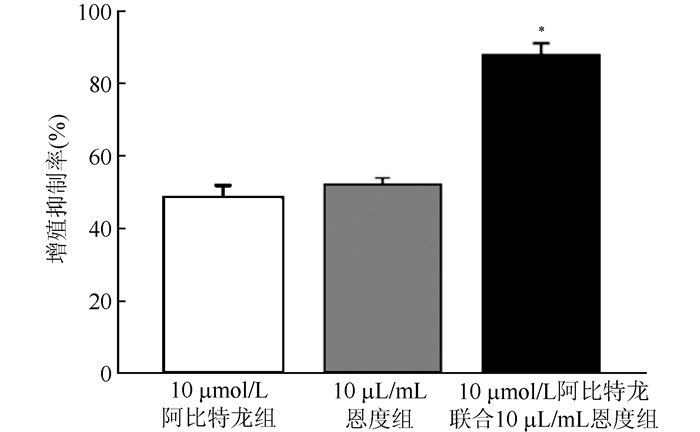
2 结果 2.1 不同药物干预后LNCaP细胞的增殖抑制率噻唑蓝比色法检测不同药物干预48 h后对LNCaP细胞增殖抑制率显示,与空白对照组比较,10和100 μmol/L阿比特龙提高LNCaP细胞的增殖抑制率,差异均具有统计学意义(均P<0.05),呈浓度依赖性;经不同浓度的恩度处理LNCaP细胞48 h显示,与空白对照组比较,10和100 μL/mL恩度提高LNCaP细胞的增殖抑制率,差异均具有统计学意义(均P<0.05),呈浓度依赖性(图 1)。在干预48 h后,10 μmol/L阿比特龙联合10 μL/mL恩度组增殖抑制率高于10 μmol/L阿比特龙组和10 μL/mL恩度组,差异均具有统计学意义(均P<0.05,图 2)。
|
| 图 1 不同浓度阿比特龙及恩度作用48 h后LNCaP细胞增殖抑制率比较 Fig.1 Proliferation inhibition rates of LNCaP cells after 48 h treatment of different concentrations of abiraterone and Endostar |
|
| 注 *与阿比特龙组和恩度组比较, 均P < 0.05 图 2 阿比特龙、恩度及联合用药48 h后LNCaP细胞增殖抑制率比较 Fig.2 Proliferation inhibition rates of LNCaP cells after 48 h treatment of abiraterone, Endostar or both |
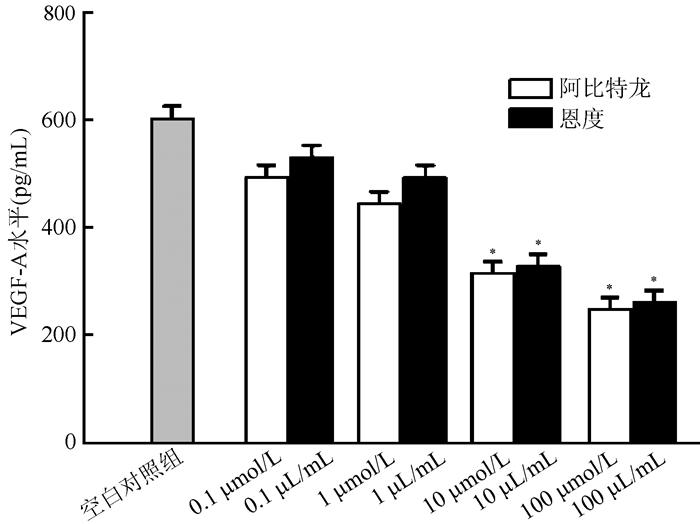
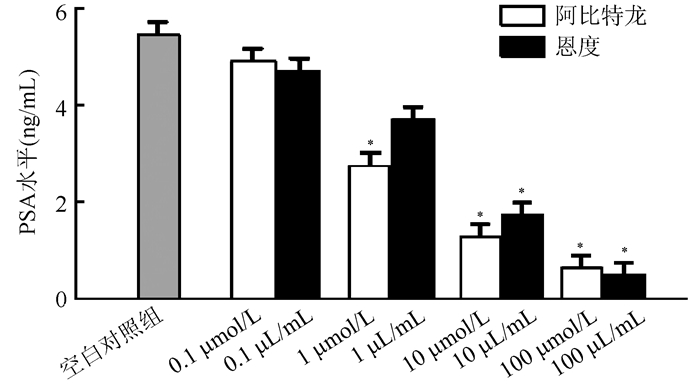
ELISA法检测不同药物干预48 h后LNCaP细胞培养液上清中VEGF-A及PSA水平显示,与空白对照组比较,10和100 μmol/L阿比特龙组LNCaP细胞培养液上清中VEGF-A水平均下降,差异均具有统计学意义(均P<0.05),呈浓度依赖性,同时1、10和100 μmol/L阿比特龙组LNCaP细胞培养液上清中PSA水平均下降,差异均具有统计学意义(均P<0.05),呈浓度依赖性。与空白对照组比较,10和100 μL/mL恩度组LNCaP细胞培养液上清中VEGF-A及PSA水平均下降,差异均具有统计学意义(均P<0.05),呈浓度依赖性(图 3~4)。
|
| 注 *与空白对照组比较, P < 0. 05 图 3 不同浓度阿比特龙及恩度处理LNCaP细胞48 h后的VEGF-A水平 Fig.3 Effects of different concentrations of abiraterone and Endostar on VEGF-A levels (ng/mL) in LNCaP cells 48 h after treatment |
|
| 注 *与空白对照组比较, P < 0. 05 图 4 不同浓度阿比特龙及恩度处理LNCaP细胞48 h后的PSA水平 Fig.4 Effect of different concentrations of abiraterone and Endostar on PSA levels in LNCaP cells 48 h after treatment |
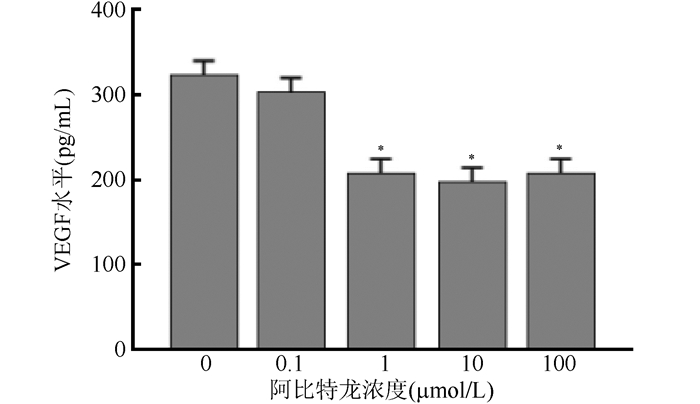
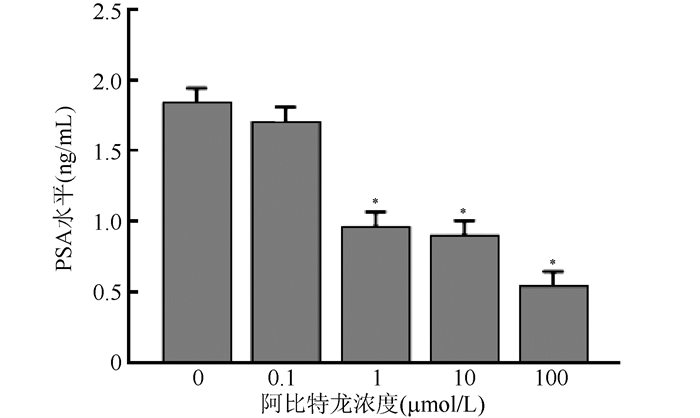
不同浓度阿比特龙联合10 μL/mL恩度作用于人前列腺癌LNCaP细胞48 h后,ELISA法测定培养液上清液中VEGF-A及PSA水平,结果显示,与对照组(0 μmol/L阿比特龙)比较,10 μL/mL恩度联合1、10和100 μmol/L阿比特龙时,LNCaP细胞培养液上清中VEGF-A及PSA水平均下降,差异均具有统计学意义(均P<0.05,图 5~6)。
|
| 注 *与0 μmol /L比较, P < 0. 05 图 5 不同浓度阿比特龙联合10 μL/mL恩度处理LNCaP细胞48 h后VEGF-A水平 Fig.5 Effect of abiraterone combined with Endostar on VEGF-A level in LNCaP cells 48 h after treatment |
|
| 注 *与0 μmol /L比较, P < 0. 05 图 6 不同浓度阿比特龙联合10 μL/mL恩度处理LNCaP细胞48 h后的PSA水平 Fig.6 Effect of abiraterone combined with Endostar on PSA level in LNCaP cells 48 h after treatment |
前列腺癌是男性泌尿生殖系统中最常见的恶性肿瘤。据2019年全球癌症报告显示,前列腺癌发病率居全球男性恶性肿瘤的首位(约19%),死亡率约为9%,仅次于肺癌[1]。近年我国前列腺癌发病率由于多种原因呈上升趋势,已成为泌尿系统中发病率最高的恶性肿瘤。多数患者就诊时已为中晚期,失去根治性治疗的机会,对于这部分患者,内分泌治疗是其主要的治疗方法。醋酸阿比特龙作为前列腺癌内分泌治疗的新型药物,目前其应用范围已经扩展到激素敏感性前列腺癌。
血管生成在肿瘤进展中的作用已在多种恶性肿瘤中被报道。VEGF是目前已知的促进血管生成作用最强的因子之一,在几乎所有的实体肿瘤[10],如乳腺癌[11]、肺癌[12]和胃癌[13]等肿瘤组织中的表达均升高且与不良预后相关。有研究证实,前列腺癌组织中VEGF呈高表达,且肿瘤分级越高,患者血清VEGF表达水平越高,并被认为是早期前列腺癌患者预后评估指标[14]。恩度是我国生产的抗血管生成类生物制品,其可抑制血管内皮细胞增殖、迁移和分化,促进内皮细胞凋亡[15]。
Dickler等[9]在乳腺癌内分泌治疗的相关研究中发现,内分泌治疗联合抗血管生成治疗可改善乳腺癌患者无进展生存期。前列腺癌的一些临床研究也显示,恩度联合化、放疗在前列腺癌治疗中的效果,但国内外少有应用恩度联合抗雄激素治疗前列腺癌的报道。
3.1 阿比特龙及恩度对LNCaP细胞增殖的影响醋酸阿比特龙是一种高选择性的17α-羟化酶,17、20-裂解酶(cytochrome P450,family 17,CYP17)抑制剂。其作用机制在于不可逆的抑制雄激素合成途径的CYP17酶,该酶负责催化孕烯醇酮为脱氢表雄酮和雄烯二酮。阿比特龙抑制CYP17后实现雄激素合成的阻断,在睾丸、肾上腺和前列腺癌合成雄激素的过程中发挥关键作用。本研究结果显示,不同浓度阿比特龙对前列腺癌LNCaP细胞均有抑制增殖的作用。这与既往报道的另一种抗雄激素药物比卡鲁胺对LNCaP细胞的影响相似[16]。在该研究中比卡鲁胺通过与雄激素受体结合而抑制LNCaP细胞增殖。本研究中阿比特龙可能是通过降低雄激素水平进一步起到抑制细胞增殖的作用,其机制可能独立于雄激素受体信号通路之外[17]。
恩度是一种非细胞毒性药物,既往研究提示,其主要通过抑制血管内皮细胞增殖而抑制肿瘤。Lee等[18]发现,与恩度具有类似作用机制的内皮抑素可通过抑制核受体介导的氧化应激而抑制激素敏感性前列腺癌细胞的增殖。本研究提示,恩度单药对LNCaP细胞具有直接增殖抑制作用,其机制是否与内皮抑素相似,或存在其他作用靶点有待进一步研究证实。
在前列腺癌的基础研究中,王蔚等[19]通过多西他赛联合恩度干预前列腺癌PC-3细胞后发现,联合用药对PC-3细胞的增殖抑制作用较各单药组更强。Picus等[20]评价贝伐珠单抗在去势抵抗性前列腺癌患者中的作用,结果显示,多西他赛联合贝伐珠单抗和雌二醇氮芥延长患者中位无瘤生存期和OS。本研究显示,与单药组比较,联合组对LNCaP细胞的增殖抑制作用更明显,提示内分泌治疗联合抗血管生成治疗在激素敏感前列腺癌治疗中同样具有进一步研究的价值。在肺癌的研究中,恩度可通过改善肿瘤细胞中药物浓度而增加化疗药物疗效[21]。本研究中,恩度联合阿比特龙作用LNCaP细胞是否是通过提高阿比特龙向LNCaP细胞内转运使细胞内阿比特龙浓度增加,进一步抑制雄激素产生而提高增殖抑制,还需要进一步的研究证实。
3.2 阿比特龙及恩度对LNCaP细胞培养液上清VEGF-A水平的影响VEGF可直接促进肿瘤细胞增殖,对调节肿瘤血管生成及增加血管通透性具有重要作用。肿瘤的血管生成不仅为肿瘤细胞的生长提供养分,还为肿瘤细胞的播散及转移等提供途径[22]。抗VEGF治疗是目前恶性肿瘤治疗领域研究的重要方向,其高度特异性的作用方式被认为是提高恶性肿瘤治疗效果及减少抗肿瘤治疗相关不良反应的重要途径。
在VEGF家族的成员中,VEGF-A是最重要的成员之一,其在生理条件下的表达水平很低,但在代谢旺盛的组织及多种肿瘤组织中均有较高水平的表达。其通过与相应受体结合而促进肿瘤生长、侵袭及转移[23]。几乎所有前列腺癌患者内分泌治疗后都会逐渐发展为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)。研究显示,当前列腺癌进展至去势抵抗阶段时,患者血清VEGF-A水平增高,血清中增高的VEGF-A使局部癌组织VEGF-A浓度进一步增高,导致VEGF-A更多地与前列腺癌细胞上的受体结合起到促进肿瘤发展的作用,这提示VEGF-A增高是前列腺癌疾病进展的重要环节[24]。
应用比卡鲁胺拮抗后可降低前列腺癌CWR22Rv1细胞培养液VEGF水平[25]。通过对良性前列腺增生患者应用5α-还原酶抑制剂发现,前列腺组织内VEGF的表达水平下降[26]。Strohmeyer等[27]研究发现,前列腺癌患者经去势治疗后的肿瘤组织中VEGF表达减少。而在前列腺癌细胞接种并去势的小鼠中,发现肿瘤生长减缓,且小鼠血清VEGF水平下降[28]。这些研究证实,在前列腺癌中雄激素或雄激素受体可能参与介导VEGF的表达。本研究结果提示,阿比特龙单药干预LNCaP细胞后VEGF-A表达水平下降,推测可能与阿比特龙抑制前列腺癌细胞中CYP17进而抑制雄激素的产生有关。
本研究还发现,恩度单药对LNCaP细胞VEGF-A表达水平具有抑制作用,考虑可能的原因是恩度阻断前列腺癌细胞上VEGFR后抑制细胞自分泌VEGF。实验进一步发现,相较于阿比特龙及恩度单药组,联合组对培养液上清中VEGF-A水平的抑制作用更强。考虑可能是由于抗血管生成药物增加肿瘤细胞对联合药物的通透性及敏感性[29]。
3.3 阿比特龙及恩度对LNCaP细胞培养液上清PSA水平的影响PSA主要存在于人前列腺腺泡和导管上皮细胞的细胞质中,健康人血清PSA水平极低,在前列腺癌和其他疾病状态下,PSA可直接进入循环系统而引起血清PSA水平升高。PSA是前列腺癌理想的预后及疗效判定指标。Shi等[30]对前列腺癌放疗后联合或不联合内分泌治疗进行研究发现,诊断时PSA值越低、PSA下降速率越快,患者生存期越长。基于COU-AA-301/302两项临床研究,转移性CRPC患者应用醋酸阿比特龙后,血清PSA动力学特征显示与OS的关系,即患者PSA最低值越低、PSA倍增时间越长,OS越长[31-32]。
PSA的表达受雄激素调节。雄激素进入前列腺上皮细胞后与细胞核内雄激素受体(androgen receptor, AR)结合,随后的一系列改变诱导PSA基因的转录,使PSA等蛋白合成增加[33]。雄激素增加PSA mRNA表达,去势小鼠接种LNCaP细胞后,当补给雄激素后发现血清PSA增加>20倍[34]。本研究结果发现, 阿比特龙单药组可降低LNCaP细胞的PSA水平,这可能与上述机制相关。
研究发现,血管内皮抑制素可视为一种内源性AR抑制剂,通过与雄激素竞争AR而发挥作用[18]。本研究发现,恩度可抑制前列腺癌LNCaP细胞分泌PSA,也可能与血管内皮抑制素具有类似的作用机制有关。当阿比特龙联合恩度后,LNCaP细胞培养液上清中PSA水平更低,优于单药组对PSA的抑制,提示联合给药具有更好的抗前列腺癌作用。临床研究中也看到类似的现象,黄国福等[35]分析晚期前列腺癌患者应用内分泌治疗及放疗联合或不联合恩度的疗效显示,两组治疗前、后PSA水平均降低,联合恩度组在不同时间PSA水平低于对照组,提示联合恩度优于单用内分泌治疗及放疗。进一步为抗血管生成治疗联合内分泌治疗应用于前列腺癌的治疗提供佐证。
综上所述,阿比特龙和恩度对LNCaP细胞的增殖及VEGF-A和PSA水平具有抑制作用,二者联合时抑制作用更强。这些结果为激素敏感性前列腺癌应用阿比特龙联合抗血管生成治疗的深入研究提供理论基础。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Yano A, Kagawa M, Takeshita H, et al. Improved survival of men with metastatic prostate cancer treated with androgen deprivation therapy plus radiotherapy to the prostate[J]. Int J Urol, 2017, 24(12): 863-865. DOI:10.1111/iju.13479 |
| [3] |
Namiki M, Mizokami A, Kitagawa Y. History and current status of endocrine therapy (hormonal therapy) for prostate cancer:General consideration[J]. Nihon Rinsho, 2016, 74(Suppl 3): 557-562. |
| [4] |
Ryan CJ, Matthew MD, Smith MR, et al. Abiraterone in metastatic prostate cancer without previous chemotherapy[J]. N Engl J Med, 2013, 368(2): 138-148. DOI:10.1056/NEJMoa1209096 |
| [5] |
James ND, Bono JSD, Spears MR, et al. Adding abiraterone for men with high-risk prostate cancer (PCa) starting long-term androgen deprivation therapy (ADT):Survival results from STAMPEDE (NCT00268476)[J]. J Clin Oncol, 2017, 35(Suppl 18): LBA5003. |
| [6] |
Wang R, Zhang K, Tao H, et al. Molecular imaging of tumor angiogenesis and therapeutic effects with dual bioluminescence[J]. Curr Pharmaceut Biotechno, 2017, 18(5): 422-428. |
| [7] |
Lee YC, Huang SP, Tsai CC, et al. Associations of, VEGF, gene polymorphisms with erectile dysfunction and related risk factors[J]. J Sexual Med, 2017, 14(4): 510-517. DOI:10.1016/j.jsxm.2017.02.009 |
| [8] |
Cheng LK, Tai LC, Chien CK, et al. Weekly low-dose docetaxel is an effective treatment with fewer adverse events for metastatic castration-resistant prostate cancer in Taiwanese patients[J]. Urol Sci, 2015, 26(4): 267-270. |
| [9] |
Dickler MN, Barry WT, Cirrincione CT, et al. Phase Ⅲ trial evaluating letrozole as first-line endocrine therapy with or without bevacizumab for the treatment of postmenopausal women with hormone receptor positive advanced-stage breast cancer:CALGB 40503(Alliance)[J]. J Clin Oncol, 2016, 34(22): 2602-2609. DOI:10.1200/JCO.2015.66.1595 |
| [10] |
Ferreira LC, Arbab AS, Jardim-Perassi BV, et al. Effect of curcumin on pro-angiogenic factors in the xenograft model of breast cancer[J]. Anticancer Agents Med Chem, 2015, 15(10): 1285-1296. DOI:10.2174/1871520615666150520093644 |
| [11] |
Yamagata Y, Tomioka H, Sakamoto K, et al. CD163-positive macrophages within the tumor stroma are associated with lymphangiogenesis and lymph node metastasis in oral squamous cell carcinoma[J]. J Oral Maxillofacial Surg, 2017(75): 2144-2153. |
| [12] |
Ball RL, Knapp CM, Whitehead KA. Lipidoid nanoparticles for siRNA delivery to the intestinal epithelium:in vitro investigations in a caco-2 model[J]. PLoS One, 2015, 10(7): e0133154. DOI:10.1371/journal.pone.0133154 |
| [13] |
Li C, Liang G, Yang S, et al. Dysregulated lncRNA-UCA1 contributes to the progression of gastric cancer through regulation of the PI3K-Akt-mTOR signaling pathway[J]. Oncotarget, 2017(7): 93476-93491. |
| [14] |
杨春娇. 恩度与化疗联合治疗多种晚期恶性肿瘤的临床效果分析[J]. 中国现代药物应用, 2018, 12(19): 107-108. |
| [15] |
吴君. 重组人血管内皮抑制素注射液与化疗联合治疗多种晚期恶性肿瘤的临床观察[J]. 中国继续医学教育, 2017, 9(9): 172-174. DOI:10.3969/j.issn.1674-9308.2017.09.093 |
| [16] |
Ferrari N, Granata I, Capaia M, et al. Adaptive phenotype drives resistance to androgen deprivation therapy in prostate cancer[J]. Cell Com Signaling, 2017, 15(1): 51. DOI:10.1186/s12964-017-0206-x |
| [17] |
Grossebrummel H, Peter T, Mandelkow R, et al. Cytochrome P45017A1 inhibitor abiraterone attenuates cellular growth of prostate cancer cells independently from androgen receptor signaling by modulation of oncogenic and apoptotic pathways[J]. Int J Oncol, 2016, 48(2): 793-800. DOI:10.3892/ijo.2015.3274 |
| [18] |
Lee JH, Kang M, Wang H, et al. Endostatin inhibits androgen-independent prostate cancer growth by suppressing nuclear receptor-mediated oxidative stress[J]. FASEB J, 2017, 31(4): 1608-1619. DOI:10.1096/fj.201601178R |
| [19] |
王蔚, 王秀美, 时艳艳, 等. 多西他赛联合恩度对前列腺癌PC-3细胞的体外作用[J]. 齐鲁医学杂志, 2012, 27(5): 403-406. |
| [20] |
Picus J, Halabi S, Kelly WK, et al. A phase Ⅱ study of estramustine, docetaxel, and bevacizumab in men with castrate prostate cancer:results of cancer and leukemia group B study(CALGB) 90006[J]. Cancer, 2011, 117(3): 526-533. |
| [21] |
Pérol M, Chouaid C, Pérol D, et al. Randomized, phase Ⅲ study of gemcitabine or erlotinib maintenance therapy versus observation, with predefined second-line treatment, after cisplatin-gemcitabine induction chemotherapy in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2012, 30(28): 3516-3524. DOI:10.1200/JCO.2011.39.9782 |
| [22] |
Ma X, Hui Y, Lin L, et al. Clinical significance of COX-2, GLUT-1 and VEGF expressions in endometrial cancer tissues[J]. Pakistan J Med Sci, 2015, 31(2): 280-284. |
| [23] |
Hussain M, Lu G, Torres S, et al. Effect of wolbachia on replication of west nile virus in a mosquito cell line and adult mosquitoes[J]. J Virol, 2013, 87(2): 851-858. DOI:10.1128/JVI.01837-12 |
| [24] |
Shen J, Kelly KR. The role of PI3K/AKT/mTOR inhibitors in the treatment of hematological malignancies[J]. Springer Paris, 2016, 29(4): 139-160. |
| [25] |
Eisermann K, Broderick CJ, Bazarov A, et al. Androgen up-regulates vascular endothelial growth factor expression in prostate cancer cells via an Sp1 binding site[J]. Mol Cancer, 2013, 12(1): 7-19. DOI:10.1186/1476-4598-12-7 |
| [26] |
Nawaz G. The effect of two weeks preoperative finasteride therapy in reducing prostate vascularity[J]. JCPSP, 2015, 26(3): 213-215. |
| [27] |
Strohmeyer D, Rössing C, Bauerfeind A, et al. Vascular endothelial growth factor and its correlation with angiogenesis and p53 expression in prostate cancer[J]. Prostate, 2015, 45(3): 216-224. |
| [28] |
Chunyu L, Qi W, Shen S, et al. Oridonin inhibits VEGF A associated angiogenesis and epithelial mesenchymal transition of breast cancer in vitro and in vivo[J]. Oncol Lett, 2018(2): 2289-2298. |
| [29] |
Li C, Huang S, Armstrong E A, et al. Antitumor effects of MEHD7945A, a dual specific antibody against EGFR and HER3, in combination with radiation in lung and head and neck cancers[J]. Mol Cancer Ther, 2015, 14: 1535-7163. |
| [30] |
Shi Z, Pinnock CB, Kinsey-Trotman S, et al. Prostate-specific antigen (PSA) rate of decline post external beam radiotherapy predicts prostate cancer death[J]. Radiothe Oncol, 2013, 107(2): 129-133. |
| [31] |
Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302):final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study[J]. Lancet Oncol, 2015, 16(2): 152-160. DOI:10.1016/S1470-2045(14)71205-7 |
| [32] |
Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer:final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study[J]. Lancet Oncol, 2012, 13(10): 983-992. DOI:10.1016/S1470-2045(12)70379-0 |
| [33] |
Weiss-Messer E, Merom O, Adi A, et al. Growth hormone (GH) receptors in prostate cancer:gene expression in human tissues and cell lines and characterization, GH signaling and androgen receptor regulation in LNCaP cells[J]. Mol Cell Endocrinol, 2004, 220(1/2): 109-123. |
| [34] |
Robitaille CN, Rivest P, Sanderson JT. Antiandrogenic mechanisms of pesticides in human LNCaP prostate and H295R adrenocortical carcinoma cells[J]. Toxicol Sci, 2015, 143(1): 126-135. DOI:10.1093/toxsci/kfu212 |
| [35] |
黄国福, 刘良宾, 冷晓玲. 长周期应用恩度治疗老年晚期前列腺癌的疗效分析[J]. 标记免疫分析与临床, 2014, 21(3): 245-248. |
 2019, Vol. 34
2019, Vol. 34


