文章信息
- 张勇, 张哲, 朱育焱, 孔垂泽
- Zhang Yong, Zhang Zhe, Zhu Yuyan, Kong Chuize
- miR-505-5p在膀胱癌细胞中靶向调控PLK1抑制细胞增殖和迁移
- miR-505-5p inhibits proliferation and migration of human bladder cancer cells by regulating PLK1
- 实用肿瘤杂志, 2019, 34(5): 402-409
- Journal of Practical Oncology, 2019, 34(5): 402-409
基金项目
- 辽宁省自然科学基金(201602830)
-
作者简介
- 张勇(1992-), 男, 重庆万州人, 硕士生, 从事泌尿系统肿瘤基础与临床研究.
-
通信作者
- 孔垂泽, E-mail:xiaoxiao1998@21cn.com
-
文章历史
- 收稿日期:2018-09-28
从全世界来看,膀胱癌的发病率高居恶性肿瘤的第10位,在男性恶性肿瘤中居第6位[1]。在中国,膀胱癌为男性高发的恶性肿瘤之一,居泌尿系统肿瘤发病率首位,并呈现逐年增长的趋势[2]。
Polo样激酶1(Polo-like kinase 1,PLK1)是丝/苏氨酸蛋白激酶家族成员之一[3],在细胞周期中发挥着多种作用。PLK1有助于细胞周期蛋白B/Cdc2的激活,并且在有丝分裂开始时参与中心体成熟和双极纺锤体形成,还通过调节后期促进复合物(anaphase-promoting complex,APC)来控制有丝分裂退出,并且参与细胞质分裂的时间和空间协调[4-5]。PLK1也是DNA损伤检查点的重要目标,可以在G2期和有丝分裂的多个点使细胞周期停滞[6];与p53结合,抑制其反式激活活性及促凋亡功能[7];PLK1对有丝分裂、纺锤体组装和DNA损伤反应中精确调节细胞分裂和维持基因组的稳定性至关重要[8-9]。之前研究表明,PLK1在多数人类肿瘤中高表达,并且其高表达与癌症的不良预后有关[10-12]。有报道显示,通过使用抗体、RNA干扰或者激酶抑制剂阻滞PLK1的表达可以有效抑制肿瘤细胞的增殖和诱导细胞凋亡[13-14]。因此,PLK1可能会成为癌症治疗的潜在靶点。
MicroRNA(缩写为miRNA)是在植物、动物和一些病毒中发现的小的非编码RNA分子(含有约22个核苷酸),其在RNA沉默和基因表达的转录后调节中起作用。miRNA在植物和动物中具有高度保守性,并且被认为在基因调控中起至关重要的作用[15-16]。DNA损伤被认为是癌症发生的主要原因,而miRNA的表达量的改变会导致DNA修复缺陷,这可能是癌症发生的重要原因之一[17]。研究表明,许多miRNA参与调节乳腺癌的众多生物学过程[18]。miR-505-5p可以作为慢性粒细胞白血病患者伊马替尼反应的潜在标志物,并可能应用于早期乳腺癌的检测[19-20]。但其在膀胱癌中与肿瘤的关系尚未阐明。本研究检测miR-505-5p和PLK1在膀胱癌组织中表达水平的变化,并进一步研究miR-505-5p对膀胱癌细胞增殖和迁移的影响,揭示miR-505-5p和PLK1在膀胱癌发生和发展中的可能机制。
1 材料与方法 1.1 临床标本采集和处理收集2016年2月至2017年10月中国医科大学附属第一医院收治的膀胱癌患者18例,包括男性14例,女性4例;年龄50~75岁,(62.7±12.6)岁,中位年龄62岁。收集其行全膀胱切除术的膀胱癌组织及相应的癌旁组织。采集的样本均获得患者本人的知情同意。本研究获得中国医科大学附属第一医院伦理委员会的批准。所有标本均置于-80 ℃备用。
1.2 细胞株与试剂人膀胱癌细胞株T24和UMUC3以及人肾上皮细胞株293T购于中国科学院上海细胞库,其中T24和UMUC3细胞株用含10%的标准胎牛血清(天津市灏洋生物制品科技公司)的RPMI 1640培养液(HyClone,美国), 293T细胞株用含10%的标准胎牛血清的DMEM培养液(HyClone,美国),在37 ℃、5%CO2培养箱中培养。0.25%胰蛋白酶/EDTA消化液(天津市灏洋生物制品科技公司);RNA提取分离试剂盒购于北京天根生物技术公司;miR-505-5p模拟物和抑制剂及其相应对照均购自苏州吉玛基因公司;PrimeScript RT reagent kit和SYBR Premix Ex Taq Ⅱ购于日本TaKaRa;双荧光素酶报告基因质粒购于上海和元生物公司;PLK1过表达质粒购于美国Addgene公司;Dual-Luciferase Report system购于美国Promega;Transwell细胞培养小室购于美国Corning;Cell Counting Kit-8购于日本DOJINDO;一抗鼠抗人PLK1抗体购于美国Santa cruz(sc-17783),一抗兔抗人GAPDH抗体购于美国Abcam(ab8245);山羊抗兔二抗和山羊抗鼠二抗购于北京中衫金桥生物技术公司;蛋白提取液RIPA和蛋白含量检测试剂盒购于上海碧云天生物技术公司;ECL发光液购于美国Pierce公司。
1.3 qRT-PCR检测膀胱癌及癌旁组织中miR-505-5p的表达量组织中加入QIAZOL 700 μL,静置5 min后,用匀浆机将组织搅碎,根据qRT-PCR试剂盒[天根生化科技(北京)有限公司]说明,分别依次加入氯仿以及裂解试剂,分次过柱,最后以去RNA酶超纯水进行洗脱,得到30~50 μL总RNA。根据试剂操作方法,进行反转录,最终将反转录样品上样进行荧光定量。其中膀胱癌及癌旁组织mRNA表达量比较用2-ΔΔCt法,其中ΔCt=ΔCt目的-ΔCt内参,ΔΔCt=ΔCt处理组-ΔCt参照组。qRT-PCR引物(上海生工生物工程):PLK1正向引物为5′-AAAGAGATCCCGGAGGTCCTA-3′,反向引物为5′-GGCTGCGGTGAATGGATATTTC-3′; GAPDH正向引物为5′-GGAGC-GAGATCCCTCCAAAAT-3′,反向引物为GGCTGTTGTCATACTTCTCATGG-3′; hsa-miR-505-5p为5′-AGAGGGAGCCAGGAAGTATTGATGT-3′, 用U6作为内参。
1.4 细胞转染及分组将T24和UMUC3细胞株铺6孔板使每孔细胞密度(3~5)×105/孔,用Lipo3000转染。hsa-miR-505-5p模拟物序列:5′-GGGAGCCAGGAAGUAUU GAUGU-3′,5′-ACAUCAAUACUUCCUGGCUCUU-3′;模拟物对照序列:5′-UUCUCCGAACGUGUCACGU TT-3′,5′-ACGUGACACGUUCGGAGAATT-3′;hsa-miR-505-5p抑制剂序列:5′-GGGAGCCAGGAAGU AUUGAUGU-3′;抑制剂对照序列:5′-CAGUACUUUU GUGUAGUACAA-3′。转染剂量为无血清培养液125 μL,Lipo3000 5 μL,模拟物对照和miR-505-5p模拟物7.5 μL,抑制剂对照和miR-505-5p抑制剂15 μL。培养液与模拟物或抑制剂混合5 min,加入Lipo3000孵育10 min形成混合物,加入培养瓶中。实验将细胞分成模拟物对照组、miR-505-5p模拟物组、抑制剂对照组和miR-505-5p抑制剂组4组。过表达实验将2.5 μg空载质粒(pcDNA组)和PLK1过表达质粒(pcDNA-PLK1组)与5 μL P3000于125 μL无血清培养液混合,加入混有5 μL Lipo3000的125 μL无血清培养液中,将质粒分别转染模拟物对照组和模拟物组T24和UMUC3细胞。
1.5 CCK-8实验测定细胞增殖能力在细胞瓶中进行转染,24 h后将细胞均匀铺于96孔板中,每孔100 μL培养液约2 000~3 000个细胞。待细胞贴壁后,在0 h组中,吸净培养液,以含血清培养液配置10% CCK-8溶液,每孔110 μL加入孔板中,孵育1 h,在450 nm波长处检测吸光度。实验分为0、24、48、72及96 h共5个时间点。
1.6 双荧光素酶报告基因分析将细胞铺96孔板,细胞密度为5 000个/孔,Luc-PLK1-wt、Luc-PLK1-mut质粒与miR-505-5p模拟物或模拟物对照共转染293T细胞,72 h后进行萤火虫荧光素酶及海肾荧光素酶活性检测,结果取萤火虫荧光和海肾荧光数值的比值。
1.7 Western blot检测PLK1蛋白表达水平冰上操作,细胞弃培养液,PBS清洗3遍,吸净培养瓶内液体,加入含有1 μmol/L PMSF的RIPA裂解液150 μL,用细胞刮勺将贴壁细胞刮下,置于冰上裂解15 min,超声破碎细胞3次,每次5 s,4 ℃,12 000 rpm,离心30 min,取上清蛋白。加入缓冲液配成2 μg/μL体系。制备10%~12% SDS-PAGE,上样,140 V电泳50 min,根据具体情况切胶,Bio-rad转印350 mA,2 h,牛奶封闭37 ℃ 1 h,封闭一抗过夜,洗膜,37 ℃封闭二抗1 h,洗膜后以发光底物发光。
1.8 Transwell实验检测细胞迁移能力将转染24 h的细胞消化离心,无血清培养液重悬,计数,小室内细胞为3×104/孔,小室上层为200 μL无血清培养液,下层为600 μL 10%胎牛血清培养液,培养24 h后,结晶紫染色15 min,棉签擦去小室上层细胞,显微镜下观察。
1.9 统计学分析采用SPSS 23软件进行数据分析。数据采用均值±标准差( x±s)表示,两组间比较采用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 miR-505-5p和PLK1在膀胱癌及癌旁正常组织中的表达水平qRT-PCR实验检测miR-505-5p在膀胱癌及癌旁正常组织中表达量显示,miR-505-5p在膀胱癌组织中的表达量低于癌旁正常组织[(0.78±0.46) vs (1.35±0.38), P < 0.01]。PLK1在膀胱癌组织中的表达量高于癌旁正常组织[(1.30±0.49) vs (0.67±0.27), P < 0.01],见图 1。
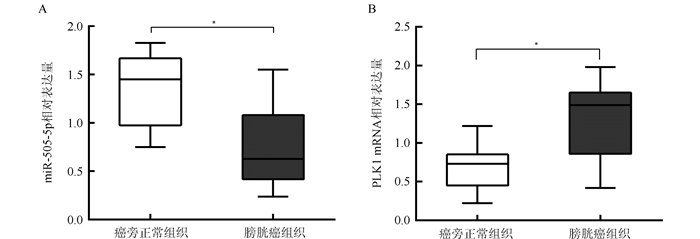
|
| 注 A:miR-505-5p 在膀胱癌及癌旁正常组织中的表达量;B:Polo 样激酶 1( Polo-like-kinase 1,PLK1)在膀胱癌及癌旁 正常组织中的表达量; *P < 0. 01 图 1 膀胱癌及癌旁正常组织中miR-505-5p和PLK1表达量 Fig.1 Expression of miR-505-5p and PLK1 in bladder cancer tissues and adjacent normal bladder tissues |
Western blot实验检测转染miR-505-5p模拟物和抑制剂的膀胱癌细胞蛋白水平变化(图 2)。T24和UMUC3细胞株中,miR-505-5p模拟物组的PLK1蛋白表达水平均低于模拟物对照组(均P < 0.01),miR-505-5p抑制剂组均高于抑制剂对照组(均P < 0.01)。
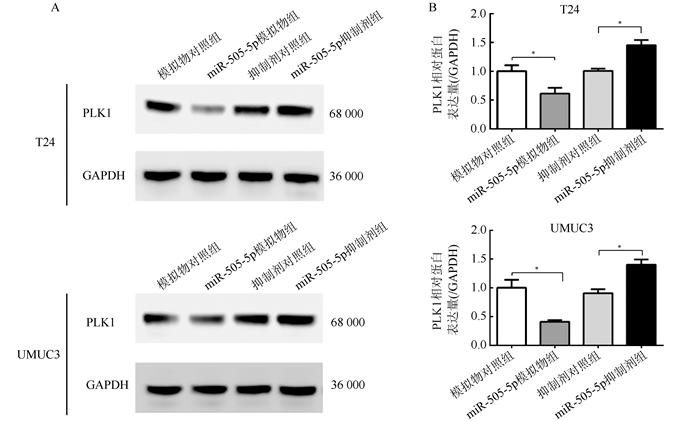
|
| 注 A:Western blot 实验结果;B:PLK1 蛋白表达直方图; *P < 0. 01 图 2 转染miR-505-5p模拟物或抑制剂后T24和UMUC3细胞PLK1蛋白表达量 Fig.2 PLK1 protein expression after transfection of miR-505-5p mimics or inhibitor in T24 and UMUC3 cells |
在293T细胞中用双荧光素酶报告基因系统验证miR-505-5P与PLK1 mRNA 3′-UTR结合(图 3)。miR-505-5p模拟物+PLK1-3′-UTR-WT组相对荧光活性较模拟物对照+PLK1-3′-UTR WT组下降约42%[(0.58±0.04)vs (1.00±0.06), P < 0.01]。而miR-505-5p模拟物+PLK1-3′-UTR MUT组相对荧光活性与模拟物对照+PLK1-3′-UTR MUT组比较,差异无统计学意义[(0.92±0.13)vs (1.04±0.08), P=0.245]。结果提示miR-505-5p可以与PLK1 mRNA 3′-UTR特异结合。
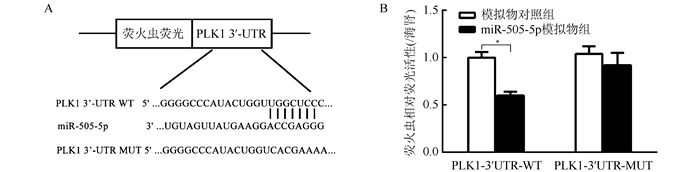
|
| 注 A:miR-505-5p 与 PLK1 的结合位点;B:双荧光素酶实验检测 miR-505-5p 调控 PLK1 的荧光活性;*P < 0. 01 图 3 293T细胞中miR-505-5p靶向结合PLK1 mRNA 3′-UTR Fig.3 miR-505-5p binded to PLK1 mRNA 3′-UTR in 293T cells |
上调miR-505-5P表达量的T24和UMUC3细胞株增殖能力在48、72和96 h均较对照组下降(均P < 0.05),下调miR-505-5p则在72和96 h均较对照组上升(均P < 0.05),见图 4。
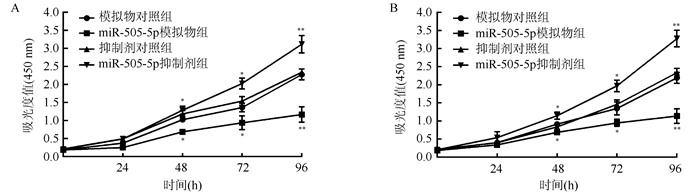
|
| 注 A:T24 细胞;B:UMUC3 细胞;*与相应对照组比较,P < 0. 05;**与相应对照组比较,P < 0. 01 图 4 miR-505-5p抑制T24和UMUC3细胞增殖 Fig.4 miR-505-5p inhibited proliferation of T24 and UMUC3 cells |
利用transwell实验检测miR-505-5p对膀胱癌细胞迁移能力的影响(图 5)。上调miR-505-5p表达量(模拟物组)的T24和UMUC3细胞均较模拟物对照组细胞迁移数量减少(均P < 0.01)。下调miR-505-5p表达量(抑制剂组)的T24和UMUC3细胞均较抑制剂对照组细胞迁移数量增多(均P < 0.05)。因此miR-505-5p可以通过靶向PLK1抑制膀胱癌细胞增殖和迁移的能力。
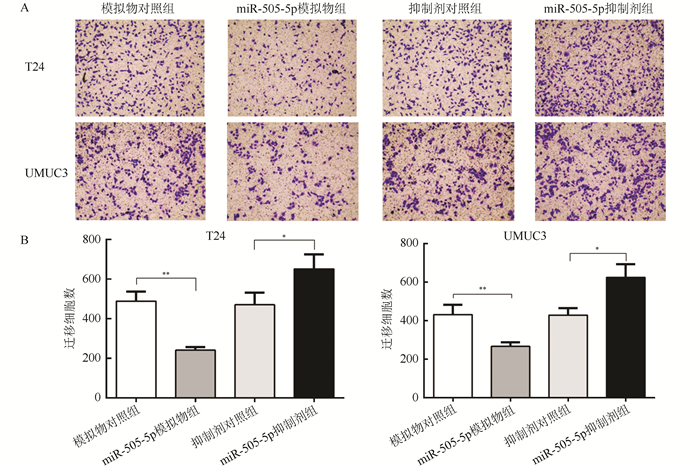
|
| 注 A:Transwell 实验检测 miR-505-5p 对膀胱癌细胞迁移的影响(结晶紫染色 × 100);B:细胞迁移结果直方图;* P < 0. 05;**P < 0. 01 图 5 miR-505-5p抑制T24和UMUC3细胞迁移 Fig.5 miR-505-5p inhibited migration of T24 and UMUC3 cells |
在膀胱癌细胞T24和UMUC3细胞中,pcDNA-PLK1组代表过表达PLK1的膀胱癌细胞,pcDNA组作为空白对照转入空载质粒。然后在转染2种质粒的膀胱癌细胞中分别瞬时转染模拟物对照和miR-505-5p模拟物,通过比较pcDNA-PLK1+模拟物对照组和pcDNA+模拟物对照组显示,过表达PLK1后膀胱癌细胞的PLK1蛋白水平升高(均P < 0.01)。CCK-8实验结果表明,过表达PLK1可以增强T24和UMUC3细胞的增殖能力(P < 0.05, P < 0.01)。Transwell实验的结果表明,过表达PLK1可以增强T24和UMUC3细胞的迁移能力(P < 0.05, P < 0.01)。pcDNA-PLK1+miR-505-5p模拟物组细胞的增殖能力和迁移能力较pcDNA+miR-505-5p模拟物组增强(均P < 0.01,图 6)。
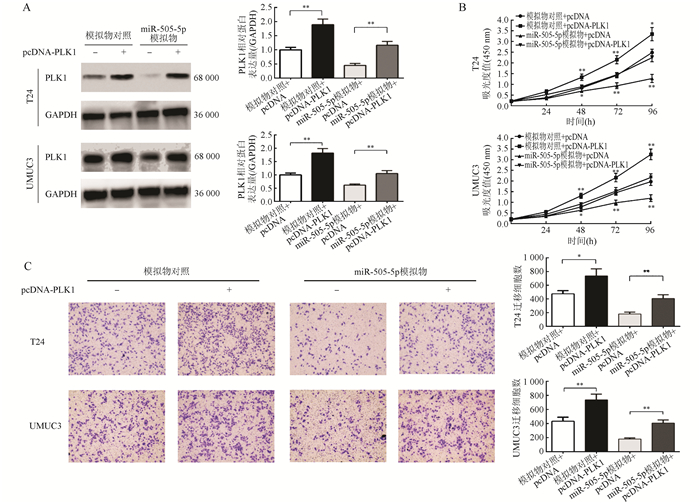
|
| 注 A:过表达 PLK1 后 miR-505-5p 对 PLK1 蛋白水平的影响(结晶紫染色 × 100);B:CCK-8 实验检测过表达 PLK1 后,miR- 505-5p 对细胞增殖的影响;C:Transwell 实验检测过表达 PLK1 后,细胞迁移能力的变化;*与相应模拟物对照组比较,P < 0. 05; **与相应模拟物对照组比较,P < 0. 01 图 6 过表达PLK1消除miR-505-5p对膀胱癌细胞T24和UMUC3的抑制迁移和增殖的作用 Fig.6 Overexpression of PLK1 abolished the inhibitory effect of miR-505-5p on the migration and proliferation of T24 and UMUC3 cells |
本研究首次证明,miR-505-5p在膀胱癌组织中的表达量低于癌旁正常组织,而PLK1在膀胱癌组织中的表达量高于癌旁正常组织。这个结果提示,miR-505-5p与PLK1存在某种关联。通过生物信息学网站的分析发现,miR-505-5p与PLK1可能有潜在的结合位点,本研究用双荧光素酶报告基因试验进行证实。过表达PLK1可以消除miR-505-5p对膀胱癌细胞增殖和迁移能力的抑制作用。本研究在2种膀胱癌细胞株T24和UMUC3中证明,miR-505-5p通过靶向PLK1抑制膀胱癌细胞增殖能力和迁移能力。
膀胱癌的肿瘤生物学行为复杂,有易复发和易转移的特点。约33%的初发膀胱癌会发生局部进展和远处转移[21],而具体的发生和发展机制尚未研究清楚。miRNA可能为揭示这一生物过程提供研究方向。miRNA在许多哺乳动物细胞类型中很丰富,并且靶向作用于人类和其他哺乳动物约60%的基因[22]。许多miRNA在进化上很保守,这意味着其具有重要的生物学功能。miRNA的表达量改变会影响众多的生物学进程,甚至与癌症相关。目前的观点认为,miRNA以癌基因或抑癌基因的角色参与到肿瘤的发生和发展之中[23]。许多其他miRNA可能与癌症的发生和发展有关[24],因此有时被称为“oncomirs”。而另外一些miRNA则可能发挥着抑制癌症的作用。研究揭示,抑制miR-125b可以减弱肝癌细胞增殖和侵袭能力[25]。而另外miR-205则可以抑制乳腺癌的转移性[26]。miR-506也可以发挥肿瘤拮抗剂的作用[27]。研究表明,miR-505-5p可能作为早期乳腺癌诊断和慢性粒细胞白血病伊马替尼反应的生物标志物,还可能与心脏代谢风险因子特征相关[19-20]。在膀胱癌中更有多个研究表明,miR-100、miR-509-3-5p和miR-296-5p均能靶向作用PLK1抑制肿瘤细胞增殖[28-30]。
已有研究探索血液中的miR-505-5p表达量与疾病的关系[19-20],本研究则在膀胱癌组织中对miR-505-5p的表达量进行检测,并且发现在膀胱癌组织中其变化趋势与致癌因子PLK1的变化趋势相反。通过体外实验,在2种膀胱癌细胞T24和UMUC3中均证明,miR-505-5p可以抑制细胞增殖和迁移。本研究在膀胱癌中探索miR-505-5p可能靶向作用PLK1而发挥出抑癌基因的作用。然而由于1个靶基因可以被多个miRNA调节,而1个miRNA也同时作用于多个靶基因,因此miR-505-5p和其他调节PLK1的miRNA各自在其中起的作用的权重以及相互之间是否存在协同作用仍然需要深入研究。本研究仅从体外实验的角度对miR-505-5p靶向PLK1调节膀胱癌细胞的功能作用进行验证,而这一结论是否可在体内实验中得到论证,仍需进一步研究。
本研究结果显示,miR-505-5p与PLK1存在靶向关系。miR-505-5p可通过靶向调控PLK1表达抑制膀胱癌细胞增殖和迁移。为进一步研究miR-505-5p参与膀胱癌发生、发展及转移的机制提供理论依据。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
韩苏军, 张思维, 陈万青, 等. 中国膀胱癌发病现状及流行趋势分析[J]. 癌症进展, 2013, 11(1): 89-95. DOI:10.3969/j.issn.1672-1535.2013.01.021 |
| [3] |
Golsteyn RM, Lane HA, Mundt KE, et al. The family of polo-like kinases[J]. Prog Cell Cycle Res, 1996, 2: 107-114. |
| [4] |
Glover DM, Hagan IM, Tavares AA. Polo-like kinases:a team that plays throughout mitosis[J]. Genes Dev, 1998, 12(24): 3777-3787. DOI:10.1101/gad.12.24.3777 |
| [5] |
Nigg EA. Polo-like kinases:positive regulators of cell division from start to finish[J]. Curr Opin Cell Biol, 1998, 10(6): 776-783. DOI:10.1016/S0955-0674(98)80121-X |
| [6] |
Smits VA, Klompmaker R, Arnaud L, et al. Polo-like kinase-1 is a target of the DNA damage checkpoint[J]. Nat Cell Biol, 2000, 2(9): 672-676. DOI:10.1038/35023629 |
| [7] |
Ando K, Ozaki T, Yamamoto H, et al. Polo-like kinase 1(Plk1) inhibits p53 function by physical interaction and phosphorylation[J]. J Biol Chem, 2004, 279(24): 25549-25561. DOI:10.1074/jbc.M314182200 |
| [8] |
Mundt KE, Golsteyn RM, Lane HA, et al. On the regulation and function of human polo-like kinase 1(PLK1):effects of overexpression on cell cycle progression[J]. Biochem Biophys Res Commun, 1997, 239(2): 377-385. DOI:10.1006/bbrc.1997.7378 |
| [9] |
Lens SM, Voest EE, Medema RH. Shared and separate functions of polo-like kinases and aurora kinases in cancer[J]. Nat Rev Cancer, 2010, 10(12): 825-841. DOI:10.1038/nrc2964 |
| [10] |
Ramani P, Nash R, Sowa-Avugrah E, et al. High levels of polo-like kinase 1 and phosphorylated translationally controlled tumor protein indicate poor prognosis in neuroblastomas[J]. J Neurooncol, 2015, 125(1): 103-111. DOI:10.1007/s11060-015-1900-4 |
| [11] |
Tut TG, Lim SH, Dissanayake IU, et al. Upregulated polo-like kinase 1 expression correlates with inferior survival outcomes in rectal cancer[J]. PLoS One, 2015, 10(6): e0129313. DOI:10.1371/journal.pone.0129313 |
| [12] |
Zhang R, Shi H, Ren F, et al. Misregulation of polo-like protein kinase 1, P53 and P21WAF1 in epithelial ovarian cancer suggests poor prognosis[J]. Oncol Rep, 2015, 33(3): 1235-1242. DOI:10.3892/or.2015.3723 |
| [13] |
Bu Y, Yang Z, Li Q, et al. Silencing of polo-like kinase (Plk) 1 via siRNA causes inhibition of growth and induction of apoptosis in human esophageal cancer cells[J]. Oncology, 2008, 74(3/4): 198-206. |
| [14] |
de Oliveira JC, Brassesco MS, Pezuk JA, et al. In vitro PLK1 inhibition by BI 2536 decreases proliferation and induces cell-cycle arrest in melanoma cells[J]. J Drugs Dermatol, 2012, 11(5): 587-592. |
| [15] |
Fromm B, Billipp T, Peck LE, et al. A uniform system for the annotation of vertebrate microRNA genes and the evolution of the human microRNAome[J]. Annu Rev Genet, 2015, 49: 213-242. DOI:10.1146/annurev-genet-120213-092023 |
| [16] |
Bartel DP. Metazoan microRNAs[J]. Cell, 2018, 173(1): 20-51. DOI:10.1016/j.cell.2018.03.006 |
| [17] |
Wan G, Mathur R, Hu X, et al. miRNA response to DNA damage[J]. Trends Biochem Sci, 2011, 36(9): 478-484. DOI:10.1016/j.tibs.2011.06.002 |
| [18] |
刘洋, 董毅龙. miRNA在乳腺癌中作用的研究进展[J]. 实用肿瘤杂志, 2017, 32(4): 300-303. |
| [19] |
Matamala N, Vargas MT, González-Cámpora R, et al. Tumor microRNA expression profiling identifies circulating microRNAs for early breast cancer detection[J]. Clin Chem, 2015, 61(8): 1098-1106. DOI:10.1373/clinchem.2015.238691 |
| [20] |
Ramachandran SS, Muiwo P, Ahmad HM, et al. miR-505-5p and miR-193b-3p:potential biomarkers of imatinib response in patients with chronic myeloid leukemia[J]. Leuk Lymphoma, 2017, 58(8): 1981-1984. DOI:10.1080/10428194.2016.1272681 |
| [21] |
Choueiri TK, Raghavan D. Chemotherapy for muscle-invasive bladder cancer treated with definitive radiotherapy:persisting uncertainties[J]. Nat Clin Pract Oncol, 2008, 5(8): 444-454. DOI:10.1038/ncponc1159 |
| [22] |
Friedman RC, Farh KK, Burge CB, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009, 19(1): 92-105. |
| [23] |
Fendler A, Stephan C, Yousef GM, et al. MicroRNAs as regulators of signal transduction in urological tumors[J]. Clin Chem, 2011, 57(7): 954-968. DOI:10.1373/clinchem.2010.157727 |
| [24] |
Musilova K, Mraz M. MicroRNAs in B-cell lymphomas:how a complex biology gets more complex[J]. Leuke-mia, 2015, 29(5): 1004-1017. DOI:10.1038/leu.2014.351 |
| [25] |
李建华, 韩玲, 杨志良. miR-125b通过靶向致癌基因LIN28B调控肝细胞癌细胞的增殖和侵袭行为[J]. 实用肿瘤杂志, 2018, 33(2): 128-132. |
| [26] |
Wu H, Mo YY. Targeting miR-205 in breast cancer[J]. Expert Opin Ther Targets, 2009, 13(12): 1439-1448. DOI:10.1517/14728220903338777 |
| [27] |
Liu G, Sun Y, Ji P, et al. MiR-506 suppresses proliferation and induces senescence by directly targeting the CDK4/6-FOXM1 axis in ovarian cancer[J]. J Pathol, 2014, 233(3): 308-318. |
| [28] |
Huang YH, Tseng YH, Lin WR, et al. HBV polymerase overexpression due to large core gene deletion enhances hepatoma cell growth by binding inhibition of microRNA-100[J]. Oncotarget, 2016, 7(8): 9448-9461. |
| [29] |
Wang XH, Lu Y, Liang JJ, et al. MiR-509-3-5p causes aberrant mitosis and anti-proliferative effect by suppression of PLK1 in human lung cancer A549 cells[J]. Biochem Biophys Res Commun, 2016, 478(2): 676-682. DOI:10.1016/j.bbrc.2016.08.006 |
| [30] |
Xu C, Li S, Chen T, et al. miR-296-5p suppresses cell viability by directly targeting PLK1 in non-small cell lung cancer[J]. Oncol Rep, 2016, 35(1): 497-503. |
 2019, Vol. 34
2019, Vol. 34


