文章信息
- 朱鸿虹, 王伟斌, 吴伟强, 滕理送
- 原发性色素性结节性肾上腺皮质病伴罕见甲状旁腺腺瘤一例
- 实用肿瘤杂志, 2019, 34(4): 370-373
-
作者简介
- 朱鸿虹(1992-), 女, 浙江杭州人, 硕士生, 从事甲状腺癌临床研究.
-
通信作者
- 滕理送, E-mail:lsteng@zju.edu.cn
-
文章历史
- 收稿日期:2019-02-02
2. 浙江大学医学院附属第一医院病理科, 浙江 杭州 310003
原发性色素性结节性肾上腺皮质病(primary pigmented nodular adrenocortical disease,PPNAD)是一种以非促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)依赖性库欣综合征为主要临床表现的罕见疾病,多数为常染色体显性遗传,常可伴发心脏或皮肤黏液瘤、神经鞘瘤、睾丸肿瘤和甲状腺肿瘤等,但迄今并无文献报道其与甲状旁腺腺瘤同时伴发的情况,本院收治1例,报道如下。
1 病例资料患者女性,49岁,2018年7月因反复双下肢水肿7年、发现肾上腺占位3个月余入本院内分泌科治疗。7年前间断出现双下肢水肿,活动后加重。6年前曾出现大汗淋漓、黑朦,就诊当地医院,查血钾3.0 mmol/L,此后血钾反复偏低。患者于3年前逐渐肥胖,3年来体质量增加30 kg。2018年3月在外院就诊行腹部CT检查意外发现左肾上腺体部结节状增粗,考虑腺瘤。垂体MR检查提示垂体内斑点状低信号影,微腺瘤待排。遂至本院就诊。既往有原发性高血压史20年,药物控制血压欠佳。否认家族性疾病史。
入院查体:身高160 cm,体质量89 kg,体质量指数35 kg/m2,血压160/94 mmHg(1 mmHg=0.133 kPa);全身皮肤未见明显紫纹、痤疮、色素沉着,心肺查体无殊,腹部膨隆,双下肢水肿。实验室检查:血常规、性激素水平、甲状腺功能和血糖无明显异常,三酰甘油偏高;电解质水平为血钾偏低(3.28 mmol/L),血钙偏高(2.68 mmol/L),其他电解质水平均在正常范围;甲状旁腺激素偏高(181.0 pg/mL);血皮质醇节律存在,8 :00、16 :00和0 :00分别为13.00 μg/dL、7.78 μg/dL和2.88 μg/dL,24 h尿游离皮质醇在正常范围内(256.96 μg/24 h),小剂量地塞米松试验可抑制。影像学检查:肾上腺增强CT检查提示左侧肾上腺增粗(图 1);B型超声提示左侧甲状旁腺区界清低回声灶;甲状旁腺显像提示左叶甲状腺中极后方结节灶,伴示踪剂明显浓聚,考虑甲状旁腺腺瘤(图 2)。入院诊断:原发性甲状旁腺功能亢进症,左侧肾上腺占位,左侧甲状旁腺区占位,垂体微腺瘤待排,多发性内分泌腺瘤病1型不能除外。
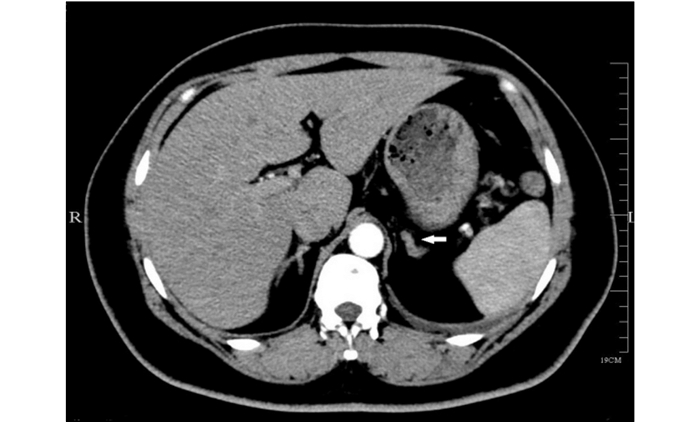
|
| 注 肾上腺增强CT检查提示,左侧肾上腺(箭头)增粗,密度均匀,增强后未见明显异常强化. 图 1 患者2018年7月7日肾上腺增强CT检查结果 |
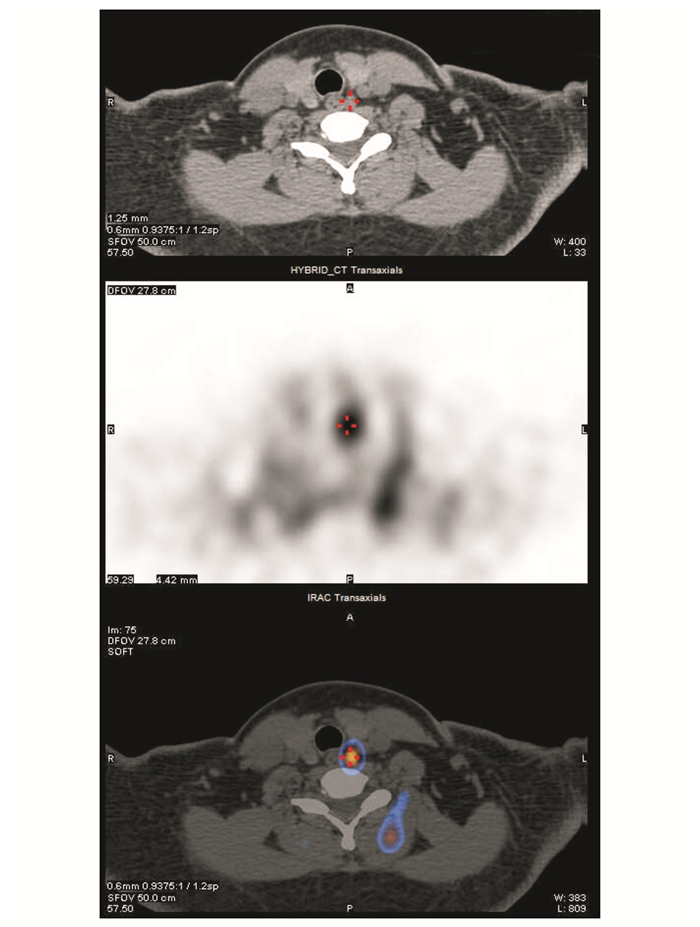
|
| 注 双时相甲状旁腺MIBI+SPECT/CT断层融合显像示,左叶甲状腺中极后方结节灶,边界清晰,大小约2.2 cm×1.0 cm× 0.6 cm,伴示踪剂明显浓聚,结合临床考虑甲状旁腺腺瘤 图 2 患者2018年7月10日双时相甲状旁腺MIBI+SPECT/CT断层融合显像结果 |
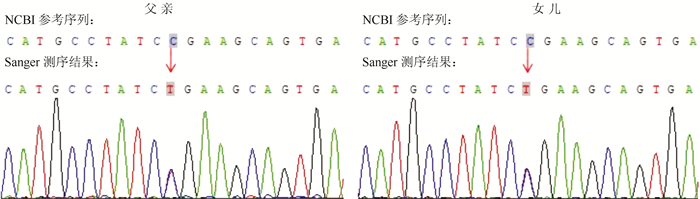
患者分别于2018年8月和9月接受左侧肾上腺切除术及左侧上极甲状旁腺腺瘤切除术,术中见左侧肾上腺增粗,局部膨大。左侧甲状腺中上极后方可及1枚结节,大小约2.0 cm×1.5 cm,质韧,边界清。术后病理:镜下可见左侧肾上腺皮质内多个散在小结节,结节间见萎缩的皮质细胞,结节内细胞胞质丰富,其内可见脂褐素颗粒(图 3);左侧甲状腺中上极结节符合甲状旁腺腺瘤,并见散在分布的棕褐色物质(图 4);病理诊断为左侧肾上腺腺瘤样增生,左侧甲状旁腺腺瘤。基因检测:在获得患者的知情同意后,对患者外周血采样,进行全外显子组测序,检出1个匹配受检者临床表型的致病性的基因变异(PDE11A基因c.C235T: p.R79X杂合变异,变异类型为无义突变),一代测序验证以上发现(图 5)。OMIM数据库收录该基因关联疾病表型为PPNAD。结合患者临床、影像及病理表现,最终诊断为PPNAD。考虑到该疾病为常染色体显性遗传,进一步采集患者父亲及女儿的外周血进行检测,在同一位点均检出相同的PDE11A基因突变(图 6),验证该患者的突变基因遗传自其父亲。

|
| 注 A:肾上腺皮质内多个散在小结节,结节间见萎缩的皮质细胞(HE×100);B:结节内细胞胞质丰富,其内可见脂褐素颗粒(HE×400) 图 3 患者2018年8月10日手术标本病理示左侧肾上腺腺瘤样增生符合原发性色素性结节性肾上腺皮质病表现 |
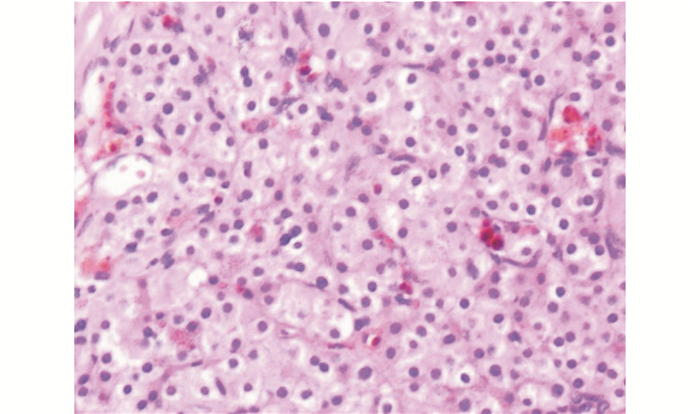
|
| 注 甲状旁腺符合腺瘤表现,其内见散在的棕褐色物质 图 4 患者2018年9月21日手术标本病理示左侧甲状旁腺腺瘤(HE×200) |
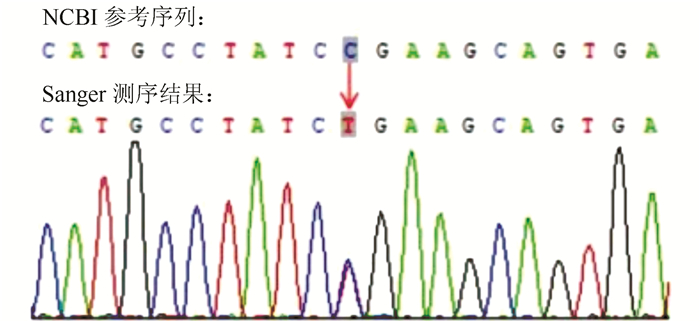
|
| 图 5 患者基因变异位点测序结果显示该位点为杂合变异(PDE11A:NM_001077197:exon3:c.C235T:p.R79X) |
|
| 图 6 患者父亲和患者女儿基因测序结果 |
患者术后体质量无明显变化,双下肢水肿无明显改善。2018年10月24日术后复查血钾4.04 mmol/L,血钙2.41 mmol/L,甲状旁腺激素19.8 pg/mL,均在正常范围内。B型超声提示双侧肾上腺区及双侧甲状旁腺区未探及明显占位性病变,肾上腺增强CT检查提示左侧术后改变,右侧未见明显异常。
2 讨论PPNAD是引起库欣综合征的一种罕见的遗传相关性疾病,多数以常染色体显性遗传方式遗传,也可散发。其特点是肾上腺皮质内多发的色素性小结节并伴有脂褐素沉积,临床上常以皮质醇增多症为主要临床表现就诊而发现。当合并有皮肤和黏膜的色素沉着、心脏或皮肤的黏液瘤、神经鞘瘤以及各种内分泌肿瘤时,被称为卡尼复合征(Carney complex,CNC)[1]。PPNAD是CNC中最常见的内分泌肿瘤,发生在约60%的CNC患者中。本例患者因发现左侧肾上腺占位就诊,临床表现及查体提示库欣综合征可能,故行左侧肾上腺切除术,术后病理呈典型的PPNAD表现。对患者及其直系亲属进行基因检测均发现突变基因,符合常染色体显性遗传规律,支持该诊断。患者同时发现甲状旁腺腺瘤,PPNAD合并甲状旁腺腺瘤迄今并无相关报道,本例为基因突变导致甲状旁腺腺瘤还是同时性双原发肿瘤难以鉴别。
PPNAD多在儿童或青年时期被诊断,更多见于女性,约占71%,中位发病年龄女性为30岁,男性为46岁[2]。其最常见的临床表现有向心性肥胖、皮肤紫纹、骨质疏松和儿童身材矮小等。典型的实验室检查表现为非ACTH依赖的库欣综合征,大剂量地塞米松抑制试验不能抑制,尿游离皮质醇(urinary free cortisol,UFC)反常性升高[3]。部分患者因病情发展缓慢、程度较轻,表现为亚临床、非典型或周期性的库欣综合征而诊断困难。本例患者发病年龄较晚,并且临床症状和实验室表现不典型,给确诊带来一定困难。
在病理上PPNAD常为双侧肾上腺皮质受累,典型的表现为肾上腺皮质内弥漫分布多个黑色或棕褐色的结节,多数被萎缩的肾上腺皮质包绕[1]。PPNAD的结节具有自主功能,可分泌皮质醇而不依赖于来自垂体的信号,因此腺体缺少ACTH的刺激而表现为萎缩。本例患者镜下可见肾上腺皮质内多个散在小结节,主要由胞质丰富的嗜酸性细胞构成,其内可见棕褐色的脂褐素颗粒沉积,结节间见萎缩的皮质细胞,符合PPNAD的病理表现。在患者的甲状旁腺内也发现散在的棕褐色物质,考虑为脂褐素或含铁血黄素,镜下难以辨别。
该病是一种常染色体显性遗传疾病,主要与PRKAR1A基因的失活突变或缺失有关[4]。PRKAR1A基因位于17q22-24,是一种抑癌基因,编码的RIα亚基是依赖于环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的蛋白激酶A(protein kinase A,PKA)的调节亚基。PKA全酶分子是由2个调节亚基(R亚基)和2个催化亚基(C亚基)组成的四聚体,不具有活性。当调节亚基与cAMP结合时,PKA释放催化亚基而活化。PRKAR1A基因发生突变可导致R1α亚基合成障碍,使PKA活性异常升高,促进多种肿瘤的增殖[5]。
值得注意的是,PPNAD还与位于2q31区域的PDE11A基因相关。磷酸二酯酶(phosphodiesterase,PDE)11A基因编码PDE11A,是PDE蛋白超家族的成员之一,催化cAMP或环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的水解。Horvath等[6]通过对无PRKAR1A突变的PPNAD家族成员进行全基因组筛查发现, PDE11A基因的失活突变与其具有强烈关联,这是PDE家族中首个被发现与肿瘤形成有关的遗传性疾病相关的成员。PDE11A基因遗传缺陷在一般人群中相对频繁发生,但其外显率较低,可能与发育、激素和性别相关[7]。本例患者在外周血中检测出PDE11A基因突变,考虑为PPNAD的致病基因。其父亲及女儿携带有相同的突变,符合常染色体显性遗传规律,携带者无PPNAD临床表现可能与该突变基因的外显率低有关。
目前对于诊断PPNAD的患者,首选的治疗方式为手术切除。双侧肾上腺切除可以达到100%的治愈率,但术后需要常规补充肾上腺皮质激素,部分患者在肾上腺次全切除和单侧切除后也可达到长期缓解[8]。针对PKA和cAMP途径的靶向药物尚在研究阶段。
PPNAD患者常可同时伴有心脏或黏液瘤、睾丸大细胞钙化性支持细胞瘤、黑色素性神经鞘瘤、甲状腺结节或癌等。PPNAD背景下也可能出现其他较为少见的肿瘤,有报道在1个携带S147G PRKAR1A突变的CNC家族中发现1例PPNAD患者合并肾上腺皮质癌[9]。临床医师应该对这类罕见的恶性事件予以关注。据笔者所知,PPNAD患者合并甲状旁腺腺瘤为首次报道,其发生是否与PDE11A突变有关尚不可知,但这种少见的并发症同样应该引起临床医师的重视,对此类难以诊断的患者进行基因分型是非常有必要的。
综上所述,本例患者通过临床表现、影像检查、病理检查及基因检测,最终确诊为PPNAD。此病例提示PPNAD也可能合并一些罕见的肿瘤,如甲状旁腺腺瘤,PDE11A基因是否与其发生有关尚不明确。发病晚、症状轻的PPNAD患者,临床上容易漏诊、误诊,基因检测可以帮助诊断这种罕见疾病,也可用于排除家族性PPNAD。目前仍有部分PPNAD患者未发现与疾病相关的遗传基因,其遗传学及发病机制有待进一步研究。
| [1] |
Carney JA, Gordon H, PC Carpenter, et al. The complex of myxomas, spotty pigmentation, and endocrine overactivity[J]. Medicine, 1985, 64(4): 270-283. DOI:10.1097/00005792-198507000-00007 |
| [2] |
Stratakis CA, Kirschner LS, JA Carney. Clinical and molecular features of the Carney complex:diagnostic criteria and recommendations for patient evaluation[J]. J Clin Endocrinol Metab, 2001, 86(9): 4041-4046. DOI:10.1210/jcem.86.9.7903 |
| [3] |
Chen S, Li R, Lu L, et al. Efficacy of dexamethasone suppression test during the diagnosis of primary pigmented nodular adrenocortical disease in Chinese adrenocorticotropic hormone-independent Cushing syndrome[J]. Endocrine, 2018, 59(1): 183-190. |
| [4] |
Bram Z, Louiset E, Ragazzon B, et al. PKA regulatory subunit 1A inactivating mutation induces serotonin signaling in primary pigmented nodular adrenal disease[J]. JCI Insight, 2016, 1(15): e87958. |
| [5] |
Casey M, Vaughan CJ, He J, et al. Mutations in the protein kinase A R1alpha regulatory subunit cause familial cardiac myxomas and Carney complex[J]. J Clin Invest, 2000, 106(5): R31-38. DOI:10.1172/JCI10841 |
| [6] |
Horvath A, Boikos S, Giatzakis C, et al. A genome-wide scan identifies mutations in the gene encoding phosphodiesterase 11A4(PDE11A) in individuals with adrenocortical hyperplasia[J]. Nat Genet, 2006, 38(7): 794-800. DOI:10.1038/ng1809 |
| [7] |
Horvath A, Giatzakis C, Robinson-White A, et al. Adrenal hyperplasia and adenomas are associated with inhibition of phosphodiesterase 11A in carriers of PDE11A sequence variants that are frequent in the population[J]. Cancer Res, 2006, 66(24): 11571-11575. DOI:10.1158/0008-5472.CAN-06-2914 |
| [8] |
Lowe KM, Young WF, Lyssikatos C, et al. Cushing syndrome in carney complex:clinical, pathologic, and molecular genetic findings in the 17 affected Mayo Clinic patients[J]. Am J Surg Pathol, 2017, 41(2): 171-181. DOI:10.1097/PAS.0000000000000748 |
| [9] |
Anselmo J, Medeiros S, Carneiro V, et al. A large family with Carney complex caused by the S147G PRKAR1A mutation shows a unique spectrum of disease including adrenocortical cancer[J]. J Clin Endocrinol Metab, 2012, 97(2): 351-359. DOI:10.1210/jc.2011-2244 |
 2019, Vol. 34
2019, Vol. 34


