文章信息
- 金礼斌, 陶惠民, 张炜, 杨正明, 刘兵
- Jin Libin, Tao Huimin, Zhang Wei, Yang Zhengming, Liu Bing
- 限制性内衬全髋关节假体在髋周肿瘤切除术后髋关节重建术中的应用
- Application of total hip arthroplasties with constrained acetabular liners following peri-hip tumor resection
- 实用肿瘤杂志, 2019, 34(4): 353-357
- Journal of Practical Oncology, 2019, 34(4): 353-357
-
作者简介
- 金礼斌(1979-), 男, 浙江绍兴人, 主治医师, 硕士, 从事骨肿瘤临床研究.
-
通信作者
- 金礼斌, E-mail:2505015@zju.edu.cn
-
文章历史
- 收稿日期:2019-05-27
人工髋关节置换术是髋关节周围肿瘤切除后常用的重建方式,能实现肢体修复并保存髋关节功能。但是髋周肿瘤切除重建术后并发症发生率较高。而且假体脱位是其中最主要且最常见的并发症[1-2]。Jaiswal等[3]报道有20%的髋周肿瘤切除术后患者会发生脱位。Issa等[4]也报道,在髋臼周围肿瘤切除术后,采用非骨水泥型假体和双动杯进行髋关节重建术的患者脱位率高达17%。而术后的脱位常导致反复脱位,甚至翻修手术,造成患者满意度下降同时提示预后不良[5]。
导致人工关节脱位的因素很多,与患者本身、手术技术、植入物设计和软组织状况相关[6]。比较特殊的是,髋周肿瘤切除术后髋关节脱位风险的因素还包括关节囊切除、外展肌与假体的连接技术以及假体头的大小等[2]。为彻底切除髋周肿瘤,外展肌和髋关节囊往往需要切除。此外,目前对于外展肌和髋关节囊附着假体的连接技术还没有非常完善。因此,临床中非常迫切需要一个安全和适当的方法来降低髋周肿瘤重建术后的脱位率。
近年来,髋臼限制性内衬(constrain acetabular liner,CAL)已成为全髋关节术后不稳定的重要选择之一。CAL的功能类似于软组织袖套,最适用于维持髋关节稳定中最重要的肌肉缺乏时[7]。Gill等[8]的研究结果显示,在使用限制性内衬的全髋关节中术后脱位率仅为1.8%。但限制性髋关节假体设计对于髋关节力学环境改变较大,会带来假体-骨界面的应力集中以及限制性内衬与股骨头的撞击,可能使患者面临早期假体松动、内衬磨损加速及髋关节活动范围减少等问题。然而,其在髋肿瘤切除术后重建的应用鲜有报道。本研究通过回顾性队列研究评价CAL假体在髋周肿瘤切除术后重建的安全性和有效性,观察其是否可以降低的脱位率。
1 资料与方法 1.1 一般资料收集2015年4月至2017年11月浙江大学医学院附属第二医院使用限制性内衬全髋假体进行全髋关节置换的12例髋周恶性肿瘤患者。其中,男性6例,女性6例;手术时患者年龄15~69岁,平均年龄42.3岁,中位年龄39.5岁。所有患者中,4例为骨盆肿瘤(Ⅱ+Ⅲ型,3例软骨肉瘤和1例孤立性纤维瘤),8例为股骨近端肿瘤(4例骨肉瘤,1例多形性未分化肉瘤,1例浆细胞骨髓瘤,1例转移瘤和1例软骨肉瘤)。所有患者均为初次Ⅰ期肿瘤切除后行全髋置换手术。其中3例股骨近端骨肉瘤患者术前进行新辅助化疗,其余患者术前未进行化疗。本研究经浙江大学医学院附属第二医院医学伦理委员会批准。所有患者均签署知情同意书。12例患者的临床资料见表 1。
| 病例 | 年龄(岁)/性别 | 肿瘤部位 | 病理诊断 | 随访时间(月) | 生存情况 | 局部复发 | 并发症 | MSTS评分 | 脱位 |
| 1 | 15/女 | 股骨近端 | 骨肉瘤 | 34 | 无瘤生存 | 无 | 无 | 28 | 无 |
| 2 | 15/男 | 股骨 | 骨肉瘤 | 42 | 无瘤生存 | 无 | 无 | 16 | 无 |
| 3 | 42/男 | 股骨近端 | 骨肉瘤 | 45 | 无瘤生存 | 无 | 无 | 24 | 无 |
| 4 | 58/女 | 股骨近端 | 多形性未分化肉瘤 | 27 | 无瘤生存 | 无 | 无 | 12 | 无 |
| 5 | 26/女 | 股骨近端 | 乳腺癌骨转移 | 26 | 无瘤生存 | 无 | 无 | 26 | 无 |
| 6 | 52/女 | 股骨近端 | 浆细胞骨髓瘤 | 17 | 带瘤生存 | 无 | 无 | 18 | 无 |
| 7 | 60/女 | 股骨近端 | 软骨肉瘤 | 29 | 无瘤生存 | 无 | 无 | 16 | 无 |
| 8 | 57/男 | 骨盆 | 软骨肉瘤 | 29 | 死亡 | 无 | DVT | 16 | 无 |
| 9 | 22/女 | 骨盆 | 软骨肉瘤 | 36 | 无瘤生存 | 无 | 无 | 28 | 无 |
| 10 | 69/男 | 骨盆 | 软骨肉瘤 | 24 | 无瘤生存 | 无 | 无 | 24 | 无 |
| 11 | 37/男 | 骨盆 | 孤立性纤维瘤 | 45 | 无瘤生存 | 无 | 深部感染 | 22 | 无 |
| 12 | 54/男 | 股骨近端 | 骨肉瘤 | 14 | 死亡 | 无 | 无 | 18 | 无 |
| 注 MSTS:肌肉骨骼肿瘤协会(The Musculoskeletal Tumor Society);DVT:深静脉血栓(deep venous thrombosis) | |||||||||
所有患者均常规进行术前检查,包括平片、髋关节增强磁共振成像和CT检查。常规进行高分辨率肺CT扫描。必要时行放射性核素骨显像(emission computed tomography,ECT)或正电子发射断层CT扫描(positron emission tomography-CT,PET-CT)。所有患者术前均接受活检以获得明确的病理诊断。
1.3 治疗3例骨肉瘤患者术前行常规新辅助化疗。根据体表面积,化疗方案为三药联合方案,采用甲氨蝶呤12 g/m2(儿童)或8 g/m2(成人)(d1,d8)、顺铂90~120 mg/m2(d15)和多柔比星60 mg/m2(d17),1个月为1个周期,行2个周期化疗后手术治疗。
所有患者的手术均由骨肿瘤外科同一团队完成。在切开皮肤30 min前使用包括头孢呋辛和克林霉素在内的预防性抗生素。术中广泛显露,保护股动静脉、股神经和坐骨神经,行肿瘤的广泛性切除。依据术前磁共振影像,切除范围包括骨边界为肿瘤边界外4 cm处正常骨平面截骨,软组织边界为肿瘤边界外2 cm处正常软组织。股骨上端肿瘤于髋臼关节囊处切断髋关节。髋臼肿瘤于股骨颈关节囊处切断髋关节。髋关节重建采用的是美国强生公司的限制性全髋假体(Duraloc® constrain liner)。肿瘤切除后外展肌有较大缺损的患者中,残余的外展肌拉直后缝合于阔筋膜上,使肌肉有足够的收缩力量和长度。在没有严重外展肌缺损的患者中,则使用不可吸收缝线将残留的外展肌与股外侧肌进行缝合后再通过股骨假体近端的预留孔重新缝合到假体上(图 1)。术后常规使用抗生素直到拔除引流管。所有患者术后均采用梯形枕制动。患者从术后第1天开始股四头肌锻炼。患者术后2周开始使用助步器下床步行。
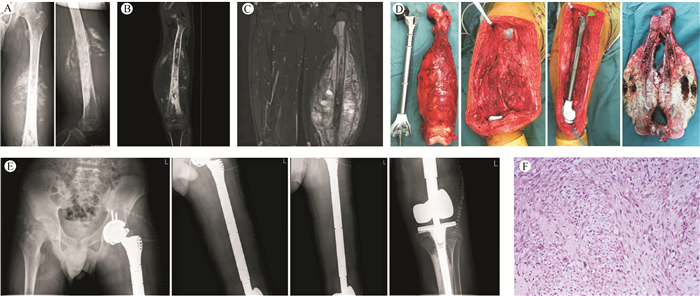
|
| 注 A:术前股骨正侧位片;B:术前股骨CT检查结果;C:术前股骨磁共振检查结果;D:术中切除肿瘤情况,绿色箭头为限制性聚乙烯内衬;E:术后的X线检查;F:术后病理检查示,左股骨高级别骨肉瘤化疗后改变,肿瘤大小为28 cm×11 cm,肿瘤突破骨皮质累及骨周围软组织,肿瘤坏死率约为60%(化疗评级Ⅰ级),四周软组织切缘为阴性(HE×100) 图 1 典型患者病例2左股骨骨肉瘤行左侧全股骨置换术 Fig.1 Typical case (case 2) osteosarcoma of left femur, left total femoral replacement |
所有患者均在术后1、3、6和12个月进行随访,之后每年随访1次。随访截止至2019年4月。随访时间为14~45个月,平均30.7个月。记录患者并发症并使用肌肉骨骼肿瘤协会(The Musculoskeletal Tumor Society,MSTS)功能评分评估功能[2, 9-10]。
1.5 统计学分析采用SPSS 16.0统计学软件分析数据。Kaplan-Meier法作生存分析,总生存时间为最末次手术日期至患者死亡或最后1次随访日期[11]。
2 结果 2.1 手术和生存情况术后病理检查的手术边缘均为R0。2例随访期间死亡,其中1例右股骨近端骨肉瘤患者(病例12)术后14个月死于肺转移,1例盆腔软骨肉瘤患者(病例8)术后29个月死于肺和脑转移。所有肿瘤切除和重建患者的2年和3年总生存率分别为91.7%和83.3%(图 2)。

|
| 图 2 限制性内衬全髋置换治疗髋周肿瘤患者总生存曲线 Fig.2 Survival curve of patients with perihip tumors treated by CAL total hip replacement |
10例患者(83.3%)未出现假体相关并发症。出现脱位0例。1例盆腔孤立性纤维瘤患者(病例11)因腹泻后肠球菌从肠道移位,术后29个月出现深部感染,经过多次清创和抗生素治疗后,最后1次随访时(术后45个月),假体仍保留,无需行翻修手术。1例骨盆软骨肉瘤患者(病例8)在24个月时发生深静脉血栓形成。其原因可能是术后12个月发生肺转移,限制其肢体活动。
2.3 功能所有患者MSTS评分为12~28分,(20.67±3.35)分;均有轻微的步态异常。其中10例不需要任何辅助行走,2例需要1根手杖辅助行走。
3 讨论髋周肿瘤切除后的重建是临床上的一个挑战。对于生存时间较长的相对年轻患者,全髋关节置换通常是髋关节重建的较好策略。值得注意的是,髋关节脱位是肿瘤切除后功能性外展肌组织不全和髋关节囊不全的主要并发症。先前的研究报告,在髋臼周围骨肿瘤切除术后,使用双活动杯非骨水泥假体进行髋关节重建时,脱位率为17%[4]。Sokolovski等[6]报道股骨近端肿瘤切除行全髋关节置换患者,有9%术后发生髋关节脱位。为了找到一种减少脱位率以达到稳定关节的方法,本研究组在肿瘤切除后使用限制性内衬的全髋关节置换术来重建髋关节。尽管随访时间较短,但本研究中患者没有出现脱位的并发症。髋关节囊的留存和在股骨头疤痕形成可以有效预防脱位。同时通过将外展肌重新连接到假体上,髋关节稳定性也得到增强。但髋周恶性肿瘤广泛切除后,常存在外展肌组织缺损,髋关节囊不全。而限制性内衬假体的使用指征正是软组织缺损和外展肌机制不足[7]。本研究结果证实,在肿瘤切除后软组织疤痕修复前,限制性内衬假体提供更好的初始髋关节稳定性。
系统回顾性研究表明,在平均随访时间 < 5年的情况下,使用限制性内衬的普通全髋置换的失败率>10%,最主要的原因就是无菌性松动[7]。因为在普通全髋置换中使用限制性内衬可能会对骨-假体界面造成过度的压力,从而影响髋臼假体-骨界面的骨长入[12]。此外,撞击也是导致失败的另一重要原因。股骨头被过深的包容在聚乙烯内衬中,使得股骨颈容易接触到相对较高的内衬边缘造成撞击。因此有学者提出应在限制性内衬全髋置换术后测量造成撞击的极端位置并对患者活动进行限制[13]。然而,本研究未发现患者出现假体失败的情况,分析原因可能是患者均为肿瘤患者,行广泛切除后髋周的肌肉及软组织的缺损造成患者髋关节活动度的下降,可能会减少骨-假体界面的过度压力,对髋臼假体-骨界面的骨长入影响较小,从而减少无菌性松动的发生,同时明显减少撞击的发生。肿瘤患者的活动能力及活动量的减少也能延长假体的使用寿命。Ueda等[11]的研究也显示,髋臼周围恶性肿瘤切除后行限制性内衬全髋置换术是一种有效的重建方法,术后髋关节脱位率及无菌性松动较低。术中技巧也很重要,在行限制性内衬全髋置换术时,患者的髋臼侧必须尽可能保留充足的骨量及骨质,必须保证合适的前倾角,髋臼假体必须使用螺钉固定,以保证良好的初始稳定性,为髋臼侧骨长入提供良好的环境,进而提高假体的长期生存。另外,在安配股骨柄假体时要确保人工股骨头-颈的牢固压配,以防出现头-颈松动分离脱位;限制性内衬的凸起边缘在压配后直径会小于人工股骨头,在复位时,暴力操作容易将凸起边缘的一部分挤入关节内,可能会造成该内衬边缘折断,继而导致放入卡环紧缩时达不到理想的效果。
本研究对应用限制性内衬全髋关节置换行髋周肿瘤切除的12例患者进行随访(平均30.6个月),结果显示,随访期间未出现脱位,未见早期假体松动和骨溶解等并发症;在功能评价方面,MSTS评分为(20.67±3.35)分;患者均有轻微的步态异常。患者术后均恢复日常活动,主观满意度好。本研究结果表明,在髋周肿瘤切除术后采用限制性内衬全髋关节置换术,其早期临床效果良好。本研究探讨的疾病较为罕见,存在一定的局限性,如本研究为缺乏对照的回顾性研究,且随访时间短,样本量小,存在一定的偏倚。
综上所述,限制性内衬全髋置换术是髋周恶性肿瘤切除术后重建髋关节的一种安全且合适的选择。考虑到本研究中的相关偏差,需要大样本和良好设计的随机对照试验来进一步探讨。
| [1] |
Renard AJ, Veth RP, Schreuder HW, et al. Function and complications after ablative and limb-salvage therapy in lower extremity sarcoma of bone[J]. J Surg Oncol, 2000, 73(4): 198-205. DOI:10.1002/(SICI)1096-9098(200004)73:4<198::AID-JSO3>3.0.CO;2-X |
| [2] |
Du Z, Tang S, Yang R, et al. Use of an artificial ligament decreases hip dislocation and improves limb function after total femoral prosthetic replacement following femoral tumor resection[J]. J Arthroplasty, 2018, 33(5): 1507-1514. DOI:10.1016/j.arth.2017.12.017 |
| [3] |
Jaiswal PK, Aston WJ, Grimer RJ, et al. Peri-acetabular resection and endoprosthetic reconstruction for tumours of the acetabulum[J]. J Bone Joint Surg Br, 2008, 90(9): 1222-1227. |
| [4] |
Issa SP, Biau D, Babinet A, et al. Pelvic reconstructions following peri-acetabular bone tumour resections using a cementless ice-cream cone prosthesis with dual mobility cup[J]. Int Orthop, 2018, 42(8): 1987-1997. DOI:10.1007/s00264-018-3785-2 |
| [5] |
Kotwal RS, Ganapathi M, John A, et al. Outcome of treatment for dislocation after primary total hip replacement[J]. J Bone Joint Surg Br, 2009, 91(3): 321-326. |
| [6] |
Sokolovski VA, Voloshin VP, Aliev MD, et al. Total hip replacement for proximal femoral tumours:our midterm results[J]. Int Orthop, 2006, 30(5): 399-402. DOI:10.1007/s00264-006-0124-9 |
| [7] |
Jones SA. Constrained acetabular liners[J]. J Arthroplasty, 2018, 33(5): 1331-1336. DOI:10.1016/j.arth.2018.01.026 |
| [8] |
Gill K, Whitehouse SL, Hubble MJW, et al. Short-term results with a constrained acetabular liner in patients at high risk of dislocation after primary total hip arthroplasty[J]. HIP Int, 2016, 26(6): 580-584. DOI:10.5301/hipint.5000396 |
| [9] |
Henderson ER, Groundland JS, Pala E, et al. Failure mode classification for tumor endoprostheses:retrospective review of five institutions and a literature review[J]. J Bone Joint Surg Am, 2011, 93(5): 418-429. DOI:10.2106/JBJS.J.00834 |
| [10] |
Enneking WF, Dunham W, Gebhardt MC, et al. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system[J]. Clin Orthop Relat Res, 1993, 286: 241-246. |
| [11] |
Ueda T, Kakunaga S, Takenaka S, et al. Constrained total hip megaprosthesis for primary periacetabular tumors[J]. Clin Orthop Relat Res, 2013, 471(3): 741-749. DOI:10.1007/s11999-012-2625-8 |
| [12] |
Della Valle CJ, Chang D, Sporer S, et al. High failure rate of a constrained acetabular liner in revision total hip arthroplasty[J]. J Arthroplasty, 2005, 20(7 Suppl 3): 103-107. |
| [13] |
Yun AG, Padgett D, Pellicci P, et al. Constrained acetabular liners:mechanisms of failure[J]. J Arthroplasty, 2005, 20(4): 536-541. DOI:10.1016/j.arth.2004.12.054 |
 2019, Vol. 34
2019, Vol. 34


