文章信息
- 龙景培, 卜贺启, 刘殿雷
- Long Jingpei, Bu Heqi, Liu Dianlei
- 冬凌草甲素对结肠癌LOVO细胞增殖和EMT影响的实验研究
- The experimental study of oridonin on proliferation and EMT of colon cancer LOVO cells
- 实用肿瘤杂志, 2019, 34(4): 309-315
- Journal of Practical Oncology, 2019, 34(4): 309-315
基金项目
- 浙江省医药卫生科技计划面上项目(2018KY325);浙江省自然科学基金项目(Y17H160187)
-
作者简介
- 龙景培(1968-), 男, 湖南邵阳人, 副主任医师, 硕士, 从事普通外科基础与临床研究.
-
通信作者
- 龙景培, E-mail: longjp@zju.edu.cn
-
文章历史
- 收稿日期:2019-04-23
2. 浙江省立同德医院肛肠科, 浙江 杭州 310012
2. Department of Coloproctological Surgery, Tongde Hospital of Zhejiang Province, Hangzhou 310012, China
结肠癌是消化系统最常见的恶性肿瘤之一,是全世界癌症死亡的主要原因[1]。结肠癌的治疗包括手术切除、化疗、放疗和靶向治疗,单独或联合治疗。迄今为止,化疗仍是结肠癌的主要治疗手段,但化疗药物的严重不良反应降低患者的生活质量[2]。因此,探索低毒性的新化疗药物具有重要的临床应用价值。天然药物及其衍生物是化疗药物的主要来源之一,有些已经用于癌症治疗几十年,如紫杉醇和喜树碱[3]。冬凌草甲素(oridonin,ORI)是从冬凌草中分离出来的一种二萜类化合物,是冬凌草中最重要的活性成分之一。研究发现,冬凌草甲素对多种肿瘤细胞株均具有显著的抑制或杀伤作用,同时对人体重要脏器如骨髓、肝和肾等无明显损伤[4]。近来研究也证实,Wnt通路的过度激活及失调与多种恶性肿瘤(如肝癌、结肠癌、胃癌和胰腺癌等)的发生和发展密切相关[5-11]。
尽管冬凌草甲素在各种癌症中显示很强的抗肿瘤活性, 并且已证实冬凌草甲素可能通过糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)调节Wnt/β-catenin信号通路,从而诱导骨肉瘤143B细胞的凋亡,抑制其增殖[12-13],但其诱导结直肠癌细胞凋亡的作用是否与Wnt /β-catenin信号有关尚不明确。因此,本研究旨在探讨Wnt/β-catenin通路在冬凌草甲素抑制结肠癌LOVO细胞增殖和上皮间质转化(epithelial-mesenchymal transition,EMT)中所扮演的角色。
1 材料与方法 1.1 材料冬凌草甲素(纯度>98%)购自上海生物科技有限公司,溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)配制成储备液(10 mmol/L), 分装后于-20 ℃冰箱保存;灭活无菌胎牛血清、胰蛋白酶、DMSO和RPMI-1640培养液购自美国Gibco公司;TRIzol试剂及cDNA反转录试剂盒、BCA蛋白浓度测定试剂盒和GSK-3β的抑制剂CHIR均购自美国Abcam公司;抗p-GSK-3β(Tyr216)、抗p-GSK-3β(Ser9)、抗β-catenin、抗E-cadherin、抗Vimentin和抗β-actin抗体购自英国Abcam公司;HRP标记的山羊抗小鼠和山羊抗兔IgG购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养结肠癌细胞株LOVO购于美国ATCC公司。LOVO细胞复苏后培养于RPMI-1640培养液中(含10 %胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素),置于含体积分数5%CO2及95%空气、37 ℃细胞培养箱中无菌培养,每隔48 h换液1次。待细胞生长至80%左右融合时,用胰酶消化传代。过夜待细胞贴壁后,取对数生长期细胞进行实验。
1.2.2 CCK-8法检测细胞增殖取对数生长期的LOVO细胞,胰酶消化离心,制成细胞悬液并调整细胞浓度为0.5×105个/mL,以每孔100 μL细胞接种到96孔板,置于细胞培养箱中培养,待细胞贴壁后,吸弃原培养液,各孔分别加入等量含不同浓度(2、4、8、12和16 μg/mL)的冬凌草甲素,分别培养24、48和72 h,每个浓度设6个复孔,同时设空白组(加入等量的培养液)和对照组(加入等量0.1% DMSO的培养液)。药物作用结束前1 h,各孔加入0.01 mL CCK-8溶液,37℃继续培养1 h,用自动酶标仪测定450 nm波长处各孔吸光值(absorbance, A)。实验重复3次并取平均值。计算药物在不同浓度和不同时间下对LOVO细胞的生长抑制率。
细胞生长抑制率=[1-(A实验组-A空白组)/(A对照组-A空白组)]×100%。
1.2.3 RT-PCR检测E-cadherin和Vimentin基因水平的表达收集处于对数生长期的结肠癌LOVO细胞,经不同浓度(4、8和12 μg/mL)冬凌草甲素处理48 h后收集细胞,同时设对照组(含0.1% DMSO培养液处理)。参照TRIzol说明书进行抽提上述各组细胞总RNA, 按照操作说明应用反转录试剂盒合成cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,PCR仪进行扩增。反应条件为:预变性94 ℃ 3 min;变性94 ℃ 30 s,退火56 ℃ 30 s,延伸72 ℃ 30 s;最后延伸10 min,共36个循环。将PCR产物用1.5%浓度的琼脂糖进行凝胶电泳检测(电压100 V, 30 min),在凝胶成像系统上观察电泳带及其位置,摄影,Image J软件将图像转换成灰度值。将各条带灰度值与内参GAPDH灰度值的比值进行分析。各引物序列和产物长度见表 1。
| 引物 | 序列 | 产物长度(bp) |
| Vimentin | 上游:5′-GGAAGAGAACTTTGCCGTTG-3′ | 308 |
| 下游:5′-TGGTATTCACGAAGGTGACG-3′ | ||
| E-cadherin | 上游:5′-CTGAGAACGAGGCTAACG-3′ | 321 |
| 下游:5′-GTCCACCATCATCATTCAATAT-3′ | ||
| GAPDH | 上游:5′-GAGTCAACGGATTTGGTCGT-3′ | 238 |
| 下游:5′-TTGATTTTGGAGGGATCTCG-3′ | ||
| 注 GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase) | ||
取对数生长期结肠癌LOVO细胞接种于6孔培养板,细胞经不同浓度(4、8和12 μg/mL)冬凌草甲素处理后置于无菌培养箱培养48 h,收集细胞,按照细胞质蛋白提取试剂盒说明方法裂解细胞膜,然后收集细胞质蛋白。BCA分析试剂测定样品总蛋白浓度,调整蛋白浓度,每组各取等量(80 μg)总蛋白样品,以12%聚丙烯酰胺凝胶电泳分离蛋白。将切取的不同目的片段,经转膜液分别转移至PVDF膜上,之后用含5%脱脂牛奶封闭2 h。洗膜后结合适当浓度的一抗4 C°孵育过夜,TBST洗膜15 min×2次后加HRP标记的二抗,常温孵育2 h,TBST洗膜15 min×2次。用增强化学发光法显色,X线曝光显影。凝胶系统扫描拍照,Image J图像软件读取灰度值,将目标条带灰度值和内参条带的灰度值比值进行分析来衡量蛋白的表达差异。
1.3 统计学分析采用SPSS 16.0软件分析数据。计量资料采用均数±标准差(x ± s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 不同浓度冬凌草甲素对结肠癌LOVO细胞增殖的影响CCK-8结果显示,不同浓度冬凌草甲素(2、4、8、12和16 μg/mL)作用LOVO细胞后,随着培养时间(24、48和72 h)延长,其增殖抑制率逐渐增高(均P < 0.05), 呈时间依赖性;同一时间点内不同浓度冬凌草甲素作用LOVO细胞后细胞增殖抑制率逐渐增高(均P < 0.05),呈剂量依赖性(图 1)。
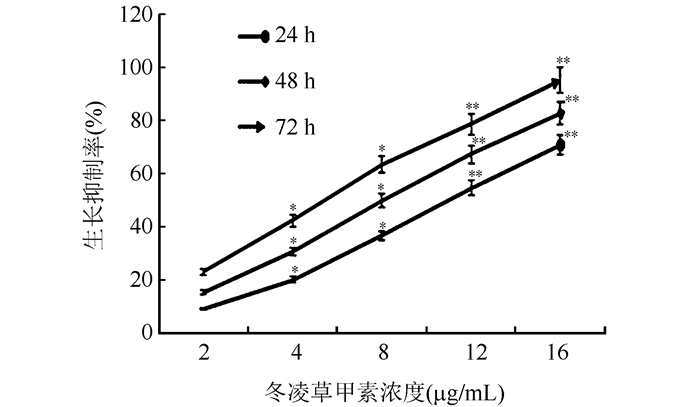
|
| 注 实验重复6次;*与对照组(仅等量0.1% DMSO培养液处理)比较,P < 0.05;**与对照组比较,P < 0.01 图 1 不同浓度冬凌草甲素作用结肠癌LOVO细胞不同时间后对细胞的抑制作用 Fig.1 Inhibition of oridonin at different concentrations on LOVO cells for different time periods |
RT-PCR分析结果显示(图 2A),与对照组比较,不同浓度(4、8和12 μg/mL)冬凌草甲素处理结肠癌LOVO细胞48 h后,E-cadherin mRNA表达水平随冬凌草甲素浓度的升高上调,而Vimentin基因表达量则随冬凌草甲素浓度的增加减少(均P < 0.05)。在12 μg/mL冬凌草甲素作用下E-cadherin和Vimentin的mRNA表达水平变化最显著(均P < 0.01)。
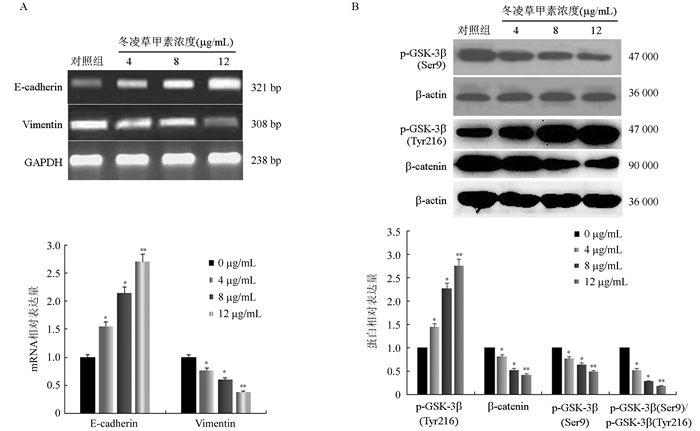
|
| 注 A:E-cadherin和Vimentin基因表达情况;B:p-GSK-3β和β-catenin蛋白表达情况;*与0 μg/mL比较,P < 0.05;**与0、4和8 μg/mL比较,P < 0.05 图 2 结肠癌LOVO细胞经不同浓度冬凌草甲素处理后E-cadherin和Vimentin基因以及p-GSK-3β和β-catenin蛋白表达水平 Fig.2 The expression levels of E-cadherin and Vimentin genes as well as p-GSK-3β and β-catenin proteins in colon cancer LOVO cells treated with oridonin at different concentrations |
结肠癌LOVO细胞经不同浓度(4、8和12 μg/mL)冬凌草甲素处理48 h后(图 2B),蛋白印迹分析结果显示,与对照组比较,p-GSK-3β(Tyr216)蛋白表达量逐渐增加,而p-GSK-3β(Ser9)蛋白表达量逐渐减少,而β-catenin总蛋白表达量也随浓度增加逐渐下降(均P < 0.05),并且该作用随着药物浓度的增加逐渐增强。在12 μg/mL冬凌草甲素作用下这些蛋白表达量差异最显著(均P < 0.01)。
2.4 GSK-3β高特异性抑制剂CHIR对冬凌草甲素处理的LOVO细胞β-catenin、E-cadherin和Vimentin蛋白表达的影响为进一步验证GSK-3β在冬凌草甲素对LOVO细胞的增殖抑制中的作用, GSK-3β特定抑制剂CHIR被用来作为条件对照。实验分四组:空白对照组(加入等量培养液24 h)、CHIR抑制剂组(单用2 μmol/L CHIR处理细胞25 h)、冬凌草甲素组(单用12 μg/mL冬凌草甲素处理细胞24 h)、联合组(先加入2 μmol/L CHIR,1 h后加入12 μg/mL冬凌草甲素处理24 h)。Western blot结果表明,与对照组比较,冬凌草甲素降低β-catenin和Vimentin的蛋白表达水平,而在CHIR的作用下,蛋白表达量较冬凌草甲素组增加(均P < 0.05,图 3)。冬凌草甲素提高LOVO细胞E-cadherin的蛋白表达水平,而CHIR抑制剂能减弱这一效应(P < 0.05)。
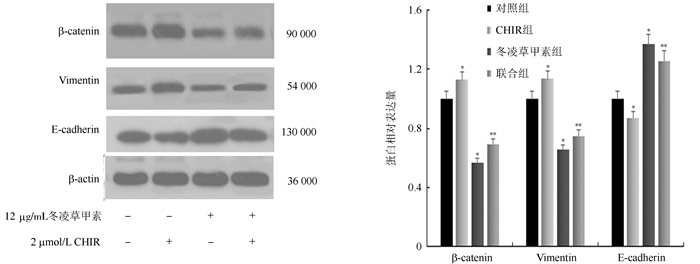
|
| 注 *与对照组比较,P < 0.05;**与冬凌草甲素组比较,P < 0.05 图 3 冬凌草甲素和CHIR作用下LOVO细胞β-catenin、E-cadherin和Vimentin的蛋白表达水平 Fig.3 Protein expression levels of β-catenin, E-cadherin and Vimentin in LOVO cells treated with of oridonin and CHIR |
结直肠癌是威胁人类生命的主要疾病之一。晚期结直肠癌通常转移到邻近组织或远程组织,使得这类癌症无法通过手术切除[14-15]。化疗是晚期结直肠癌的重要治疗手段之一[16],但化疗引起的剧烈恶心、呕吐和毛发脱落等不良反应,不仅增加患者的身体负担,影响生活质量,同时也制约药物的临床使用和疗效。天然药物来源的中药复合物及单体,因其在抗肿瘤治疗中具有高效低毒的特点,目前已逐渐成为抗肿瘤药物研发的热点之一。
冬凌草系唇形科香茶菜属植物,在我国分布广泛。通常取其地上部分入药,味苦甘,性微寒,具有清热解毒、消炎止痛、健胃活血及抗肿瘤等作用。冬凌草主要的化学成分为贝壳杉烯类的二菇,包括冬凌草甲素、乙素、丙素、丁素和戊素等。冬凌草甲素对多种肿瘤细胞均有抑制或杀伤作用,且对人体重要脏器如骨髓、肝和肾等无明显损伤。冬凌草甲素可抑制结肠癌HCT116细胞的增殖和诱导凋亡,并阻滞周期在G2/M期,且其抑制增殖和诱导凋亡可能是通过上调骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)从而激活p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinases,p38MAPK)信号通路发挥作用[17-18]。冬凌草甲素还可通过ROS/JNK/c-Jun信号轴诱导氟尿嘧啶敏感和耐药的结直肠癌细胞凋亡[19-20]。此外,还有研究发现,冬凌草甲素能够下调结肠癌细胞中Wnt/β-catenin信号下游癌基因c-myc的表达水平,从而抑制结肠癌增殖[21]。冬凌草甲素还可以通过Wnt/β-catenin信号通路抑制胰腺癌SW1990细胞迁移和EMT过程[5]。
然而,冬凌草甲素抑制人结直肠癌细胞的作用机制尚待确证。本研究结果表明,冬凌草甲素可能通过调控GSK-3β的活性来下调Wnt/β-catenin信号转导, 以此实现对结肠癌LOVO细胞的增殖活性及EMT过程的抑制作用。
EMT在肿瘤转移和进展中起关键作用。在这一重要的生物学过程中,上皮细胞失去极性和细胞-细胞粘附,这些细胞获得迁移和侵袭性,成为间充质干细胞; 上皮标志物E-cadherin的丢失和间充质标志物Vimentin的获得被认为是EMT的重要特征[22]。越来越多证据显示,EMT在促进肿瘤侵袭和转移方面扮演着重要的角色[23]。E-cadherin、Claudin、β-catenin和细胞角蛋白表达减少, 而间充质细胞标志物Snail、Vimentin和N-cadherin的表达在EMT期间增加[24]。地塞米松在低氧条件下可通过抑制结肠癌细胞株EMT来阻止细胞迁移和侵袭[25]。本研究结果显示,冬凌草甲素增加LOVO细胞中E-cadherin的表达,降低Vimentin的表达,并呈剂量依赖性,表明冬凌草甲素可能通过抑制结肠癌细胞的EMT过程,进而抑制细胞的迁移和侵袭。
Wnt/β-catenin信号通路通过多种生物学过程(包括细胞生长、侵袭和转移、细胞凋亡和分化等)的调控在各种人类癌症进展中扮演重要角色,Wnt/β-catenin通路是触发其下游目标分子EMT、survivin和cyclin D1的一个重要信号通路[26]。在典型Wnt/β-catenin信号转导中,Wnt配体结合到由细胞表面特异性受体卷曲蛋白(Frizzled)受体和辅助受体低密度脂蛋白受体相关蛋白(LRP5/6)组成的双受体复合物,从而导致β-catenin复合体和Axin/APC/GSK-3β的失活,关键的调控者β-catenin被蛋白酶体降解,β-catenin随后聚集在细胞质转位到细胞核中,与转录因子结合调控下游靶基因[27]。Wnt/β-catenin信号通路参与结肠癌的发生。研究显示,与相邻的非肿瘤结直肠黏膜组织比较,结直肠癌组织中,β-catenin过表达[28]。不同β-catenin的表达水平与结直肠癌的侵袭性形态特征、上皮间质转化和预后不良有关[29]。β-catenin的表达下调可抑制结肠癌细胞的增殖和凋亡[30]。本研究也发现,冬凌草甲素抑制LOVO细胞的增殖,并下调β-catenin蛋白的表达水平。相关研究已证实,β-catenin在细胞质中的稳定由Axin/APC/GSK-3β复合体进行调控,β-catenin被具有活性的GSK-3β磷酸化后而降解,从而导致Wnt/β-catenin信号通路的失活[31]。GSK-3β活性水平由其磷酸化状态所调节,Ser-9磷酸化为失活状态,而Tyr-216磷酸化为活化的GSK-3β,p-GSK-3β(Ser9)/ p-GSK-3β(Tyr-216)之比可作为GSK-3β酶蛋白失活的指数。GSK3βY216磷酸化可激活Wnt/β-catenin信号通路[32]。GSK-3β的特异性抑制剂相当于Wnt/β-catenin通路的特异性激活剂[33]。蛋白印迹分析结果显示,与对照组比较,p-GSK-3β(Tyr216)蛋白表达水平增加,而p-GSK-3β(Ser9)和β-catenin总蛋白表达水平均减少(均P < 0.05),并且该作用随着药物浓度的增加逐渐增强,在12 μg/mL冬凌草甲素作用下这些蛋白表达量差异最显著(均P < 0.01)。基于以上研究结果,笔者推测冬凌草甲素引起的GSK-3β失活导致的Wnt/β-catenin信号减弱可能是冬凌草甲素发挥抗结肠癌LOVO细胞作用的主要机制。同时,本研究还采用GSK-3β特异性抑制剂CHIR来验证冬凌草甲素是否通过影响GSK-3β活性的表达进而负调控Wnt/β-catenin信号的传导。与未使用抑制剂的相同浓度冬凌草甲素的结果对照显示,CHIR抑制剂处理后可部分逆转冬凌草甲素引起的β-catenin、Vimentin和E-cadherin的变化,从而表明冬凌草甲素可能通过调控Wnt/β-catenin信号通路来抑制结肠癌细胞的增殖和EMT过程。
综上所述,冬凌草甲素可抑制结肠癌细胞株LOVO的生长和EMT, 进而抑制其侵袭和转移。这可能与冬凌草甲素通过增加结肠癌LOVO细胞GSK-3β活性,进而抑制Wnt /β-catenin通路有关,但更详细的分子传导机制有待进一步深入研究。
| [1] |
Applegate CC, Lane MA. Role of retinoids in the prevention and treatment of colorectal cancer[J]. World J Gastrointest Oncol, 2015, 7(10): 184-203. DOI:10.4251/wjgo.v7.i10.184 |
| [2] |
Gustavsson B, Carlsson G, Machover D, et al. A review of the evolution of systemic chemotherapy in the management of colorect[J]. Clin Colorectal Cancer, 2015, 14(1): 1-10. |
| [3] |
Weaver BA. How Taxol/paclitaxel kills cancer cells[J]. Mol Biol Cell, 2014, 25(17): 2677-2681. |
| [4] |
Owona BA, Schluesener HJ. Molecular insight in the multifunctional effects of oridonin[J]. Drugs in R&D, 2015, 15(3): 233-244. |
| [5] |
Liu QQ, Chen K, Ye Q, et al. Oridonin inhibits pancreatic cancer cell migration and epithelial-mesenchymal transition by suppressing Wnt/β-catenin signaling pathway[J]. Cancer Cell Int, 2016, 16(11): 57. |
| [6] |
Guo Z, Zhou Y, Yang J, et al. Dendrobium candidum extract inhibits proliferation and induces apoptosis of liver cancer cells by inactivating Wnt/β-catenin signaling pathway[J]. Biomed Pharmacother, 2019, 110(2): 371-379. |
| [7] |
Srivastava NS, Srivastava RAK. Curcumin and quercetin synergistically inhibit cancer cell proliferation in multiple cancer cells and modulate Wnt/β-catenin signaling and apoptotic pathways in A375 cells[J]. Phytomedicine, 2019, 52(1): 117-128. |
| [8] |
Xian X, Tang L, Wu C, et al. miR-23b-3p and miR-130a-5p affect cell growth, migration and invasion by targeting CB1R via the Wnt/β-catenin signaling pathway in gastric carcinoma[J]. Onco Targets Ther, 2018, 11(8): 7503-7512. |
| [9] |
Zhang Z, Chang Y, Zhang J, et al. HMGB3 promotes growth and migration in colorectal cancer by regulating WNT/β-catenin pathway[J]. PLoS One, 2017, 12(7): e0179741. DOI:10.1371/journal.pone.0179741 |
| [10] |
Hu HZ, Yang YB, Xu XD, et al. Oridonin induces apoptosis via PI3K/Akt pathway in cervical carcinoma HeLa cell line[J]. Acta Pharmacol Sin, 2007, 28(11): 1819-1826. DOI:10.1111/j.1745-7254.2007.00667.x |
| [11] |
Li X, Li X, Wang J, et al. Oridonin up - regulates expression of P21 and induces autophagy and apoptosis in human prostate cancer cells[J]. Int J Biol Sci, 2012, 8(6): 901-912. DOI:10.7150/ijbs.4554 |
| [12] |
Liang J, Wang W, Wei L, et al. Oridonin inhibits growth and induces apoptosis of human neurocytoma cells via the Wnt/β-catenin pathway[J]. Oncol Lett, 2018, 16(3): 3333-3340. |
| [13] |
Liu Y, Liu YZ, Zhang RX, et al. Oridonin inhibits the proliferation of human osteosarcoma cells by suppressing Wnt/β-catenin signaling[J]. Int J Oncol, 2014, 45(2): 795-803. |
| [14] |
中国医师协会外科医师分会多学科综合治疗专业委员会, 中国抗癌协会大肠癌专业委员会. 结直肠癌肺转移多学科综合治疗专家共识[J]. 实用肿瘤杂志, 2018, 33(6): 487-501. |
| [15] |
Wang J, Du Y, Liu X, et al. MicroRNAs as regulator of signaling networks in metastatic colon cancer[J]. Biomed Res Int, 2015, 2015(823620): 1-12. |
| [16] |
Liu DM, Thakor AS, Baerlocher M, et al. A review of conventional and drug-eluting chemoembolization in the treatment of colorectal liver metastases:principles and proof[J]. Future Oncol, 2015, 11(9): 1421-1428. DOI:10.2217/fon.15.3 |
| [17] |
Liu RX, Ma Y, Hu XL, et al. Anticancer effects of oridonin on colon cancer are mediated via BMP7/p38 MAPK/p53 signaling[J]. Int J Oncol, 2018, 53(5): 2091-2101. |
| [18] |
Ren CM, Li Y, Chen QZ, et al. Oridonin inhibits the proliferation of human colon cancer cells by upregulating BMP7 to activate p38 MAPK[J]. Oncol Rep, 2016, 35(5): 2691-2698. DOI:10.3892/or.2016.4654 |
| [19] |
Gao FH, Liu F, Wei W, et al. Oridonin induces apoptosis and senescence by increasing hydrogen peroxide and glutathione depletion in colorectal cancer cells[J]. Int J Mol Med, 2012, 29(4): 649-655. DOI:10.3892/ijmm.2012.895 |
| [20] |
Zhang D, Zhou Q, Huang D, et al. ROS/JNK/c-Jun axis is involved in oridonin-induced caspase-dependent apoptosis in human colorectal cancer cells[J]. Biochem Biophys Res Commun, 2019, 513(3): 594-601. DOI:10.1016/j.bbrc.2019.04.011 |
| [21] |
Gao FH, Hu XH, Li W, et al. Oridonin induces apoptosis and senescence in colorectal cancer cells by increasing histone hyperacetylation and regulation of p16, p21, p27 and c-myc[J]. BMC Cancer, 2010, 10(6): 610-621. |
| [22] |
Mitra A, Mishra L, Li S. EMT, CTCs and CSCs in tumor relapse and drug-resistance[J]. Oncotarget, 2015, 6(13): 10697-10711. |
| [23] |
陈韡, 于悦, 孙艳霞, 等. Id1和Id3协同诱导结肠癌SW620细胞EMT并影响其侵袭与迁移[J]. 中国肿瘤生物治疗杂志, 2018, 25(10): 987-993. DOI:10.3872/j.issn.1007-385X.2018.10.003 |
| [24] |
Yang YJ, Li ZB, Zhang GR, et al. Snail-induced epithelial-mesenchymal transition in gastric carcinoma cells and generation of cancer stem cell characteristics[J]. Genet Mol Res, 2016, 15(3): 1-13. |
| [25] |
Kim JH, Hwang YJ, Han SH, et al. Dexamethasone inhibits hypoxia-induced epithelial-mesenchymal transition in colon cancer[J]. World J Gastroenterol, 2015, 21(34): 9887-9899. DOI:10.3748/wjg.v21.i34.9887 |
| [26] |
Lee SC, Kim OH, Lee SK, et al. IWR-1 inhibits epithelial-mesenchymal transition of colorectal cancer cells through suppressing Wnt/β-catenin signaling as well as survivin expression[J]. Oncotarget, 2015, 6(29): 27146-27159. |
| [27] |
Clevers H, Nusse R. Wnt/β-catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-205. DOI:10.1016/j.cell.2012.05.012 |
| [28] |
Zhen T, Dai S, Li H, et al. MACC1 promotes carcinogenesis of colorectal cancer via β-catenin signaling pathway[J]. Oncotarget, 2014, 5(11): 3756-3769. |
| [29] |
Gao ZH, Lu C, Wang MX, et al. Differential β-catenin expression levels are associated with morphological features and prognosis of colorectal cancer[J]. Oncol Lett, 2014, 8(5): 2069-2076. DOI:10.3892/ol.2014.2433 |
| [30] |
Yang D, Zhang X, Zhang W, et al. Vicenin-2 inhibits Wnt/β-catenin signaling and induces apoptosis in HT-29 human colon cancer cell line[J]. Drug Des Devel Ther, 2018, 12(18): 1303-1310. |
| [31] |
Bikkavilli RK, Feigin ME, Malbon CC. p38 mitogen-activated protein kinase regulates canonical Wnt/β-catenin signaling by inactivation of GSK3β[J]. J Cell Sci, 2008, 121(21): 3598-3607. DOI:10.1242/jcs.032854 |
| [32] |
Gao CX, Chen GM, Kuan SF., et al. FAK/PYK2 promotes the Wnt/β-catenin pathway and intestinal tumorigenesis by phosphorylating GSK3β[J]. Elife, 2015, 4(e): 10072. |
| [33] |
Tejeda-Muñoz N, Robles-Flores M. Glycogen synthase kinase 3 in Wnt signaling pathway and cancer[J]. IUBMB Life, 2015, 67(12): 914-922. DOI:10.1002/iub.1454 |
 2019, Vol. 34
2019, Vol. 34


