文章信息
- 李武军, 陈志军, 张斌杰, 陈城, 李予林
- Li Wujun, Chen Zhijun, Zhang Binjie, Chen Cheng, Li Yulin
- NLR动态变化对SCLC化疗患者预后的影响
- Effect of dynamic changes of neutrophil-to-lymphocyte ratio on prognosis of patients with small cell lung cancer treated with chemotherapy
- 实用肿瘤杂志, 2019, 34(3): 252-256
- Journal of Practical Oncology, 2019, 34(3): 252-256
-
作者简介
- 李武军(1984-), 男, 浙江岱山人, 主治医师, 从事肺癌及食管癌等的临床诊治研究.
-
通信作者
- 李武军, seainglong23@163.com
-
文章历史
- 收稿日期:2018-02-12
近年来,肺癌发病率急剧上升,其死亡率和发病率均排在恶性肿瘤的首位[1]。其中,有20%左右的肺癌患者为小细胞肺癌(small cell lung cancer,SCLC)。SCLC较非小细胞肺癌(non-small-cell lung cancer,NSCLC)侵蚀性更强,恶性程度更高,生长更迅速,易向远处转移,预后较差。SCLC常见于叶支气管和主支气管,时常伴有纵隔淋巴结和肺门转移[2]。SCLC可根据临床分期选择治疗方案。SCLC易复发且侵蚀性强,故手术治疗并不是主要的治疗方式。一般情况下,局限期SCLC患者采用放化疗联合,广泛期患者则使用以化疗为主的综合性治疗。年龄、性别和肿瘤位置等都是SCLC预后的影响因素。肿瘤中炎性反应指标发挥重要作用。而中性粒细胞与淋巴细胞的比值(neutrophil-to-lymphocyte ratio,NLR)又是有效反映全身炎性反应的指标,故NLR可以作为诊断肿瘤及评估预后的指标。在肿瘤微环境中中性粒细胞具有促进肿瘤抑制免疫的作用,因此NLR的升高表明机体抗肿瘤免疫力降低,从而导致不良预后[3]。本文探讨SCLC患者NLR与临床特征的关系及对预后的影响。
1 资料与方法 1.1 一般资料选取2013年6月至2015年1月在舟山医院接受化疗治疗的90例经细胞学或病理学检测确诊的SCLC患者。所有患者于化疗前检测外周血NLR,依据受试者工作特征(receiver operating characteristic,ROC)曲线得到最佳NLR临界值为3.56。NLR≥ 3.56的患者为高NLR,纳入对照组(n=29),年龄55~72岁,中位年龄57岁;NLR 3.56的患者为低NLR,纳入观察组(n=61),年龄56~74岁,中位年龄58岁。
1.2 纳入和排除标准纳入标准:(1)年龄18~80岁;(2)确诊为SCLC;(3)临床基本资料完整;(4)接受≥1个周期的化疗。排除标准:(1)血液学检查不完善;(2)具有慢性病或全身系统性疾病;(3)随访无法追踪或无病理学依据;(4)有其他肿瘤病史;(5)患有其他感染性疾病、恶性肿瘤及免疫系统疾病的患者;(6)接受过免疫治疗及其他抗肿瘤治疗。
1.3 患者临床分期评估标准T1:肿瘤直径 < 3 cm,对主要支气管无影响,没有扩散到脏层胸膜。T2(具有以下≥1个特点):肿瘤直径≥3 cm; 距离隆突>2 cm,累及主要支气管;扩散到脏层胸膜。T3(具有以下≥1个特点):扩散到纵隔胸膜、膈肌、胸壁或者壁层心包;累及一侧主支气管,距离隆突 < 2 cm且不包含隆突。T4(具有以下≥1个特点):扩散到心脏、食管、纵隔、气管、隆突或脊柱;同一个肺叶里>2个肿瘤结节,存在恶性心包积液或胸腔积液。
1.4 治疗和检测患者化疗方案为铂类结合吉西他滨及恩度。恩度7.5 mg/m2与0.9%氯化钠注射液(normal saline,NS)500 mL,d1~14,静脉滴注3~4 h,21 d为1个周期,共治疗2个周期。铂类结合吉西他滨方案:吉西他滨1 000 mg/m2与NS 500 mL静脉滴注30 min,d1,d8;顺铂80 mg/m2与NS 500 mL静脉滴注2~3 h,d1使用,或d1~3分3 d使用;卡铂300~400 mg/m2与5%葡萄糖注射液(glucose solution,GS) 500 mL静脉滴注2 h,d1~2分2 d使用或d1使用;21 d为1个周期,共治疗2个周期。
患者在化疗前1周和化疗后2周清晨空腹抽取静脉血待检测。所抽取标本保证在患者没有使用影响免疫功能及白细胞的药物的情况下采集,且患者在化疗过程中没有发生急性感染。在化疗前1周和化疗后2周检测患者中性粒细胞计数、外周血白细胞计数、淋巴细胞计数、和血小板计数,在化疗前1周内采用酶联免疫吸附实验(enzyme-linked immunosorbnent assay,ELISA)检测患者癌胚抗原(carcinoembryonic antigen,CEA)水平。计算NLR(中性粒细胞计数/淋巴细胞计数)。收集患者临床资料。ROC曲线得到化疗前NLR的最佳临界值为3.56,此时特异度为82.3%,敏感度为88.3%,ROC曲线下面积最大(图 1)。
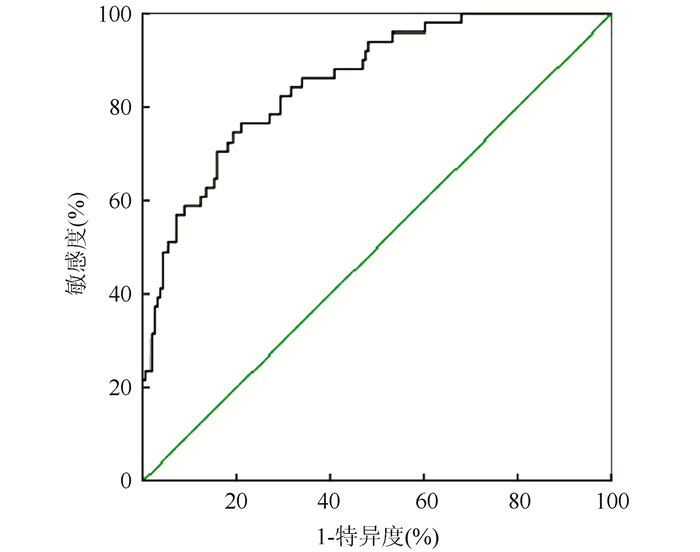
|
| 图 1 小细胞肺癌患者化疗前NLR最佳临界值的ROC曲线 Fig.1 ROC curve of NLR optimal threshold before chemotherapy of small cell lung cancer patients |
通过查阅电子病历、短信或电话方式进行随访。随访内容包括患者复发转移情况、一般情况、后续治疗情况、生存情况和死因等,并记录其无进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)。所有患者第1年每3个月复诊1次,第2年每6个月复诊1次,第3年复诊1次,共随访3年,所有患者均在访。
1.6 统计学分析采用SPSS 20.0软件进行数据分析。计量资料采用均数±标准差(x ± s)表示,组间比较采用t检验。计数资料组间比较采用χ2检验,绘制ROC曲线确定化疗前NLR值的最佳临界值,生存分析采用Kaplan-Meier法。以P < 0.05为差异具有统计学意义。
2 结果 2.1 SCLC患者化疗前NLR水平与临床特征的关系两组患者在年龄、性别、原发肿瘤位置和吸烟史方面比较,差异均无统计学意义(均P>0.05),在化疗前CEA水平和临床分期方面比较,差异均具有统计学意义(均P <0.05)。对照组患者在化疗前CEA水平较高,分期较晚且多为广泛期(表 1)。
| 临床特征 | 对照组 | 观察组 | χ2值 | P值 |
| 性别 | 0.701 | 0.403 | ||
| 男 | 23 | 43 | ||
| 女 | 6 | 18 | ||
| 年龄 | 2.398 | 0.118 | ||
| ≤60岁 | 20 | 33 | ||
| >60岁 | 9 | 28 | ||
| 临床分期 | 9.172 | 0.003 | ||
| 广泛期 | 16 | 18 | ||
| 局限期 | 13 | 43 | ||
| 吸烟史 | 0.371 | 0.544 | ||
| 有 | 17 | 32 | ||
| 无 | 12 | 29 | ||
| 原发肿瘤部位 | 2.729 | 0.097 | ||
| 左肺 | 12 | 31 | ||
| 右肺 | 17 | 30 | ||
| CEA | 4.301 | 0.038 | ||
| >5 μg/L | 10 | 13 | ||
| ≤5 μg/L | 19 | 48 | ||
| 注 CEA:前癌胚抗原(carcinoembryonic antigen) | ||||
对照组和观察组3年PFS生存率分别为34.5%(10/29)和52.5%(32/61),两组比较差异无统计学意义(χ2=3.729,P=0.054);对照组和观察组3年OS生存率分别为41.4%(12/29)和57.4%(35/61),两组比较差异无统计学意义(χ2=3.309,P=0.069)。其中对照组中位PFS和中位OS分别为22.0个月和24.0个月(图 2)。
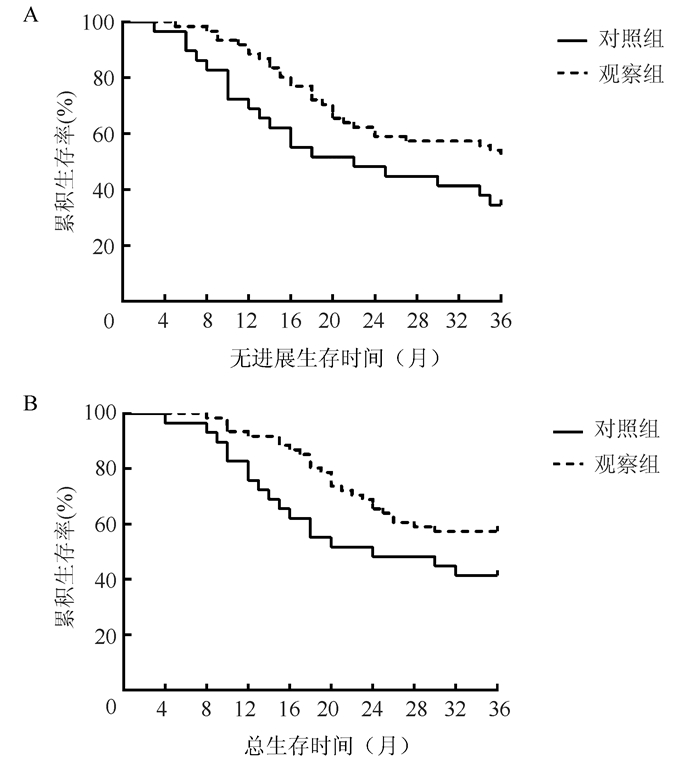
|
| 注 A:无进展生存曲线;B:总生存曲线 图 2 观察组与对照组小细胞肺癌患者生存曲线 Fig.2 Survival curves of patients with small cell lung cancer in the observation group and control group |
根据化疗前、后NLR与临界值3.56的比较情况,将患者分为A、B、C和D组。A组为化疗前、后NLR均≥3.56;B组为化疗前≥3.56、化疗后 < 3.56;C组为化疗前 < 3.56、化疗后≥3.56;D组为化疗前、后均 < 3.56。A、B、C和D组3年PFS生存率分别为18.2%(4/22)、30.0%(6/20)、58.3%(14/24)和75.0%(18/24),四组比较差异有统计学意义(χ2=23.681,P < 0.01);A、B、C和D组3年OS生存率分别为31.8%(7/22)、50.0%(10/20)、66.7%(16/24)和83.3%(20/24),四组比较差异有统计学意义(χ2=15.802,P=0.001)。其中A和B组中位PFS分别为17.0个月和24.5个月,A和B组中位OS为21.0个月和31.0个月(图 3)。
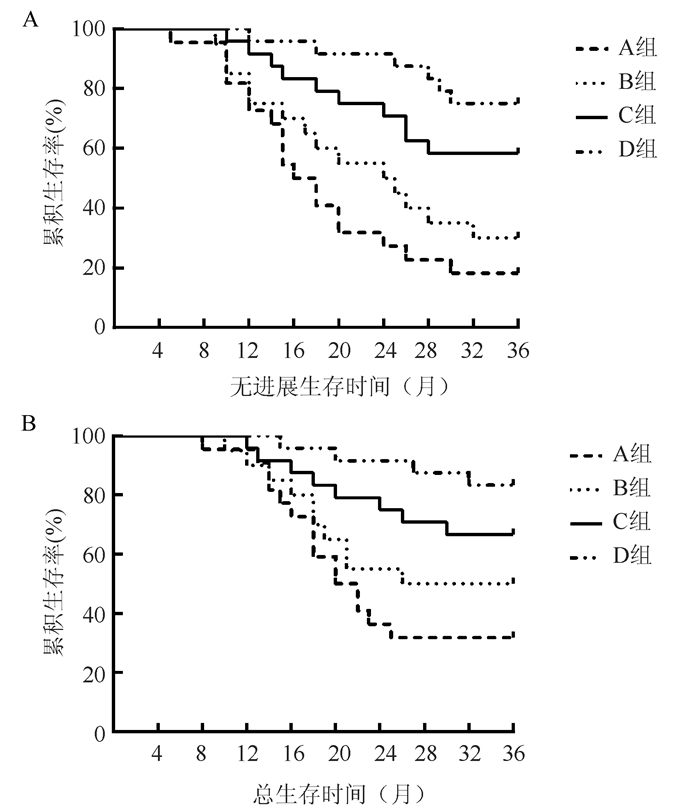
|
| 注 A:无进展生存曲线;B:总生存曲线 图 3 化疗前和化疗后NLR变化对小细胞肺癌患者生存的影响 Fig.3 Effect of NLR changes before and after chemotherapy on the survival of small cell lung cancer patients |
炎性反应在肿瘤研究中占有重要作用。炎性反应分子水平方面的检测方式繁琐复杂,限制其在临床上的应用[4-5]。中性粒细胞和淋巴细胞与肿瘤患者的预后密切相关,因此NLR在肿瘤患者预后的研究中有重要意义[6-7]。NLR作为反映炎性反应的敏感性指标,其值增高表明预后不良。研究表明,NLR可作为肝癌、乳腺癌和结直肠癌等多种肿瘤独立的预后不良影响因素[8]。炎性反应发生时会打破淋巴细胞与中性粒细胞的平衡状态,使机体的免疫状态发生改变,促进肿瘤发展[9-10]。
本研究探讨SCLC患者NLR和临床特征的关系以及对患者预后的影响。本文研究显示,化疗前NLR高的患者分期较晚(广泛期),CEA含量较高;化疗前NLR含量在广泛期、男性患者中较高;与已有研究报道一致[11]。本研究显示,NLR在预测SCLC患者预后中具有重要价值。患者化疗前NLR高提示其预后不良。SCLC患者化疗后外周血白细胞计数、血小板计数、中性粒细胞计数及NLR均降低,但淋巴细胞计数增高。患者炎性反应调节因子和炎性反应激活因子平衡状态发生改变,提示机体免疫炎性反应指标随着化疗而发生变化。传统观点认为,化学药物会引起骨髓抑制,降低外周血细胞数量。但本研究中患者化疗后淋巴细胞计数上升。化疗早期患者体内淋巴细胞减少,但残存的淋巴细胞为保证机体免疫环境的平衡,在短时间内可高效增殖形成自稳性增生,这为肿瘤治疗提供新的研究方向[12-14]。本研究中对照组和观察组患者3年PFS和OS比较,差异均无统计学意义(均P>0.05),提示化疗前NLR分组对预后评估意义不大。综合化疗前、后NLR对所有患者重新进行分组发现,四组3年PFS和OS生存率比较差异均具有统计学意义(均P < 0.05),且表现为A组 < B组 < C组 < D组,说明化疗后NLR对小细胞肺癌患者预后影响较大,提示临床工作者在小细胞癌诊疗过程中须重视化疗前、后NLR值评估,对其预后作出预测,为个体诊疗作出一定贡献。
综上所述,NLR可作为SCLC患者的预后指标,初诊NLR较大的患者预后较差。目前,NLR水平的变化对机体的影响研究仍处于探索阶段,仍需大量前瞻性临床试验探索其对SCLC预后的意义。
| [1] |
凌发昱, 喻东亮. 局部晚期肺癌扩大切除的外科治疗现状[J]. 实用肿瘤杂志, 2018, 33(5): 476-479. |
| [2] |
姜忠于, 胡春秀, 刘学武, 等. 靶向药物治疗对表皮生长因子受体基因不同位点突变的非小细胞肺癌患者预后影响[J]. 中国临床药理学杂志, 2015, 5(23): 2306-2308. |
| [3] |
林晓明, 梁荣, 李淑慧, 等. 预后营养指数对非小细胞肺癌化疗患者的预后价值研究[J]. 中国医师杂志, 2017, 19(6): 876-882. DOI:10.3760/cma.j.issn.1008-1372.2017.06.021 |
| [4] |
Peng B, Wang YH, Liu YM, et al. Prognostic significance of the neutrophil to lymphocyte ratio in patients with non-small cell lung cancer:a systemic review and meta-analysis[J]. Int J Clin Exp Med, 2015, 8(3): 3098-3102. |
| [5] |
倪婧, 王永庆, 张英平, 等. 中性粒细胞/淋巴细胞比值和血小板/淋巴细胞比值在弥漫大B细胞淋巴瘤预后判断中的意义[J]. 中国实验血液学杂志, 2016, 24(2): 427-432. |
| [6] |
李士英, 熊佳时, 何忠惠, 等. 中性粒细胞-淋巴细胞比率与老年NSCLC患者临床病理及预后的相关性分析[J]. 现代生物医学进展, 2017, 17(10): 1846-1848. |
| [7] |
Jafri SH, Shi R, Mills G. Advance lung cancer inflammation index (ALI) at diagnosis is a prognostic marker in patients with metastatic non-small cell lung cancer (NSCLC):a retrospective review[J]. BMC Cancer, 2013, 13(1): 1-7. DOI:10.1186/1471-2407-13-1 |
| [8] |
聂冬, 王若峥, 吾甫尔. 治疗前PLR与NLR在评估新疆维吾尔族鼻咽癌预后价值中的初步探讨[J]. 中国医师杂志, 2016, 18(5): 647-652. DOI:10.3760/cma.j.issn.1008-1372.2016.05.003 |
| [9] |
Xie D, Marks R, Zhang M, et al. Nomograms predict overall survival for patients with small-cell lung cancer incorporating pretreatment peripheral blood markers[J]. J Thorac Oncol, 2015, 10(8): 1213-1220. DOI:10.1097/JTO.0000000000000585 |
| [10] |
Li QQ, Lu ZH, Yang L, et al. Neutrophil count and the inflammation-based glasgow prognostic score predict survival in patients with advanced gastric cancer receiving first-line chemotherapy[J]. Asian Pac J Cancer Prev, 2014, 15(2): 945-950. DOI:10.7314/APJCP.2014.15.2.945 |
| [11] |
黄燚, 刘丹, 李为民, 等. 小细胞肺癌患者中性粒细胞淋巴细胞比值与临床预后的相关因素分析[J]. 西部医学, 2016, 28(1): 109-112. DOI:10.3969/j.issn.1672-3511.2016.01.029 |
| [12] |
Mangla A, Thekkekara R, Yadav U, et al. The association of prechemotherapy neutrophil-lymphocyte ratio with survival in non-small cell lung cancer patients:prevention/screening[J]. Int J Radiat Oncol Biol Phys, 2014, 90(5): 64-67. |
| [13] |
刘亚芳, 邢舴, 宋勇, 等. 不同途径获取肺癌组织对病理类型诊断的差异性分析[J]. 医学研究生学报, 2016, 29(5): 500-503. |
| [14] |
赵建强, 侯予龙, 臧豹, 等. 影响非小细胞肺癌肺叶袖状切除术后患者生存的预后因素分析[J]. 实用肿瘤杂志, 2015, 30(4): 352-355. |
 2019, Vol. 34
2019, Vol. 34


