文章信息
- 杨澎, 朱宇
- Yang Peng, Zhu Yu
- 低位和中高位直肠癌手术方式、并发症及预后比较
- Comparison of operative methods, postoperative complications and prognosis of patients with low rectal cancer and middle-high rectal cancer
- 实用肿瘤杂志, 2019, 34(3): 245-248
- Journal of Practical Oncology, 2019, 34(3): 245-248
-
作者简介
- 杨澎(1981-), 男, 浙江嘉兴人, 主治医师, 硕士, 从事普通外科学临床研究.
-
文章历史
- 收稿日期:2017-11-01
直肠癌是常见恶性肿瘤之一,在消化系统中排名靠前,好发于经济发达地区。近年,我国经济水平快速增长,国民的饮食结构和生活习惯也发生相应改变,直肠癌发病率及死亡率稳定上升,均高于世界平均水平。尽管如此,直肠癌的治疗并无明显进展,手术治疗仍是其最主要的治疗方式,包括腹会阴联合直肠癌根治术(Miles术)、经腹直肠癌切除术(Dixon术)和经腹直肠癌切除+近端造口+远端封闭术(Hartmann术),但手术方法不同,术后并发症、生活质量及预后不尽相同[1-3]。其中,肿瘤位置是选择合适手术方式的关键因素,根据肿瘤与齿状线的位置关系不同,直肠癌分为低位直肠癌和中高位直肠癌[4-5]。本研究拟通过回顾性分析2012年5月至2014年5月于本院诊治的76例低位直肠癌和中高位直肠癌患者的手术方式、术后并发症及预后的不同之处以期更好地为直肠癌的临床治疗提供依据。
1 资料与方法 1.1 一般资料纳入标准:(1)临床表现、实验室检查及病理结果均提示为直肠癌;(2)均接受手术治疗且为同一个团队;(3)遵循直肠癌TNM临床分期标准[6],TNM分期在Ⅰ~Ⅲ期;(4)预期生存期>3个月;(5)患者临床资料及随访资料完整。排除标准:(1)转移性直肠癌;(2)合并其他原发肿瘤。在遵循以上入选标准的基础上,选取收集2012年5月至2014年5月于本院诊治的76例直肠癌患者作为研究对象,根据肿瘤位置不同将其分为低位直肠癌组(齿状线≤5 cm)和中高位直肠癌组(齿状线>5 cm),分别为46例和30例。其中低位直肠癌组:男性31例,女性15例;年龄38~58岁,(45.37±8.09)岁,中位年龄48岁;低分化15例,中高分化31例;TNM临床分期Ⅰ期12例,Ⅱ期25例,Ⅲ期9例。中高位直肠癌组:男性21例,女性9例;年龄40~60岁,(47.12±7.88)岁,中位年龄49岁;低分化10例,中高分化20例;TNM临床分期Ⅰ期7例,Ⅱ期19例,Ⅲ期5例。两组患者在性别、年龄、分化及TNM临床分期等方面比较,差异均无统计学意义(均P>0.05)。
1.2 方法患者主要采用3种手术方式,分别为Miles术、Dixon术和Hartmann术。其中Miles术适用于腹膜返折以下的直肠癌,切除范围包括乙状结肠远端、全部直肠、肠系膜下动脉及其区域淋巴结、全直肠系膜、肛提肌、坐骨肛门窝内脂肪、肛管及肛门周围约5 cm直径的皮肤、皮下组织及全部肛门括约肌,并于左下腹行永久性乙状结肠单腔造口。Dixon术适用于腹膜返折以上的直肠癌,要求肿瘤位于齿状线>5 cm,以能根治、切除肿瘤为原则。Hartmann术则适用于一般情况差,不能耐受Miles术或者急性梗阻不宜进行Dixon术的直肠癌患者。
所有患者临床资料完整,且均得到随访,随访时间从出院后第1天开始计算,第1年每3个月随访1次,第2年每6个月随访1次,随访的主要方式为门诊复诊、电话、微信平台及上门等方式,共随访2年,患者死亡或达到截止日期为止。
1.3 统计学分析采用SPSS 19.0统计学软件作数据分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。生存曲线的绘制采用Kaplan-Meier法,生存率比较采用Log-rank检验。采用χ2检验或秩和检验对预后影响因素进行单因素分析,多因素分析采用Logistic回归分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 两组手术方式比较低位直肠癌组以Miles术(76.1%)为主,而中高位直肠癌组以Dixon术(80.0%)为主。两组在是否采用Hartmann术方面比较,差异无统计学意义(P>0.05,表 1)。
| 组别 | 例数 | Miles术 | Dixon术 | Hartmann术 |
| 低位直肠癌组 | 46 | 35(76.1) | 0(0.0) | 11(23.9) |
| 中高位直肠癌组 | 30 | 0(0.0) | 24(80.0) | 6(20.0) |
| χ2值 | - | 42.312 | 53.785 | 0.160 |
| P值 | - | < 0.01 | < 0.01 | 0.689 |
低位直肠癌组术后并发症以输尿管损伤、排尿功能障碍及性功能障碍为主,而中高位直肠癌组则以肠梗阻和下肢静脉血栓为主(均P < 0.05);但两组在造瘘口瘘或狭窄、感染及切口疝等发生率方面比较,差异均无统计学意义(均P>0.05,表 2)。
| 组别 | 例数 | 造瘘口瘘或狭窄 | 肠梗阻 | 输尿管损伤 | 下肢静脉血栓 | 排尿功能障碍 | 性功能障碍 | 感染 | 切口疝 |
| 低位直肠癌组 | 46 | 6(13.0) | 2(4.3) | 9(19.6) | 1(2.2) | 6(13.0) | 6(13.0) | 7(15.2) | 5(10.9) |
| 中高位直肠癌组 | 30 | 5(16.7) | 7(23.3) | 1(3.3) | 5(16.7) | 0(0.0) | 0(0.0) | 5(16.7) | 5(16.7) |
| χ2值 | - | 0.193 | 6.269 | 4.187 | 5.245 | 4.248 | 4.248 | 0.029 | 0.534 |
| P值 | - | 0.661 | 0.012 | 0.041 | 0.022 | 0.039 | 0.039 | 0.866 | 0.465 |
低位直肠癌组2年生存率为41.3%,中高位直肠癌组2年生存率为66.7%,两组比较差异具有统计学意义(χ2=4.777,P=0.029,图 1)。
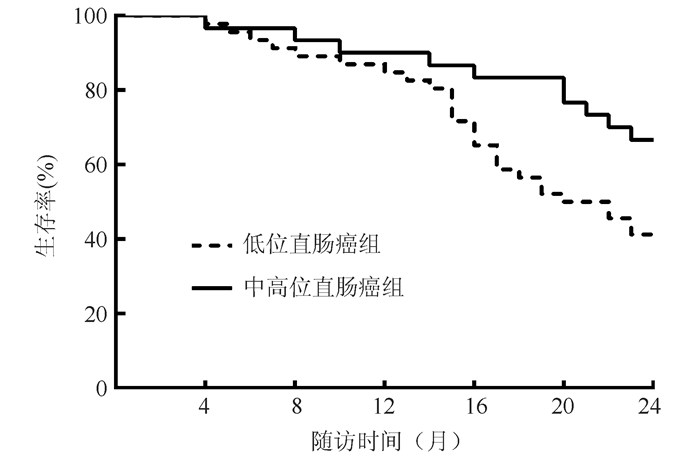
|
| 图 1 低位直肠癌组和中高位直肠癌组总生存比较 Fig.1 Comparison of overall survival between the low rectal cancer group and middle-high rectal cancer group |
经单因素分析得知,直肠癌预后在肿瘤位置、分化情况和淋巴转移方面比较,差异均具有统计学意义(均P < 0.05),但在性别、年龄、手术方式、肿瘤大小及TNM分期方面比较,差异均无统计学意义(均P>0.05,表 3)。
| 临床特征 | 2年生存率(例,%) | χ2值 | P值 |
| 性别 | 0.422 | 0.516 | |
| 男 | 28/52(53.8) | ||
| 女 | 11/24(45.8) | ||
| 年龄 | 0.882 | 0.348 | |
| <45岁 | 20/35(57.1) | ||
| ≥45岁 | 19/41(46.3) | ||
| 肿瘤位置(与齿状线关系) | 4.777 | 0.029 | |
| 低位直肠癌 | 19/46(41.3) | ||
| 中高位直肠癌 | 20/30(66.7) | ||
| 手术方式 | 1.357 | 0.108 | |
| Miles术 | 17/35(48.6) | ||
| Dixon术 | 14/24(58.3) | ||
| Hartmann术 | 8/17(47.1) | ||
| 分化程度 | 5.564 | 0.018 | |
| 低分化 | 8/25(32.0) | ||
| 中高分化 | 31/51(60.8) | ||
| 肿瘤大小 | 1.437 | 0.231 | |
| <3 cm | 20/44(45.5) | ||
| ≥3 cm | 19/32(59.4) | ||
| 淋巴转移 | 4.319 | 0.038 | |
| 是 | 10/28(35.7) | ||
| 否 | 29/48(60.4) | ||
| TNM分期 | 0.605 | 0.322 | |
| Ⅰ期 | 16/19(84.2) | ||
| Ⅱ期 | 23/44(52.3) | ||
| Ⅲ期 | 6/14(42.9) |
多因素分析显示,淋巴转移是影响直肠癌预后的独立因素(P<0.05,表 4)。
| 因素 | β | SE | Wald值 | P值 | OR | 95%CI |
| 肿瘤位置 | 0.883 | 0.615 | 2.738 | 0.053 | 1.442 | 1.222~1.838 |
| 分化情况 | 0.73 | 0.42 | 1.89 | 0.075 | 0.837 | 0.538~1.448 |
| 淋巴转移 | 0.591 | 0.282 | 4.556 | 0.033 | 3.813 | 1.055~4.872 |
肿瘤所处位置不同,其治疗方式、疗效及预后截然不同,因此了解不同位置肿瘤患者的治疗方式、疗效及预后对肿瘤患者至关重要[7]。齿状线位于肛管内面,是由肛瓣和肛柱下端所围成的一个锯齿形环形线,是直肠区别于其他组织器官的最好分界线。在直肠癌中,距齿状线位置不同,其手术方式、术后并发症及预后则不同[8]。
本研究中,低位直肠癌组患者的手术方式主要为Miles术,占76.1%,而中高位直肠癌组患者的手术方式主要为Dixon术,占80.0%,这与刘士凯等[9]研究结果基本一致,显示术前明确与齿状线的位置关系的重要性。本研究发现,低位直肠癌组术后并发症以输尿管损伤、排尿功能障碍及性功能障碍为主,而中高位直肠癌组则以肠梗阻和下肢静脉血栓为主(均P < 0.05),这可能与手术方式的选择相关,低位直肠癌患者多选择Miles术,损伤输尿管及周围神经可能性大,而中高位直肠癌患者多选择Dixon术,离大肠小肠更近,更容易导致肠梗阻,且其血供更丰富,脱落物更容易进入血液循环造成下肢静脉血管栓塞[10-11]。这与廖占国[12]和张清泉等[13]的研究结果基本一致,提示可对此类患者可能发生的术后并发症进行预防处理。此外,本研究还发现,低位直肠癌组2年生存率(41.3%)低于中高位直肠癌组(66.7%);远低于多数研究(多数直肠癌患者2年生存率为60%~80%)[14],这可能是因为术者部分技术细节稍欠缺且不能实施超低位直肠癌切除术。在本研究关于直肠癌预后影响因素的单因素分析中,TNM临床分期Ⅰ~Ⅲ期2年生存率亦低于其他研究者研究结果[15],这可能是因为术者部分技术细节欠缺,且多数患者因个人原因未能在术前及术后接受完整的放化疗或免疫治疗及靶向治疗等新型治疗方案。在本文的单因素及多因素分析中,淋巴转移是影响直肠癌预后的独立危险因素(P < 0.05)。提示在关注肿瘤位置的同时更应关注是否发生淋巴转移,对于已发生淋巴转移的患者在术中应将其处理干净,甚至对可能侵犯淋巴进行预处理,阻断其可能侵袭和转移途径,以更好地改善患者预后。这与郑成军等[16]的研究结果基本一致。
综上所述,直肠癌位置不同,其手术方式、术后并发症及预后相差甚异,淋巴转移是影响其预后的独立危险因素。
| [1] |
李艺伟, 蔡三军. 局部进展期直肠癌综合治疗的临床思考[J]. 实用肿瘤杂志, 2017, 32(2): 105-109. |
| [2] |
刘超, 朱耀明. 直肠癌治疗进展[J]. 中国中西医结合外科杂志, 2015, 21(4): 422-425. DOI:10.3969/j.issn.1007-6948.2015.04.030 |
| [3] |
随凯, 廖国庆, 何茂梁. 不同术式对直肠癌患者免疫功能的影响[J]. 实用肿瘤杂志, 2017, 32(5): 431-434. |
| [4] |
冯鹏才, 杨金煜, 唐明杰, 等. 进展期中低位直肠癌新辅助放化疗后肿瘤部位及手术方式对患者预后的影响[J]. 中国普通外科杂志, 2015, 24(6): 895-898. |
| [5] |
随凯, 廖国庆, 何茂梁. 不同术式对直肠癌患者免疫功能的影响[J]. 实用肿瘤杂志, 2017, 32(5): 431-434. |
| [6] |
韩洪秋, 刘彤, 赵丽中, 等. 国际新的TNM分期对分析结直肠癌预后的临床意义[J]. 中华医学杂志, 2012, 86(12): 819-821. |
| [7] |
王澜, 孔洁, 韩春, 等.不同部位食管癌精确放疗预后分析[C].北京: 中华医学会第九次全国放射肿瘤治疗学学术会议, 2012.
|
| [8] |
Weiser MR, Fichera A, Schrag D, et al. Progress in the PROSPECT trial:precision treatment for rectal cancer?[J]. Bull Am Coll Surg, 2015, 100(4): 51-60. |
| [9] |
刘士凯, 菅书明, 雷周满. 低位直肠癌保肛手术适应证及手术方法选择[J]. 中国实用医药, 2016, 11(1): 47-48. |
| [10] |
李英杰, 武爱文. 低位直肠癌手术并发症及对策[J]. 中国实用外科杂志, 2017, 37(6): 628-633. |
| [11] |
姜可伟, 高志冬. 腹腔镜结直肠手术并发症的预防与处理[J]. 中华胃肠外科杂志, 2015, 18(6): 533-535. DOI:10.3760/cma.j.issn.1671-0274.2015.06.004 |
| [12] |
廖占国. 结直肠癌术后并发症危险因素分析[J]. 山东医药, 2014, 54(22): 61-62. DOI:10.3969/j.issn.1002-266X.2014.22.024 |
| [13] |
张清泉, 黄彬, 任炜, 等. 结直肠癌手术并发症及其影响因素分析[J]. 中华临床医师杂志:电子版, 2013, 7(23): 41-43. |
| [14] |
郑成军, 赵雪云, 王健, 等. 264例直肠癌预后的影响因素分析[J]. 重庆医学, 2014, 36(1): 122-124. |
| [15] |
张利飞, 裴海平. 结直肠癌预后预测研究进展[J]. 中国普通外科杂志, 2015, 24(4): 581-588. |
| [16] |
郑成军, 赵雪云, 王健, 等. 264例直肠癌预后的影响因素分析[J]. 重庆医学, 2014, 43(1): 122-124. |
 2019, Vol. 34
2019, Vol. 34
