文章信息
- 冶秀鹏, 包慎, 郭莹, 魏玉萍, 智峰, 李叶琼, 宋丽君, 牛玉婕, 白洁, 李芳
- 真性红细胞增多症急性髓细胞白血病转化三例
- 实用肿瘤杂志, 2019, 34(2): 172-174
-
基金项目
基金项目:宁夏自然科学基金(2018AAC03174);中央高校青年重点基金(31920140074)
-
作者简介
- 冶秀鹏(1980-), 男, 宁夏回族自治区银川人, 副主任医师, 硕士生, 从事血液肿瘤临床研究.
-
通信作者
- 包慎, E-mail:469968516@qq.com
-
文章历史
- 收稿日期:2017-03-09
真性红细胞增多症(polycythemia vera,PV)是一种起源于造血干细胞的克隆性骨髓增殖性疾病。PV起病隐匿,进展缓慢,晚期可以转化为骨髓纤维化或急性白血病等骨髓增生异常的疾病。现报道3例PV转化为急性髓细胞白血病(acute myeloid leukemia,AML)的病例,以提高临床医师对此类疾病的认识。
1 临床资料病例1患者,男性,53岁,主因头晕、乏力3年余于2011年12月首次收住本院。既往有原发性高血压史10余年,2004年曾患心肌梗死,2006年患脑梗死。2010年体检发现脾大,红细胞增高,未行诊治。2008年曾多次就诊于当地医院,多次查血常规示,血红蛋白>190 g/L;腹部CT检查示,门静脉高压,脾大,诊断为肝硬化,给予保肝治疗。2011年2月患者就诊于外院,血常规示,白细胞7.69×109/L,血红蛋白197 g/L,血小板71×109/L;分子检测显示,BCR-ABL融合基因阴性,JAK2V617F基因突变阳性;骨髓活检示,重度纤维化伴骨硬化症,考虑真红纤维化期;诊断为真性红细胞增多症(简称真红)、骨髓纤维化和骨硬化症。给予α干扰素(3×106 U,2次/周)、羟基脲(0.5 g,2次/d)、骨化三醇胶丸(商品名:罗盖全;0.5 μg,1次/d)和沙利度胺(100 mg,1次/d)等治疗。为进一步诊疗于2011年11月25日就诊于本院。入院查体示,心肺(-),脾大,肋下约4横指;血常规示,白细胞3.93×109/L,中性粒细胞2.13×109/L,红细胞7.71×1012/L,血红蛋白189 g/L,血小板181×109/L;末梢血涂片正常;腹部B型超声示,肝、脾肿大;骨髓活检示,骨髓结构完全破坏,纤维组织重度增生,造血组织少见,骨小梁明显增厚,考虑真红后纤维化期。给予静脉放血和羟基脲(0.5 g,3次/d)等治疗,病情好转后出院。出院后患者规律口服羟基脲(0.5 g,3次/d)、罗盖全(0.25 μg,1次/d)和沙利度胺(100 mg,每晚服用1次)等药物。2012年6月入院复查,血常规示,白细胞1.66×109/L,中性粒细胞0.41×109/L,红细胞7.44×1012/L,血红蛋白180.0 g/L,血小板120×109/L;骨髓活检示,造血组织少见,纤维组织广泛增殖,骨小梁明显增厚;仍诊断为真红后骨髓纤维化、骨硬化症(图 1)。此后多次复查血常规三系进行性下降,白细胞维持在(1.80~3.50)× 109/L,中性粒细胞(0.45~1.35)×109/L,红细胞(5.00~5.83)×1012/L,血红蛋白110~125.0 g/L,血小板(3~10)×109/L。考虑真红后骨髓纤维化造血功能衰竭,遂停用羟基脲,给予重组人血小板生成素(15 000 U,1次/d)和雄激素刺激骨髓造血等治疗。7月21日血常规示,白细胞2.95×109/L,中性粒细胞0.32×109/L,血红蛋白102 g/L,血小板12×109/L;末梢血涂片示,原始细胞23%;骨髓流式细胞术示,符合急性髓系细胞白血病M2免疫表型;诊断为PV后骨髓纤维化、骨硬化症,AML转化(图 2)。给予预激方案GAA(促粒素200 μg/d,吡柔比星10 mg d1~5、阿糖胞苷20 mg d1~7)等治疗,效果欠佳,末梢血涂片原始细胞波动在10%~26%之间,于10月12日死于脑出血。
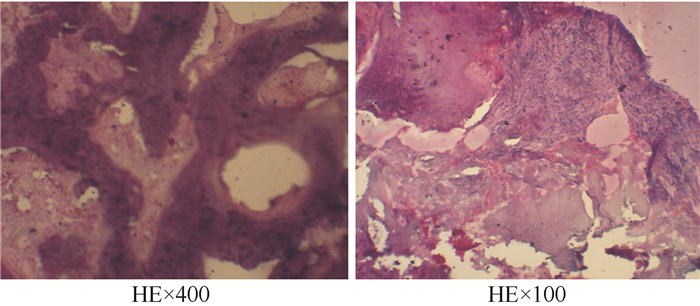
|
| 注 骨髓活检示,纤维组织重度增生,骨小梁明显增厚,骨硬化症. 图 1 例1患者2012年6月11日骨髓活检结果 |
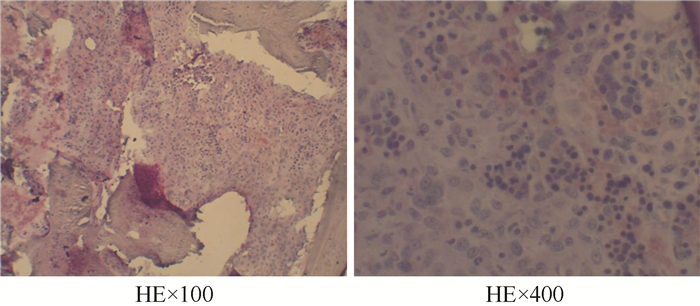
|
| 注 骨髓活检示,残存造血组织中可见白血性原始细胞局灶片状分布. 图 2 例1患者2012年7月23日骨髓活检结果 |
病例2患者,女性,70岁,于2014年3月因发热、咳嗽2 d收住本院。既往于2008年因红细胞增高,多次于外院查血常规示,血红蛋白>180 g/L;分子检测显示,BCR-ABL阴性,JAK2V617F阳性,确诊为真性红细胞增多症,确诊后即长期口服羟基脲(1 g,3次/d)治疗,有高血压及冠心病病史8年余。于2014年3月8日就诊于本院,查体示,贫血貌,脾脏肋下3 cm;血常规示,白细胞16.38×109/L,血红蛋白91 g/L,血小板110×109/L;末梢血涂片示,原始细胞24%;骨髓流式细胞术示,符合急性髓系白血病M2免疫表型;骨髓涂片原始粒细胞77%,提示AML-M2a。骨髓活检示,骨髓增生极度活跃,原始细胞弥漫性浸润,符合AML-M2a。后间断给予HA方案(高三尖杉酯碱2 mg d1~7,阿糖胞苷50 mg d1~7)治疗,效果欠佳。6个月后死于脑出血。
病例3患者,女性,84岁,于2015年5月因发热伴咳嗽3 d收住本院。既往有高血压及冠心病病史8年余。2008年于外院体检发现红细胞增高,血红蛋白20.5 g/L;分子检测示,BCR-ABL阴性,JAK2V617F阳性,确诊为真性红细胞增多症,确诊后即长期口服羟基脲(1 g,3次/d)治疗。2015年5月10日于本院查体示,贫血貌,脾脏肋下5 cm;血常规示,白细胞40.20×109/L,血红蛋白70 g/L,血小板75×109/L;末梢血涂片示,原始细胞28%;骨髓涂片示,原始粒细胞65%,提示AML-M2。骨髓流式细胞术示,符合急性髓系白血病M2免疫表型;骨髓活检示,骨髓增生极度活跃,原始细胞弥漫性浸润,符合AML。由于该病例为高龄患者,5月16日开始间断给予单药高三尖杉酯碱1 mg d1~5及阿糖胞苷10 mg d1~5治疗,效果不佳,5个月后因脑出血死亡。
2 讨论PV是一种原因未明的慢性骨髓增生性肿瘤,西方人年发病率约为1~3/10万,亚洲人发病率更低。以红细胞数量及容量显著增多伴白细胞、血小板升高为特征常伴有脾增大,血栓形成及髓外化生,晚期可发生骨髓纤维化和AML。PV可分为3个阶段:(1)前驱期或多血前期,表现为临界或轻度红细胞增多;(2)明显的多血期;(3)多血后期,以全血细胞减少(包括贫血)和骨髓纤维化以及髓外造血为特点,多血期后骨髓纤维化期,即真红后骨髓纤维化(post-polycythemia vera myelofibrosis,post-PVMF)[1]。
PV发病原因尚不清楚,目前仅明确造血干细胞发生JAK2V617F突变或相关的基因突变,发生率几乎为100%,JAK2基因突变导致细胞因子受体酪氨酸激酶持续激活,使红细胞增殖活性明显增加[2]。PV确诊时通常处于多血期,发病年龄一般为60岁左右,男性多于女性,患者最终会发生致命的并发症,如血栓、出血、转化为post-PVMF或AML血栓事件,多发于>65岁患者,在部分患者中此类症状比血液学特征早出现2年[3]。例1既往曾患心肌梗死及脑梗死,此外这3例患者均患有高血压,也可能系PV引起的症状性高血压。
post-PVMF和AML是疾病进展的2个重要指征。目前还不清楚这些并发症是自然病程的进展,还是与先前的治疗有关。post-PVMF常为终末期并发症,初诊10~15年后发生率为15%~20%,生存>20年者达50%[4]。AML的发病率为1.3%,发生的中位时间为确诊后8.4年。较大年龄、白细胞数目增多、贫血、血小板减少和病程长为转化为白血病的高危因素[5]。本研究例1患者诊断时即处于post-PVMF,骨硬化期,属自然病程的终末期,10年病程后发展为post-PVMF,短期内又转化为AML,说明PV是逐渐进展的慢性造血干细胞恶性克隆性疾病。此患者病史较长,病程转归经历多血期、多血后期和post-PVMF,符合经典真红的发展过程,虽然在post-PVMF后也曾短期应用过羟基脲治疗,但不能肯定疾病转化与羟基脲治疗有关,更可能是因为疾病的自然转归。值得注意的是该患者在进入post-PVMF后并不是因此导致骨髓造血功能衰竭死亡,而是再次转化AML导致死亡,同一患者同时经历2种PV终末期事件是极为少见的。例2及例3患者确诊后即长期应用羟基脲治疗,而并未完整经历PV病理学上的多血后期和post-PVMF这种经典发展过程,在疾病的多血期就直接转化为AML;因此,就不能排除长期应用羟基脲诱发白血病的可能,此2例患者白血病转化不应该是疾病的自然转归。需要考虑羟基脲长期应用对于慢性骨髓增殖性肿瘤无害的观点,这有待今后更多临床研究来证实。
PV的主要治疗方法有静脉放血、羟基脲、α干扰素和靶向药物鲁克替尼等。过去羟基脲被认为是一线治疗性药物,其机制是通过抑制核糖核苷酸还原酶而影响DNA的合成,从而抑制骨髓增殖,理论上有致白血病作用。研究报道,羟基脲有致白血病作用,单用羟基脲治疗PV和原发性血小板增多症(thrombocythemia,ET)并发白血病的发生率为10.5%,多数在用药的前4年发生[6-7]。其诱发白血病的机制[8]可能为:(1)损伤染色体,通过与DNA双螺旋链结合引起DNA交联机会增加,染色体重排、姐妹染色体单体交换,这些染色体的畸形可产生异常的克隆并可发展为肿瘤细胞;(2)细胞免疫异常,化疗药物可引起肿瘤免疫监视的失控[8]。有研究运用羟基脲与单纯放血疗法比较,在白血病转化率及病死率方面差异无统计学意义(均P>0.05)。
PV一旦转化为AML,各种治疗效果均差,患者通常在数月内死亡[9-10]。本研究3例患者在转化为AML后,虽经积极治疗,患者均在短期内死亡。
综上所述,PV是逐渐进展的恶性克隆性疾病,可向骨髓纤维化、骨硬化和AML等转化。转化原因可能是疾病发展的自然病程,但不能排除长期应用羟基脲所致,羟基脲应用的安全性应当受到重视。靶向药物的应用带来新的希望。PV一旦转化为白血病后无良好治疗方法,最佳治疗方案需要进一步探索。
| [1] |
Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390. DOI:10.1182/blood-2016-01-643569 |
| [2] |
Bryan JC, Verstovsek S. Overcoming treatment challenges in myelofibrosis and polycythemia vera:the role of ruxolitinib[J]. Cancer Chemother Pharmacol, 2016, 77(6): 1125-1142. DOI:10.1007/s00280-016-3012-z |
| [3] |
Putra J, Toor A, Noce TA, et al. Multiple liver lesions in a patient with Budd-Chiari syndrome secondary to polycythemia vera[J]. Ann Hepatol, 2015, 14(4): 547-549. |
| [4] |
Björkholm M, Hultcrantz M, Derolf ÅR. Leukemic transformation in myeloproliferative neoplasms:therapy-related or unrelated?[J]. Best Pract Res Clin Haematol, 2014, 27(2): 141-153. DOI:10.1016/j.beha.2014.07.003 |
| [5] |
Hernández-Boluda JC, Pereira A, Gómez M, et al. The International Prognostic Scoring System does not accurately discriminate different risk categories in patients with post-essential thrombocythemia and post-polycythemia veramyelofibrosis[J]. Haematologica, 2014, 99(4): e55-57. DOI:10.3324/haematol.2013.101733 |
| [6] |
Graham A, Milligan G, Manuel L, et al. Symptoms, concomitant conditions and cardiac risk in European hydroxyurea treated polycythemia vera patients[J]. Value Health, 2015, 18(7): A436. |
| [7] |
Alvarez-Larrán A, Kerguelen A, Hernández-Boluda JC, et al. Frequency and prognostic value of resistance/intolerance to hydroxycarbamide in 890 patients with polycythaemia vera[J]. Br J Haematol, 2016, 172(5): 786-793. DOI:10.1111/bjh.2016.172.issue-5 |
| [8] |
Kiladjian JJ, Chevret S, Dosquet C, et al. Treatment of polycythemia vera with hydroxyurea and pipobroman:final results of a randomized trial initiated in 1980[J]. J Clin Oncol, 2011, 29(29): 3907-3913. DOI:10.1200/JCO.2011.36.0792 |
| [9] |
Agarwal MB, Malhotra H, Chakrabarti P, et al. Myeloproliferative neoplasms working group consensus recommendations for diagnosis and management of primary myelofibrosis, polycythemia vera, and essential thrombocythemia[J]. Indian J Med Paediatr Oncol, 2015, 36(1): 3-16. DOI:10.4103/0971-5851.151770 |
| [10] |
陈姣, 王晓冬, 贾永前. 地西他滨对MPN患者JAK2基因表达及突变的影响及临床意义[J]. 实用肿瘤杂志, 2017, 32(1): 48-52. |
 2019, Vol. 34
2019, Vol. 34


