文章信息
- 李晓英, 徐彬, 叶菁菁
- Li Xiaoying, Xu Bin, Ye Jingjing
- 先天性纤维肉瘤的临床特征及影像学表现
- Clinical and imaging characteristics of congenital fibrosarcoma
- 实用肿瘤杂志, 2019, 34(2): 168-171
- Journal of Practical Oncology, 2019, 34(2): 168-171
-
作者简介
- 李晓英(1978-), 女, 浙江杭州人, 主治医师, 硕士, 从事小儿超声诊断研究.
-
通信作者
- 叶菁菁, E-mail:6195005@zju.edu.cn
-
文章历史
- 收稿日期:2018-03-20
先天性纤维肉瘤(congenital fibrosarcoma, CFS)是一种较少见的儿童软组织肿瘤,主要见于新生儿和婴幼儿,虽然生物学行为及预后较好,但延误治疗仍有截肢或远处转移的风险。由于症状缺乏典型性,术前常被误认为良性肿瘤而行一般性的切除,往往导致复发。目前国内外对于CFS的报道较少,且以个案报道为主[1-2]。本文通过对6例经过手术且病理证实的CFS进行回顾性分析,旨在提高对该病的认识。
1 资料与方法收集本院2007年9月至2017年9月期间有影像学检查、手术和病理资料的CFS 6例。其中男性4例,女性2例;年龄25 d~5岁,中位年龄6个月。所有患儿均以发现体表包块就诊。
2 结果 2.1 临床特征6例患儿中头颈部2例(1例头部,1例颈部),下肢2例(1例足背,1例大腿),躯干部2例(1例胸壁,1例背部)。4例刚出生时发现肿块,另2例分别为11个月及4.5岁时查体发现。3例于新生儿期就诊,2例于新生儿期手术,第1次手术与初次发现肿块的时间间隔最长为3年10个月。肿块较固定,边界较清楚,质地较韧,肿物表面皮肤呈紫红色3例(1例表面破溃出血),3例呈正常肤色。均行手术切除, 其中1例破溃出血者行急诊手术。3例复发,复发时间为术后1~8个月,其中2例为局部复发,再次手术切除,术后加化疗,1例随访6个月无复发,1例随访2年无复发,另1例于外院手术治疗后切口感染不愈,在本院行截肢术,术后2个月复发再次行截肢术,最终出现肺转移。术前正确诊断2例,诊断为血管瘤2例,淋巴管瘤1例,错构瘤1例。
2.2 影像学表现6例均行超声检查且均以超声为首选检查方法。肿块首次超声检查最长径为2.7~8.0 cm,(4.7±1.8) cm。6例均为单发软组织肿块。3例位于皮下,3例位于肌层及肌层下。5例表现为边界清楚的实质性肿块,1例边界欠清。回声接近或低于肌肉组织,内回声欠均匀,可见点线状高回声(图 1),部分呈栅栏状结构,未见肿块周围骨质破坏,局部无淋巴结肿大。5例肿瘤内见丰富血流信号,部分见粗大血管回声,1例位于颈部的肿块内仅见少许点状血流信号。局部复发者仍表现为边界清楚的低回声肿块。
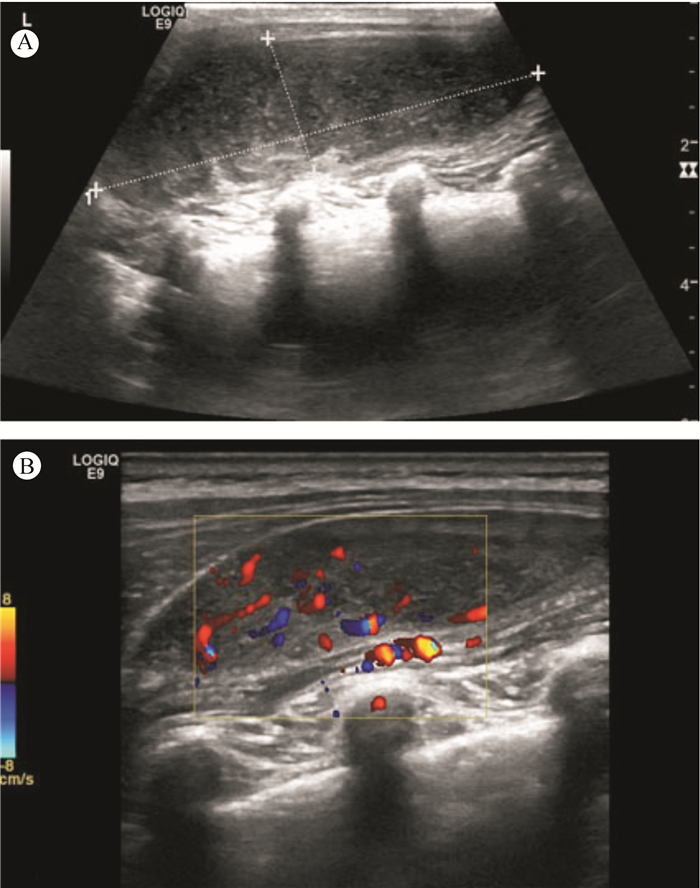
|
| 注 A:肿瘤边界清楚,内回声欠均匀,可见点线状高回声;B:肿瘤内见丰富血流信号. 图 1 4.5岁男性患儿背部肌层先天性纤维肉瘤超声表现 Fig.1 Sonographic findings of a 4.5 year-old boy with congenital fibrosarcoma in the muscle layer of the back |
3例行MRI检查(图 2),2例表现为长T1长T2信号,1例表现为长T1长T2信号为主,局部见短T1短T2信号。病灶与周围软组织分界清,邻近骨骼未见受累。
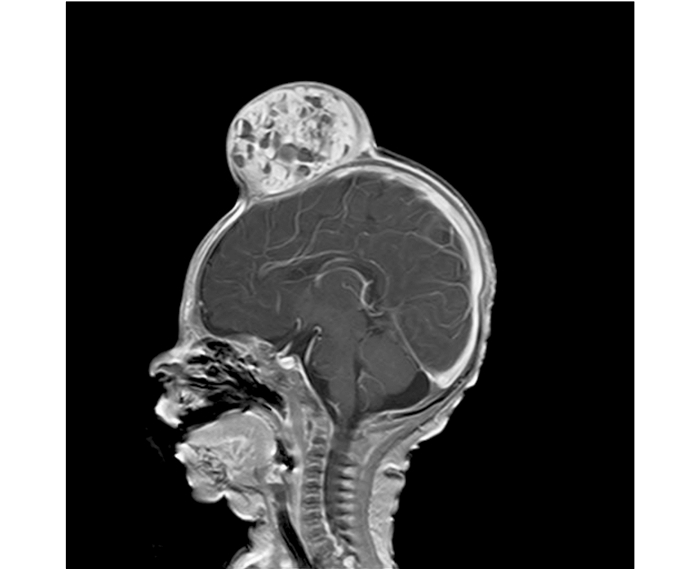
|
| 注 MRI检查示,额顶部头皮软组织内类圆形肿块影,边界清楚,增强肿块呈不均匀强化,与颅内结构未见明显相通. 图 2 25 d男婴MRI检查结果 Fig.2 MRI results of the lesion of a 25-day-old baby boy |
3例行CT检查,平扫肿块2例密度均匀,1例密度欠均匀,未见骨质破坏及钙化灶;动脉期肿块边缘呈环形强化2例(图 3),呈结节状强化1例,静脉期强化程度减弱,延迟期无强化,呈“快进快出”的强化方式。
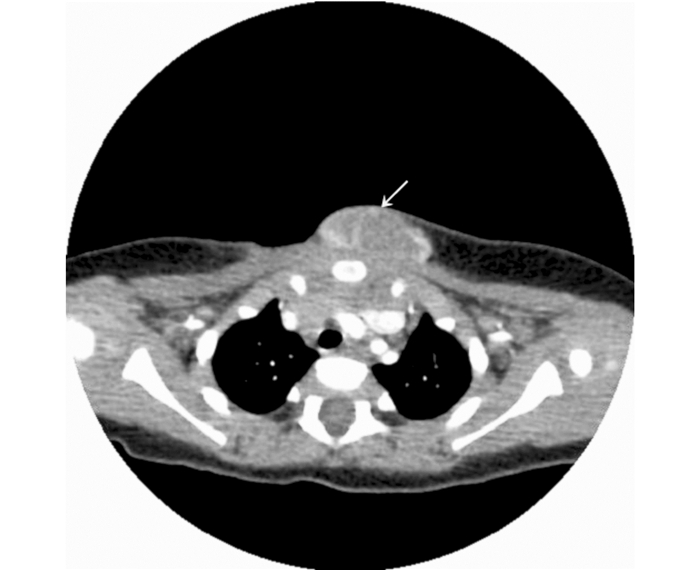
|
| 注 CT检查示,前上胸壁椭圆形软组织密度影(见箭头),边界清,突向体表,注射对比剂后边缘呈环形强化. 图 3 26 d女婴CT检查结果 Fig.3 CT results of the lesion of a 26-day-old baby girl |
镜下见梭形细胞成束状或交叉状排列,富于细胞,核分裂明显,血管丰富。免疫组织化学检查显示,肿瘤细胞均表达波形蛋白(Vimentin),4例平滑肌特异性肌纤蛋白(smooth muscle actin,SMA)阴性,2例SMA局灶阳性,结蛋白(Desmin)和肌动蛋白(Actin)均阴性。
3 讨论婴儿型纤维肉瘤指发生于 < 5岁(特别是≤1岁)的个体的纤维肉瘤,是≤1岁儿童最常见的软组织肉瘤[3],其中36%~80%的病例为先天性,因此又称为先天性纤维肉瘤,男性稍多见[4]。可以发生于任何部位,好发于四肢远端,其次为躯干和头颈部,其他少见的部位有肠系膜和腹膜后等部位。本研究中5例为≤1岁发病,其中4例出生即发现肿块,均发生于较常见部位,男性占66.7%,与已有报道相似[5-6]。
CFS在组织学上与成人典型纤维肉瘤相似,但通常认为其生物学行为显著不同,罕见转移,预后较好[3]。然而其局部却呈侵袭性生长,生长多较迅速,延误治疗易导致切除困难,发生在肢体可导致截肢等不良后果[7],亦有报道出现远处转移[8-9],甚至死亡[10]。本组病例中有1例患儿出生即发现足背肿块,肿块缓慢生长3年后,突然出现加速生长并表面破溃,行截肢手术切除,术后出现复发及肺转移。因此早期确诊可以减少因肿块巨大而行截肢或发生远处转移的风险。临床上婴幼儿的体表包块常以超声作为首选检查方法,因此如果超声能作适当的提示,可以使临床提高警惕,避免延误治疗影响预后。
笔者总结CFS超声表现为边界清楚的实质性肿块,回声接近或低于肌肉组织,内回声欠均匀,可见点线状高回声,部分呈栅栏状结构,局部无淋巴结肿大,肿瘤内多有较丰富血流信号,部分可见较粗大血管。文献[11]报道CFS内部罕见钙化,骨破坏亦少见,在本组6例中均未出现。
CFS在临床上容易与血管瘤相混淆[9, 12]。由于血管瘤在婴幼儿中十分常见,两者外观均可呈紫红色,因此区分存在困难。但是血管瘤质地较柔软,CFS质地较硬,CFS在发现时常体积较大,由于该肿瘤生长活跃,其表面多存在表浅溃疡和静脉曲张,可与血管瘤相区别。超声表现上两者均可呈低回声,但血管瘤多表现为囊实相间的蜂窝状,而CFS质地较实,可见点线状高回声。CFS在增强CT检查中呈“快进快出”的强化特点,无延迟强化,有别于血管瘤。少数病例可被误诊为横纹肌肉瘤。横纹肌肉瘤好发于泌尿生殖道和腹膜后,四肢少见, 恶性度较高,形态较CFS更不规则,预后差,较早发生远处转移等可供鉴别。
CFS的组织学特征为梭形细胞成束状或交叉状排列,富于细胞,血管丰富,免疫组织化学检查示肿瘤细胞表达Vimentin;肌源性标志SMA染色不定.部分呈局灶阳性。
CFS临床首选的治疗方案是肿瘤病灶的广泛切除术,预后较好,即使复发也可再次手术切除。本组中2例术后复发者均再次手术切除,配合术后化疗,分别随访6个月和2年无复发。本病主要死亡原因是肿瘤的浸润性生长造成重要器官的破坏或出血,少见原因为远处转移,因此早期确诊并及时准确的治疗可取得较满意的疗效。
| [1] |
Suzuki T, Murakoshi T, Tanaka K, et al. Sonographic features of congenital infantile fibrosarcoma that appeared as a sacrococcygeal teratoma during pregnancy[J]. J Obstet Gynaecol Res, 2015, 41(8): 1282-1286. DOI:10.1111/jog.v41.8 |
| [2] |
昝星有, 周卫平, 吴鹏西. 盆腔婴儿型纤维肉瘤超声表现1例[J]. 中华超声影像学杂志, 2014, 23(6): 538. DOI:10.3760/cma.j.issn.1004-4477.2014.06.021 |
| [3] |
Orbach D, Brennan B, De Paoli A, et al. Conservative strategy in infantile fibrosarcoma is possible:The European paediatric soft tissue sarcoma study group experience[J]. Eur J Cancer, 2016, 57(2): 1-9. |
| [4] |
Steelman C, Katzenstein H, Parham D, et al. Unusual presentation of congenital infantile fibrosarcoma in seven infants with molecular-genetic analysis[J]. Fetal Pediatr Pathol, 2011, 30(5): 329-337. DOI:10.3109/15513815.2011.587497 |
| [5] |
Enos T, Hosler GA, Uddin N, et al. Congenital infantile fibrosarcoma mimicking a cutaneous vascular lesion:a case report and review of the literature[J]. J Cutan Pathol, 2017, 44(2): 193-200. |
| [6] |
Sargar KM, Sheybani EF, Shenoy A, et al. Pediatric fibroblastic and myofibroblastic tumors:a pictorial review[J]. Radiographics, 2016, 36(4): 1195-1214. DOI:10.1148/rg.2016150191 |
| [7] |
Akyüz C, Sari N, Vargel I, et al. A newborn with infantile fibrosarcoma of foot:treatment with chemotherapy and extremity-sparing surgery[J]. J Perinato, 2010, 30(1): 63-65. DOI:10.1038/jp.2009.92 |
| [8] |
van Grotel M, Blanco E, Sebire NJ, et al. Distant metastatic spread of molecularly proven infantile fibrosarcoma of the chest in a 2-month-old girl:case report and review of literature[J]. J Pediatr Hematol Oncol, 2014, 36(3): 231-233. DOI:10.1097/MPH.0000000000000055 |
| [9] |
Yan AC, Chamlin SL, Liang MG, et al. Congenital infantile fibrosarcoma:a masquerader of ulcerated hemangioma[J]. Pediatr Dermatol, 2006, 23(4): 330-334. DOI:10.1111/pde.2006.23.issue-4 |
| [10] |
Akyüz C, Küpeli S, Varan A, et al. Infantile fibrosarcoma:retrospective analysis of eleven patients[J]. Tumori, 2011, 97(2): 166-169. DOI:10.1177/030089161109700206 |
| [11] |
Ainsworth KE, Chavhan GB, Gupta AA, et al. Congenital infantile fibrosarcoma:review of imaging features[J]. Pediatr Radiol, 2014, 44(9): 1124-1129. DOI:10.1007/s00247-014-2957-5 |
| [12] |
Brockman RM, Humphrey SR, Moe DC, et al. Mimickers of infantile hemangiomas[J]. Pediatr Dermatol, 2017, 34(3): 331-336. DOI:10.1111/pde.2017.34.issue-3 |
 2019, Vol. 34
2019, Vol. 34


