文章信息
- 程萍, 杨飚
- Chen Ping, Yang Biao
- 3D-CRT和SMART同步联合化疗治疗局部中晚期子宫颈癌的疗效及安全性比较
- Comparison of efficacy and safety between 3D-CRT and SMART combined chemotherapy in treatment of locally advanced cervical cancer
- 实用肿瘤杂志, 2019, 34(2): 163-167
- Journal of Practical Oncology, 2019, 34(2): 163-167
-
作者简介
- 程萍(1973-), 女, 湖北十堰人, 副主任医师, 硕士生, 从事妇科肿瘤临床研究.
-
通信作者
- 杨飚, E-mail:13797846501@163.com
-
文章历史
- 收稿日期:2018-01-17
子宫颈癌早期多无特异性症状,相当一部分患者首次确诊即已为中晚期[1]。目前对于局部中晚期子宫颈癌临床首选同步放化疗方案。三维适型调强放射治疗(three dimensional conformal radiation therapy,3D-CRT)方案是应用最广泛的放疗技术之一,已被大量临床研究证实在控制病情进展和延长生存时间方面效果良好,但在治疗过程中需对整个盆腹腔进行照射,易诱发多种放射性并发症,严重影响生活质量[2]。同步推量调强放射治疗(simultaneous modulated accelerated radiation therapy,SMART)是近年来被应用于临床的一种新型放疗技术,在同一照射野下对肿瘤靶区和临床靶区进行差异性分割照射[3]。国外研究显示,SMART方案可提高肿瘤患者病变区域剂量的同时有效减少不良反应发生风险[4]。但国内尚缺乏对局部中晚期子宫颈癌患者的相关随机对照研究。本文旨在探讨3D-CRT和SMART同步联合化疗对局部中晚期子宫颈癌患者近期疗效、生存时间及不良反应的影响,为治疗方案选择提供更多循证依据。
1 资料与方法 1.1 一般资料选取湖北医药学院附属太和医院妇科2012年4月至2014年7月收治的局部中晚期子宫颈癌患者100例,以随机数字表法分为3D-CRT组和SMART组各50例。3D-CRT组年龄39~64岁,中位年龄为54.5岁;高分化11例,中分化17例,低分化22例;根据国际妇产科联盟分期,ⅡB期9例,ⅢA期18例,ⅢB期23例。SMART组年龄41~65岁,中位年龄为55.5岁;高分化13例,中分化18例,低分化19例;根据国际妇产科联盟分期,ⅡB期7例,ⅢA期21例,ⅢB期22例。两组患者年龄、分化程度及临床分期方面比较,差异均无统计学意义(均P>0.05)。
1.2 纳入与排除标准纳入标准:(1)根据子宫颈手术病理活检确诊子宫颈鳞状细胞癌;(2)首次接受放化疗;(3)KPS评分>70分。本研究经医院伦理委员会批准,患者及家属知情同意。排除标准:(1)放化疗禁忌;(2)其他系统恶性肿瘤;(3)盆腹腔淋巴结及远处转移;(4)免疫系统疾病;(5)精神系统疾病;(6)心、脑、肝、肾功能障碍;(7)临床资料不全。
1.3 治疗方法3D-CRT组患者采用3D-CRT方案治疗,即行Varian2300C型直线加速器行盆腔外6 MV X线片照射,2 Gy/次,5次/周,总放疗剂量为48~50 Gy;其中照射野上界为第4~5腰椎,下界为耻骨联合上缘下2 cm,外界为真骨盆股骨头与股骨颈交界处;盆腔外照射10次改为后装放疗,6 Gy/次,1次/周,保证A点和B点总剂量分别为70~85 Gy和50 Gy。
SMART组采用SMART方案治疗。首先完成靶区勾画,其中肿瘤靶体积为原发肿瘤+转移淋巴结区域,临床靶体积为肿瘤靶体积+宫旁组织+阴道上1/2区域+子宫+盆腔淋巴引流区域,计划靶体积区域为临床靶体积向外周扩大0.5 cm,肿瘤同步推靶区为肿瘤靶体积向外周扩大0.5 cm。不同剂量设定为:(1)肿瘤靶体积60~65 Gy;(2)计划靶体积为48~50 Gy;总剂量分为26~28次完成,且保证靶体积内接受处方剂量95%照射,且平均剂量和最大剂量分别<105%和 < 110%。
危及器官剂量设定为:(1)直肠V40<40%;(2)膀胱V40<30%;(3)小肠V30<40%;(4)股骨头V50<5%。盆腔外照射结束后改为后装放疗,6 Gy/次,共3~5次。两组患者化疗方案均为:(1)紫杉醇脂质体90 mg/m2,1次/周;(2)洛铂10 mg静脉滴注,1次/周;用药时间均至放疗结束。
1.4 观察指标随访截止时间为2017年7月1日,中位随访时间为36个月。观察指标:(1)患者随访1年、2年及3年生存情况;(2)患者随访局部复发和远处转移情况;(3)参考美国肿瘤放射治疗协作组不良反应判定标准对不良反应进行评价[5],包括骨髓抑制、消化道反应、放射性直肠炎及放射性膀胱炎。
1.5 疗效评价标准近期疗效判定依据RECIST1.0标准[5],分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD)。其中客观缓解率(objective remission rate,ORR)为CR+PR,疾病控制率(disease control rate,DCR)为CR+PR+SD。
1.6 统计学分析采用SPSS 18.0软件进行数据分析。计数资料以频数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier作生存分析,生存比较采用Log-rank检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 两组患者近期疗效比较SMART组患者ORR和DCR均高于3D-CRT组(均P < 0.05,表 1)。
| 组别 | 例数 | CR | PR | SD | PD | ORR(%) | DCR(%) |
| 3D-CRT组 | 50 | 14 | 16 | 13 | 7 | 60.0 | 86.0 |
| SMART组 | 50 | 25 | 18 | 7 | 0 | 86.0 | 100.0 |
| 注3D-CRT:三维适型调强放射治疗(three dimensional conformal radiation therapy);SMART:同步推量调强放射治疗(simultaneous modulated accelerated radiation therapy);CR:完全缓解(complete response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease);ORR:客观缓解率(objective remission rate);DCR:疾病控制率(disease control rate). | |||||||
两组1年总生存率比较,差异无统计学意义(94.0% vs 88.0%,P>0.05)。SMART组2年和3年总生存率均高于3D-CRT组(88.0% vs 70.0%,70.0% vs 42.0%,均P < 0.05,图 1)。
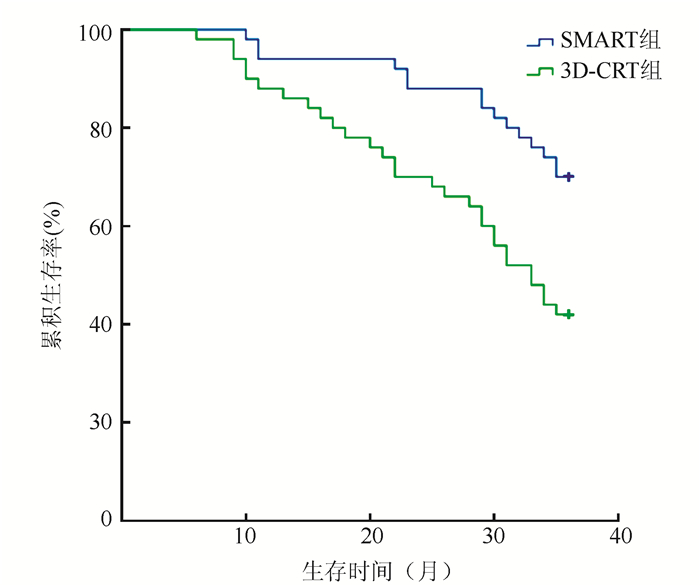
|
| 图 1 SMART组和3D-CRT组患者总生存曲线 Fig.1 Survival curves of the SMART group and the 3D-CRT group |
截止随访结束,SMART组局部复发率和远处转移率均低于3D-CRT组[10.0%(5/50) vs 34.0%(17/50),6.0%(3/50) vs 30.0%(15/50),均P < 0.05]。
2.4 两组患者不良反应发生率比较SMART组患者Ⅰ~Ⅱ级骨髓抑制、放射性直肠炎及膀胱炎发生率均低于3D-CRT组(均P < 0.05)。SMART组Ⅲ~Ⅳ级放射性直肠炎发生率低于3D-CRT组(P < 0.05,表 2)。
| 组别 | 例数 | 骨髓抑制 | 消化道反应 | 放射性直肠炎 | 放射性膀胱炎 | |||||||
| Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | |||||
| 3D-CRT组 | 50 | 24(48.0) | 4(8.0) | 14(28.0) | 0(0.0) | 13(26.0) | 12(24.0) | 8(16.0) | 1(2.0) | |||
| SMART组 | 50 | 9(18.0) | 2(4.0) | 16(32.0) | 1(2.0) | 5(10.0) | 0(0.0) | 1(2.0) | 0(0.0) | |||
| χ2值 | 10.176 | 0.709 | 0.190 | 1.010 | 4.336 | 13.636 | 5.983 | 1.010 | ||||
| P值 | 0.001 | 0.400 | 0.663 | 0.315 | 0.037 | < 0.01 | 0.014 | 0.315 | ||||
| 注3D-CRT:三维适型调强放射治疗(three dimensional conformal radiation therapy);SMART:同步推量调强放射治疗(simultaneous modulated accelerated radiation therapy). | ||||||||||||
目前对于无法手术治疗的局部中晚期子宫颈癌患者同步放化疗是一线治疗方案。临床采用根治性放疗包括盆腔外和腔内照射2个部分[6]。3D-CRT技术无法有效保护盆腔重要脏器,>10%的患者可出现Ⅲ~Ⅳ度放射性损伤,其中放射性直肠炎被认为是导致再次入院的主要原因,给家庭和社会带来极大负担[7-8]。国内外诊疗指南对局部中晚期子宫颈癌放疗技术的应用尚无统一推荐。
传统适形放疗技术可保证放射剂量在三维方向与靶区一致,调节靶区内各点剂量强度确保靶区达到给定的剂量,又使周围正常组织的受量减少;但其在治疗过程中要通过给患者复位进行缩野,且放疗次数多,耗费人力和物力,给患者带来经济负担。SMART通过减少总的治疗时间增加对肿瘤的控制率,可以实现多个不同靶区的不同处方剂量同时进行。SMART方案是一类在调强放疗(intensity modulated radiation therapy,IMRT)基础上给予肿瘤靶区同步推量照射的新型放疗技术,在治疗过程中在给予原发灶区高剂量照射同时辅以亚临床灶和周围扩大区低剂量照射[9]。与传统放疗技术比较,SMART技术在全部治疗过程仅需进行1次计划,可有效缩短模拟计划时间[10]。作为一种加速分割方案,SMART方案能够抑制肿瘤克隆源细胞增殖[11]。此外SMART所具有的束流调强优势还可达到多剂量照射目的,即针对不同肿瘤靶区和周围组织进行差异化照射[12]。SMART方案能够在不缩野追加剂量同时达到给予肿瘤靶体积根治剂量应用的目的,同时临床靶体积仅需接受符合微小或亚临床病灶需要剂量射线照射[13]。本研究结果显示,SMART组ORR和DCR均高于3D-CRT组(均P < 0.05),2年和3年总生存率均高于3D-CRT组(均P < 0.05),局部复发率和远处转移率均低于3D-CRT组(均P < 0.05),证实SMART方案辅助用于局部中晚期子宫颈癌患者治疗在控制病情进展、延长生存时间及降低远期复发转移方面具有优势。两组患者1年总生存率比较,差异无统计学意义(P>0.05),且3D-CRT组患者2年总生存率较以往报道结果更低[14],笔者认为这可能与入选样本量不足有关,故需进一步更大规模临床研究确证。
本研究表明,SMART组患者Ⅰ~Ⅱ级骨髓抑制、放射性直肠炎及膀胱炎发生率均低于3D-CRT组(均P < 0.05),Ⅲ~Ⅳ级放射性直肠炎发生率低于3D-CRT组(P < 0.05)。这提示局部中晚期子宫颈癌患者行SMART方案辅助治疗有助于降低相关放射性并发症发生,与以往报道结果相符,其中SMART组放射性直肠炎多为Ⅰ~Ⅱ级,且发生率仅为14%,且无Ⅲ~Ⅳ级出现,较以往文献结论更低[11]。笔者认为这可能与研究中靶区周围组织预防照射剂量降低有关,而3D-CRT组患者Ⅲ~Ⅳ级放射性直肠炎发生率则为24%。研究显示,骨髓抑制是行同步放化疗局部中晚期子宫颈癌患者常见药物不良反应之一[15]。本研究中,患者以Ⅰ~Ⅱ级不良反应为主,且经对症干预或停药后均恢复;而相较于以往回顾性报道结果[16],本研究患者Ⅲ~Ⅳ级骨髓抑制发生率更低,推测与小剂量洛铂应用(10 mg/次)有关,其常规剂量应为35 mg/m2。
综上所述,相较于3D-CRT方案,SMART方案同步联合化疗治疗局部中晚期子宫颈癌可有效延缓病情进展,提高远期生存率,避免复发转移,并有助于降低不良反应发生风险。但鉴于样本量小、随访时间短及单一中心等因素制约,所得结论还有待更大规模随机对照研究证实。
| [1] |
陈悦, 肖苏, 潘伟. ⅠB2和ⅡA2期子宫颈癌术前近距离放疗联合同步化疗的近期疗效及安全性[J]. 实用肿瘤杂志, 2018, 32(1): 91-94. |
| [2] |
Hass P, Eggemann H, Costa SD, et al. Adjuvant hysterectomy after radiochemotherapy for locally advanced cervical cancer[J]. Strahl Und Onkol, 2017, 193(1): 1-8. DOI:10.1007/s00066-016-1041-5 |
| [3] |
Lee J, Lin JB, Chang CL, et al. Impact of para-aortic recurrence risk-guided intensity-modulated radiotherapy in locally advanced cervical cancer with positive pelvic lymph nodes[J]. Gynecol Oncol, 2017, 33(8): 112-118. |
| [4] |
Datta NR, Rogers S, Klingbiel D, et al. Hyperthermia and radiotherapy with or without chemotherapy in locally advanced cervical cancer:A systematic review with conventional and network meta-analyses[J]. Inte J Hyperth, 2016, 32(7): 809-821. DOI:10.1080/02656736.2016.1195924 |
| [5] |
陈惠祯, 蔡红兵. 现代妇科肿瘤学[M]. 武汉: 湖北科学技术出版社, 2006: 206-207.
|
| [6] |
周晖, 林仲秋. 子宫颈癌治疗进展和争议问题[J]. 实用肿瘤杂志, 2016, 31(6): 494-496. |
| [7] |
Bailleux C, Falk AT, Chand-Fouche ME, et al. Concomitant cervical and transperineal parametrial high-dose-rate brachytherapy boost for locally advanced cervical cancer[J]. J Contemp Brachythe, 2016, 8(1): 23-28. |
| [8] |
Zhang WZ, Zhai TT, Lu JY, et al. Volumetric modulated arc therapy vs C-IMRT for the treatment of upper thoracic esophageal cancer[J]. PLoS One, 2015, 10(3): 1-11. |
| [9] |
Datta NR, Stutz E, Liu M, et al. Concurrent chemoradiotherapy vs radiotherapy alone in locally advanced cervix cancer:A systematic review and meta-analysis[J]. Gynecol Oncol, 2017, 145(2): 374-385. DOI:10.1016/j.ygyno.2017.01.033 |
| [10] |
Heijkoop ST, van Doorn HC, Stalpers LJ, et al. Results of concurrent chemotherapy and hyperthermia in patients with recurrent cervical cancer after previous chemoradiation[J]. Int J Hyperthermia, 2014, 30(1): 6-10. DOI:10.3109/02656736.2013.844366 |
| [11] |
Renard-oldrini S, Guinement L, Salleron J, et al. Dosimetric comparaison between VMAT and tomotherapy with paraaortic irradiation for cervix carcinoma[J]. Cancer Radiother, 2015, 19(8): 733-738. DOI:10.1016/j.canrad.2015.05.031 |
| [12] |
Sharfo AW, Voet PW, Breedveld S, et al. Comparison of VMAT and IMRT strategies for cervical cancer patients using automated planning[J]. Radiother Oncol, 2015, 114(3): 395-401. DOI:10.1016/j.radonc.2015.02.006 |
| [13] |
Hegazy MW, Mahmood RI, Albadawi IA, et al. Radiotherapy dose escalation with concurrent chemotherapy in locally advanced cervix cancer is feasible[J]. Clin Translat Oncol, 2016, 18(1): 58-64. DOI:10.1007/s12094-015-1336-5 |
| [14] |
Hansen H, Hogdall C, Engelholm S. Radiation therapy without cisplatin for elderly cervical cancer patients[J]. Int J Radiat Oncol Biol Phys, 2014, 90(Suppl 1): S484-485. |
| [15] |
Umayahara K, Takekuma M, Hirashima Y, et al. Phase Ⅱ study of concurrent chemoradiotherapy with weekly cisplatin and paclitaxel in patients with locally advanced uterine cervical cancer:The JACCRO GY-01 trial[J]. Gynecol Oncol, 2016, 14(2): 253-258, 712. |
| [16] |
Jia MX, Zhang X, Yin C, et al. Peripheral dose measurements in cervical cancer radiotherapy:a comparison of volumetric modulated arc therapy and step-and-shoot IMRT techniques[J]. Radiat Oncol, 2014, 7(1): 1-7. |
 2019, Vol. 34
2019, Vol. 34


