文章信息
- 魏志力, 张毅
- Wei Zhili, Zhang Yi
- 术前血清CA19-9和CEA联合升高与胆囊癌术后生存期的相关性研究
- Preoperative serum CA19-9 and CEA levels in predicting survival of gallbladder cancer patients after surgical treatment
- 实用肿瘤杂志, 2019, 34(2): 151-154
- Journal of Practical Oncology, 2019, 34(2): 151-154
-
作者简介
- 魏志力(1975-), 男, 陕西咸阳人, 副主任医师, 硕士, 从事肝胆肿瘤临床研究.
-
通信作者
- 张毅, E-mail:zhangyi9662@163.com
-
文章历史
- 收稿日期:2018-03-09
胆囊癌是胆管系统最常见的恶性肿瘤,占胆管系统肿瘤的80%~95%,恶性程度高,预后差,5年生存率 < 5%[1]。术前血清肿瘤标志物水平是预测胆囊癌患者生存期的有效指标。糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)是一种黏蛋白,在胰腺癌、胃癌和胆管癌患者中可显著升高[2]。而癌胚抗原(carcinoembryonic antigen,CEA)是一种广谱肿瘤标志物,在消化道肿瘤、胰腺癌、胆管癌和正常胚胎组织中均可升高。尽管CEA的升高反映恶性肿瘤存在的可能性,但CEA对胆管癌(尤其是胆囊癌)的特异度和敏感度均较差[3]。CA19-9和CEA的联合应用是评估胰腺癌患者预后的最优指标[4-5]。已有研究报道CA19-9或CEA在胆囊癌中的预后评估价值[6]。但目前尚无研究报道CEA和CA19-9的联合应用在预测胆囊癌患者预后评估中的价值。本研究主要评估CEA和CA19-9在胆囊癌患者术后预后评估的临床价值。
1 资料与方法 1.1 一般资料回顾性分析本院2005年1月至2012年12月接受胆囊癌根治术的患者的临床资料,纳入标准为经术后石蜡病理证实为胆囊癌且不伴其他恶性肿瘤的患者,排除标准为转移性胆囊癌、未行手术治疗、病例资料不全和围手术期死亡的患者。共107例患者纳入本研究,年龄38~86岁,(59.2±9.0)岁,中位年龄57岁。其中男性39例(36.4%),女性68例(63.6%);41例(38.3%)术前存在黄疸;TNM分期Ⅰ期43例(40.2%),Ⅱ期33例(30.8%),Ⅲ期24例(22.9%),Ⅳ期7例(6.5%);胆囊腺癌95例(88.2%),非腺癌12例(11.2%);低分化癌20例(18.7%),中高分化癌87例(81.3%);R0切除76例(71.0%),R1切除31例(29.0%)。
1.2 分组情况根据术前CA19-9及CEA正常参考值上限为阈值,将CA19-9≥37 U/mL和CEA≥5 mg/L定义为血清CA19-9和CEA异常升高。据此将患者分为三组:CA19-9 < 37 U/mL且CEA < 5 mg/L者为A组,共40例(37.4%);CA19-9≥37 U/mL且CEA < 5 mg/L者以及CA19-9 < 37 U/mL且CEA≥5 mg/L者为B组,共42例(39.3%);CA19-9≥37 U/mL且CEA≥5 mg/L者为C组,共25例(23.4%)。
1.3 随访通过门诊及病史系统对患者进行随访,随访时间截止至2017年12月。以患者手术日期到患者死亡或最后1次失访时间作为总生存期(overall survival,OS)。所有患者的中位随访时间48个月(1~121个月)。随访结束时,89例(83.2%)患者死亡,18例(16.8%)患者生存。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析。计数资料以频数(百分比)表示,采用秩和(χ2)检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under curve,AUC)分析各标志物对患者生存预后评估的准确性。通过Kaplan-Meier生存曲线分析患者的生存率,并以Log-rank检验比较两组患者间的生存率差异。多因素Cox风险模型用于分析各项参数与胆囊癌患者的预后关联。以P < 0.05为差异具有统计学意义。
2 结果 2.1 CA19-9联合CEA分组患者的术后生存情况所有107例患者的中位随访时间为48个月(1~121个月),术后1、3和5年OS分别为46.7%、24.3%和8.4%。C组R0切除率与A组和B组比较,差异均具有统计学意义(均P < 0.01)。A组、B组和C组中位OS分别为26个月、12个月和5个月,术后1、3和5年OS比较,差异均具有统计学意义(均P < 0.05,表 1,图 1)。
| 组别 | 例数 | R0切除率 | 中位总生存时间(月) | 总生存率 | ||
| 1年 | 3年 | 5年 | ||||
| A组 | 40 | 34(86.0) | 26 | 26(65.0) | 18(45.0) | 8(20.0) |
| B组 | 42 | 31(73.0) | 12 | 19(45.2) | 7(16.7) | 1(2.4) |
| C组 | 25 | 11(45.0) | 5 | 5(23.8) | 1(4.8) | 0(0.0) |
| χ2值 | 28.740 | 34.803 | 12.577 | 16.249 | 11.252 | |
| P值 | < 0.01 | < 0.01 | 0.002 | < 0.01 | 0.004 | |
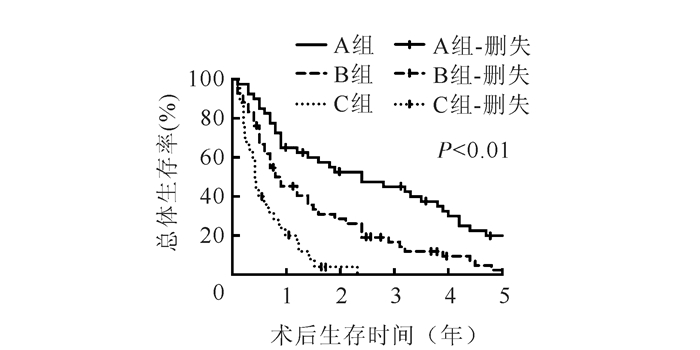
|
| 图 1 A组、B组和C组胆囊癌患者根治术后总生存曲线 Fig.1 Overall survival curve after radical operation in patients with gallbladder cancer in group A, B and C |
通过单因素和多因素Cox回归分析证实,术前黄疸、CA19-9和CEA联合指标、手术切缘、肿瘤分化程度和TNM分期等是影响胆囊癌患者术后生存期的独立影响因子(均P < 0.05, 表 2)。
| 因素 | 单因素分析 | 多因素分析 | |||
| HR(95% CI) | P值 | HR(95% CI) | P值 | ||
| 年龄(≥65岁vs < 65岁) | 1.20(0.87~1.44) | 0.156 | - | ||
| 性别(男vs女) | 0.91(0.74~1.23) | 0.467 | - | ||
| 术前黄疸(有vs无) | 2.44(1.81~2.91) | < 0.01 | 1.43(1.11~1.92) | 0.011 | |
| AFP (≥20 μg/L vs < 20 μg/L) | 1.04(0.67~1.39) | 0.833 | - | ||
| 联合指标(A组vs B组vs C组) | 2.12(1.53~2.96) | < 0.01 | 1.65(1.24~2.03) | < 0.01 | |
| 手术切缘(R0 vs R1) | 0.76(0.56~0.84) | 0.008 | 0.86(0.69~0.92) | 0.040 | |
| 病理分型(腺癌vs非腺癌) | 0.84(0.68~1.19) | 0.222 | - | ||
| 肿瘤分化程度(低分化vs中高分化) | 1.92(1.64~2.51) | < 0.01 | 2.21(1.89~2.95) | < 0.01 | |
| TNM分期(Ⅲ~Ⅳ期vs Ⅰ~Ⅱ期) | 5.84(3.40~9.24) | < 0.01 | 5.13(2.08~8.64) | < 0.01 | |
| 注AFP:甲胎蛋白(alpha fetoprotein). | |||||
通过术后1、3和5年ROC曲线及AUC判断各项肿瘤标志物对胆囊癌患者术后预后的预测价值,CA19-9联合CEA的预测价值在各时间点均高于甲胎蛋白(alpha fetoprotein,AFP)、CA19-9或CEA(表 3)。
| 血清标志物 | 术后1年 | 术后3年 | 术后5年 |
| AFP | 0.483 | 0.592 | 0.599 |
| CA19-9 | 0.681 | 0.755 | 0.771 |
| CEA | 0.642 | 0.703 | 0.765 |
| CA19-9联合CEA | 0.690 | 0.821 | 0.892 |
| 注AFP:甲胎蛋白(alpha fetoprotein);CA19-9:糖类抗原19-9(carbohydrate antigen 19-9);CEA:癌胚抗原(carcino-embryonic antigen). | |||
CA19-9和CEA是胆囊癌患者术前诊断和检测术后肿瘤复发的最常用血清肿瘤标志物。已有研究表明,联合CA19-9和CEA的检测能够提高胆囊癌的诊断率[7],但对胆囊癌患者预后评估价值尚无报道。本研究结果表明,术前CA19-9和CEA的联合评估是预测胆囊癌患者术后短期和长期生存预后的有效指标。时间依赖性的ROC曲线可以评估术前血清标志物水平对患者术后不同时间的生存情况的预测价值[8-9]。本研究中,术前CA19-9或CEA水平对胆囊癌患者术后1、3和5年的预测价值均高于术前AFP水平,联合术前CA19-9和CEA水平对胆囊癌患者术后各随访时间点的生存预测价值高于单用CA19-9或CEA。
本研究入组的胆囊癌患者中,术前CA19-9和CEA均处于正常范围内的胆囊癌患者术后1、3和5年OS均最高,而术前CA19-9和CEA同时升高的患者术后1、3和5年OS均最低。目前手术切除是胆囊癌患者获得长期生存的主要治疗方式,尤其是R0切除。但胆囊癌患者确诊时多处于肿瘤进展期或晚期阶段,仅 < 10%的患者能够接受手术治疗,5年OS < 5%[10]。本研究发现,术前CA19-9和CEA同时升高的胆囊癌患者的R0切除率为45.0%,而中位OS仅为5个月,术后1和3年OS仅为23.8%和4.8%。因此胆囊癌患者(尤其是术前CA19-9和CEA同时升高的患者)应尽早开展术后辅助化疗。如有研究显示,胆囊癌患者术后接受吉西他滨联合奥沙利铂或顺铂等化疗方案能够提高中位OS[11-13]。
术前新辅助化疗的应用可潜在延长胆囊癌患者的长期生存率[14]。尽管较早期的研究认为,新辅助化疗对胆囊癌患者的预后改善无明显优势[15],但Agrawal等[16]发现,不可切除性胆囊癌患者采取新辅助治疗后能够提高手术可切除率和R0切除。Selvakumar等[17]认为,胆囊癌患者行新辅助化疗后进行手术切除,能够有效改善生存预后和生活质量。结合本研究结果,笔者认为针对术前CA19-9和CEA同时升高的胆囊癌患者,术前可采取新辅助化疗以提高肿瘤降期的可能,提高R0切除率,延长生存期。
由于胆囊癌发病率较低,本研究纳入的病例数相对较少,不可避免地受到选择偏倚的影响。但笔者认为,尽管胆囊癌的发病率低,但其恶性程度极高,患者的生存预后极差,因此对于确诊胆囊癌的患者,如何有效预测其预后和改善预后在临床上尤为重要,尤其是采用个体化治疗方案,以提高胆囊癌患者的R0切除率。
综上所述,本研究证实,术前CA19-9和CEA的同时升高是预测胆囊癌患者术后生存预后较差的危险因素。针对这类患者,可在术前及术后采取个体化治疗方案来改善患者预后。
| [1] |
Hundal R, Shaffer EA. Gallbladder cancer:epidemiology and outcome[J]. Clin Epidemiol, 2014, 6(1): 99-109. |
| [2] |
蒙秀坚, 陈秀勤, 陆爱英, 等. 血清肿瘤标志物CA19-9的临床应用研究[J]. 国际检验医学杂志, 2014, 35(12): 1566-1567. DOI:10.3969/j.issn.1673-4130.2014.12.019 |
| [3] |
Grunnet M, Mau-Sørensen M. Serum tumor markers in bile duct cancer——a review[J]. Biomarkers, 2014, 19(6): 437-443. DOI:10.3109/1354750X.2014.923048 |
| [4] |
Zhang Y, Yang J, Li H, et al. Tumor markers CA19-9, CA242 and CEA in the diagnosis of pancreatic cancer:a meta-analysis[J]. Int J Clin Exp Med, 2015, 8(7): 11683-11691. |
| [5] |
宋文渊, 吴雷, 赵红岩, 等. 外周血内CA19-9、CA242及CEA对胰腺癌诊断及病理分期评估的价值[J]. 实用肿瘤杂志, 2017, 32(1): 52-56. |
| [6] |
耿智敏, 王林, 陈晨, 等. 438例胆囊癌外科治疗及预后因素分析[J]. 中华消化外科杂志, 2016, 15(4): 346-352. DOI:10.3760/cma.j.issn.1673-9752.2016.04.008 |
| [7] |
高磊, 谌松霖, 王光霞. 超声联合CA19-9及CEA检测对胆囊癌早期诊断准确性的影响[J]. 中国中西医结合外科杂志, 2017, 23(3): 239-242. DOI:10.3969/j.issn.1007-6948.2017.03.005 |
| [8] |
Nishikawa H, Nishijima N, Enomoto H, et al. Predictive factors in patients with hepatocellular carcinoma receiving sorafenib therapy using time-dependent receiver operating characteristic analysis[J]. J Cancer, 2017, 8(3): 378-387. DOI:10.7150/jca.16786 |
| [9] |
Tada T, 何丽丽, 李婉玉. HBcrAg为肝细胞癌发展的预测因子[J]. 临床肝胆病杂志, 2016, 32(7): 1405. |
| [10] |
Groot Koerkamp B, Fong Y. Outcomes in biliary malignancy[J]. J Surg Oncol, 2014, 110(5): 585-591. DOI:10.1002/jso.v110.5 |
| [11] |
Singh SK, Talwar R, Kannan N, et al. Aggressive surgical approach for gallbladder cancer:a single-center experience from Northern India[J]. J Gastrointest Cancer, 2015, 46(4): 399-407. DOI:10.1007/s12029-015-9766-4 |
| [12] |
Sharma A, Dwary AD, Mohanti BK, et al. Best supportive care compared with chemotherapy for unresectable gallbladder cancer:a randomized controlled study[J]. J Clin Oncol, 2010, 28(30): 4581-4586. DOI:10.1200/JCO.2010.29.3605 |
| [13] |
黄勇, 刘峰, 姜斌. 替吉奥或顺铂联合吉西他滨治疗进展期胆囊癌临床观察[J]. 中华肿瘤防治杂志, 2015, 22(14): 1134-1137. |
| [14] |
孟强劳, 王林, 耿智敏. 进展期胆囊癌新辅助化疗研究进展[J]. 中华肝胆外科杂志, 2017, 23(11): 789-792. DOI:10.3760/cma.j.issn.1007-8118.2017.11.017 |
| [15] |
De AX, Losada H, Mora J, et al. Neoadjuvant chemoradiotherapy in gallbladder cancer[J]. Rev Med Chi, 2004, 132(1): 51-57. |
| [16] |
Agrawal S, Mohan L, Neyaz Z, et al. Radiological downstaging with neoadjuvant therapy in unresectable gall bladder cancers[J]. Asian Pac J Cancer Prev, 2015, 17(4): 2137-2140. |
| [17] |
Selvakumar VP, Zaidi S, Pande P, et al. Resection after neoadjuvant chemotherapy in advanced carcinoma of the gallbladder:a retrospective study[J]. Indian J Surg Oncol, 2015, 6(1): 16-19. DOI:10.1007/s13193-015-0377-0 |
 2019, Vol. 34
2019, Vol. 34


