文章信息
- 陈佳栋, 罗天航, 孙颢, 沈浩, 章盛平, 薛绪潮
- Chen Jiadong, Luo Tianhang, Sun Hao, Shen Hao, Zhang Shengping, Xue Xuchao
- CXCR4及VEGF-C在胃癌组织中的表达及其意义
- Expression and significance of CXCR4 and VEGF-C in gastric carcinoma
- 实用肿瘤杂志, 2019, 34(2): 146-150
- Journal of Practical Oncology, 2019, 34(2): 146-150
-
作者简介
- 陈佳栋(1983-),男,江苏江阴人,主治医师,从事胃肠道肿瘤诊治临床研究.
-
通信作者
- 薛绪潮, E-mail:xuexch@163.com
-
文章历史
- 收稿日期:2018-05-20
2. 静安区中心医院普外科, 上海 200040
2. Department of General Surgery, Jing'an District Central Hospital, Shanghai 200040, China
胃癌是消化道常见恶性肿瘤,在全球癌症死亡原因中居第2位[1]。胃癌细胞的侵袭和转移是患者死亡的主要原因[2-3]。研究胃癌侵袭转移机制对于早期干预、后期治疗和提高疗效具有重要意义。肿瘤细胞可限定表达某些趋化因子或趋化因子受体,提示趋化因子及受体与肿瘤侵袭和转移密切相关[4],然而趋化因子受体在胃肿瘤中的表达无确定结论[5]。本研究采用免疫组织化学和RT-PCR检测胃癌组织中CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)和血管内皮生长因子C(vascular endothelial growth factor C, VEGF-C)蛋白和mRNA的表达差异,分析CXCR4在胃癌组织中的表达特点以及与VEGF-C表达的关系,探讨其在胃癌的发生、侵袭和转移过程中的作用。
1 资料与方法 1.1 一般资料收集海军军医大学附属长海医院胃肠道外科2016年3月至2018年3月290例胃癌根治术后胃癌组织,同时留取距离癌组织>5 cm的正常胃黏膜组织150例(经病理切片证实无肿瘤及增生性病变)为对照。290例胃癌患者中,男性210例,女性80例;年龄32~75岁,中位年龄57岁。对照组患者男性100例,女性50例;年龄33~71岁,中位年龄55岁。患者术前均未行新辅助放化疗,所有标本均经4%甲醛固定,常规石蜡包埋、切片,HE染色,经组织病理确诊,按世界卫生组织(World Health Organization,WHO)标准分型分级[6],按国际抗癌联盟(Union for International Cancer Control,UICC)标准行pTNM分期[7]。
1.2 试剂和方法鼠抗人CXCR4抗体和鼠抗人VEGF-C抗体均购自美国Santa Cruz公司,稀释度为1 :100。RT-PCR试剂盒购自日本TaKaRa公司,CXCR4由日本TaKaRa西安海宁生物技术有限公司合成,7500荧光定量PCR仪为美国ABI公司产品。
免疫组织化学染色:4%甲醛固定,常规石蜡包埋,切片后SP染色观察;用PBS代替一抗作阴性对照。
RT-PCR检测:从-80℃取出标本,组织总RNA提取,反转录及RT-PCR均按试剂盒说明书进行。按以下程序进行扩增:94℃预变性5 min,94℃变性30 s,62℃复性30 s,72℃延伸1 min, 循环40次,72℃延伸10 min。反应结束后取10 μL扩增产物与2 μL 6×缓冲液混合,在1.5%的琼脂糖凝胶上电泳分析。
1.3 结果判断CXCR4和VEGF-C均以细胞质染色出现棕黄色颗粒为阳性结果,采用半定量积分方法[8],每例均随机观察5个高倍视野(×400)。阳性细胞百分率计算:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。阳性细胞强度计分:无着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。将阳性细胞百分率与染色强度相乘,0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~8分为强阳性(+++),其中≥2分为阳性表达。
RT-PCR产物经凝胶电泳后,利用凝胶成像分析系统分析处理,CXCR4和VEGF-C分别在173 bp和285 bp出现电泳带。应用Quantity One灰度分析软件检测CXCR4、VEGF-C及相应GAPDH电泳条带灰度吸光度值,并计算相对应系数。
1.4 统计学分析采用SPSS 19.0统计学软件分析数据。计量资料采用均数±标准差(
CXCR4表达主要定位于细胞膜和细胞质,VEGF-C表达主要定位于细胞质。290例胃癌组织标本中,细胞膜和细胞质均可见CXCR4和VEGF-C阳性表达,阳性表达率分别为83.3%(241/290)和65.0%(189/290)。CXCR4和VEGF-C在胃癌组织中的表达高于正常胃黏膜组织(图 1)。

|
| 图 1 胃癌和正常胃黏膜组织中CXCR4和VEGF-C的表达(SP×100) Fig.1 Expression of CXCR4 and VEGF-C in gastric cancer and normal gastric mucosa (SP×100) |
CXCR4在胃癌组织TNM分期Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期患者中的阳性表达率分别为71.7%、84.0%、87.2%和89.6%,差异具有统计学意义(P < 0.05,表 1)。CXCR4在高分化、中分化和低分化患者中阳性表达率分别为76.2%、82.2%和89.1%;随分化程度由高到低,CXCR4的表达呈升高趋势,但组间比较,差异无统计学意义(P>0.05)。CXCR4在腺癌和印戒细胞癌患者中的阳性表达率为87.3%和79.3%(P>0.05)。
| 临床病理特征 | 例数 | CXCR4 | 阳性表达率(例,%) | χ2值 | P值 | |||
| - | + | ++ | +++ | |||||
| TNM分期 | 22.209 | < 0.01 | ||||||
| Ⅰ期 | 53 | 15 | 23 | 10 | 5 | 38(71.7) | ||
| Ⅱ期 | 150 | 24 | 72 | 48 | 6 | 126(84.0) | ||
| Ⅲ期 | 39 | 5 | 10 | 19 | 5 | 34(87.2) | ||
| Ⅳ期 | 48 | 5 | 10 | 23 | 10 | 43(89.6) | ||
| 病理分型 | 2.161 | 0.142 | ||||||
| 腺癌 | 150 | 19 | 63 | 53 | 15 | 131(87.3) | ||
| 印戒细胞癌 | 140 | 29 | 53 | 48 | 10 | 111(79.3) | ||
| 分化程度 | < 0.01 | 0.985 | ||||||
| 高分化 | 63 | 15 | 19 | 24 | 5 | 48(76.2) | ||
| 中分化 | 135 | 24 | 48 | 48 | 15 | 111(82.2) | ||
| 低分化 | 92 | 10 | 48 | 29 | 5 | 82(89.1) | ||
胃癌组织中CXCR4表达与VEGF-C表达呈正相关(r=0.729,P=0.047,表 2)。
| VEGF-C | CXCR4 | 合计 | |||
| - | + | ++ | +++ | ||
| - | 48 | 48 | 5 | 0 | 101 |
| + | 0 | 63 | 48 | 15 | 126 |
| ++ | 0 | 5 | 48 | 5 | 58 |
| +++ | 0 | 0 | 0 | 5 | 5 |
| 合计 | 48 | 116 | 101 | 25 | 290 |
290例胃癌和150例正常胃黏膜组织中,CXCR4 mRNA表达分别为(0.787±0.156)和(0.557±0.175),VEGF-C mRNA表达分别为(0.717±0.175)和(0.470±0.181),在胃癌组织中的表达均高于正常胃黏膜组织(t=4.399、4.148,均P < 0.01,图 2~3)。
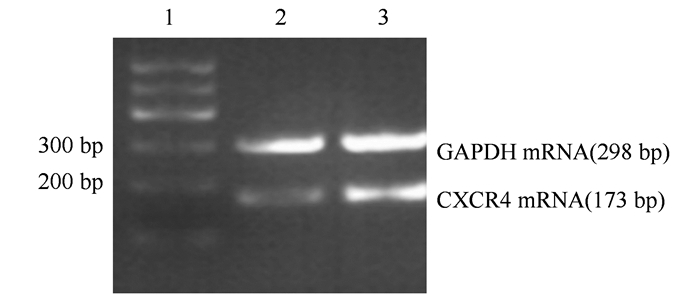
|
| 注1:DNA标准(DL2000);2:正常胃黏膜组织;3:胃癌组织. 图 2 胃癌组织和正常胃黏膜组织中CXCR4 mRNA表达 Fig.2 CXCR4 mRNA expression in gastric cancer and normal gastric mucosa |
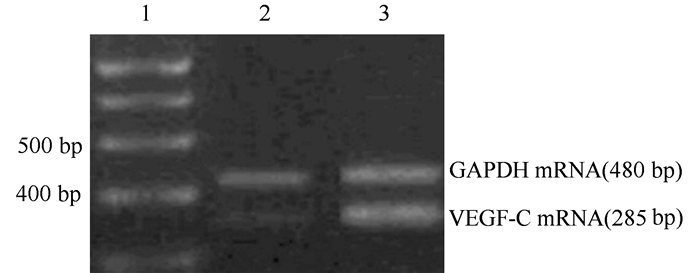
|
| 注1:DNA标准(DL2000);2:正常胃黏膜组织;3.胃癌组织. 图 3 胃癌组织和正常胃黏膜组织中VEGF-C mRNA表达 Fig.3 VEGF-C mRNA expression in gastric cancer and normal gastric mucosa |
290例胃癌组织中,CXCR4 mRNA表达量在患者的性别、年龄、分化程度及癌组织浸润深度方面比较,差异均无统计学意义(均P>0.05,表 3),但在淋巴结转移方面比较,差异具有统计学意义(P < 0.01)。VEGF-C mRNA表达量在患者的性别、年龄及分化程度方面比较,差异均无统计学意义(均P>0.05),但在癌组织浸润深度和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05)。
| 临床病理特征 | 例数 | CXCR4 mRNA | t值 | P值 | VEGF-C mRNA | t值 | P值 |
| 性别 | 0.126 | 0.450 | 0.195 | 0.423 | |||
| 男 | 210 | 0.785±0.172 | 0.713±0.188 | ||||
| 女 | 80 | 0.793±0.114 | 0.727±0.144 | ||||
| 年龄 | 0.578 | 0.282 | 1.643 | 0.051 | |||
| ≥60岁 | 160 | 0.802±0.153 | 0.771±0.168 | ||||
| <60岁 | 130 | 0.768±0.163 | 0.677±0.171 | ||||
| 浸润深度 | 0.731 | 0.233 | 2.069 | 0.020 | |||
| 黏膜下及肌层 | 70 | 0.750±0.212 | 0.647±0.164 | ||||
| 浆膜层 | 220 | 0.799±0.137 | 0.774±0.166 | ||||
| 分化程度 | 0.256 | 0.399 | 0.349 | 0.364 | |||
| 高中分化 | 90 | 0.776±0.194 | 0.750±0.212 | ||||
| 低分化 | 200 | 0.792±0.140 | 0.750±0.212 | ||||
| 淋巴结转移 | 5.437 | < 0.01 | 2.910 | 0.002 | |||
| 无 | 100 | 0.635±0.090 | 0.601±0.189 | ||||
| 有 | 190 | 0.867±0.118 | 0.778±0.135 |
290例胃癌组织中CXCR4和VEGF-C mRNA表达量分别为(0.787±0.156)和(0.717±0.175),两者之间呈正相关(r=0.346,P=0.045)。
3 讨论趋化因子是具有化学趋化作用的单链小分子蛋白质,有激活和趋化白细胞作用,参与许多疾病的发生和发展[9]。研究表明,癌细胞的转移和炎细胞的迁移有相似的过程,如涉及细胞趋化和黏附跨内皮迁移等[10]。趋化因子及其受体存在与炎细胞相似的转移机制。不同的趋化因子对肿瘤的发生和发展发挥不同作用[11]。SDF-1是一种基质细胞来源的细胞因子,是CXC趋化因子家族成员,相对分子质量为8 000,国际命名为CXCL12,其特异性受体为CXCR4。通过该受体可启动细胞内多种信号转导。SDF-1/CXCR4构成1个细胞信息传递的生物学轴,与肿瘤细胞的生长和转移密切相关。在白血病、乳腺恶性肿瘤、前列腺癌和结肠癌等多种肿瘤细胞中SDF-1/CXCR4高表达[12],与肿瘤的生长和转移相关[13-15]。CXCR4已成为肿瘤诊断和治疗新靶点[16]。
本研究发现,胃癌组织中CXCR4表达与其他肿瘤组织一样,均位于细胞膜和细胞质中;与胃正常组织比较,胃腺癌和印戒细胞癌都高表达CXCR4。CXCR4表达与肿瘤的恶性程度和预后有关。在难治性转移性前列腺恶性肿瘤中,CXCR4可作为具有强侵袭性的表型。在晚期浸润性膀胱癌中CXCR4 mRNA表达上调,但在表浅性膀胱癌中低表达[17-18]。本研究发现,随着胃癌分化程度的降低,CXCR4表达有增高的趋势,但差异无统计学意义(P>0.05),提示CXCR4表达与胃癌的分化程度关系不密切。CXCR4表达在不同TNM分期的胃癌组织中比较,差异具有统计学意义(P < 0.05),尤其在有局部浸润和淋巴结转移的Ⅱ、Ⅲ和Ⅳ期胃癌组织中,CXCR4表达高于Ⅰ期,表明CXCR4表达水平与胃癌的侵袭和转移密切相关,可能成为判断胃癌预后的一项重要指标。
VEGF-C可在多种肿瘤细胞中表达,能促进肿瘤新血管形成,是淋巴管生成因子[19]。针以VEGF-C介导的信号通路为靶点的靶向治疗是近年来的研究热点[20-21],同时已经用于临床[22]。本研究显示,VEGF-C在胃癌组织中阳性表达率达65.0%,且肿瘤组织内CXCR4与VEGF-C表达呈正相关(r=0.346,P=0.045),通过SDF-1/CXCR4可上调VEGF-C的表达促进肿瘤新血管的生成[23]。因此,CXCR4和VEGF-C之间可能存在促进血管生成的正反馈通路,如乳腺恶性肿瘤和神经胶质瘤细胞自身分泌VEGF-C,同时VEGF-C能够促进CXCR4高表达,进而导致细胞的趋化作用迁移[24]。
CXCR4及VEGF-C在胃癌组织中高表达,在胃癌的发生、侵袭和转移过程中起着重要作用。CXCR4可作为判断转移和预后的依据,为胃癌的诊治提供分子靶向目标,对提高胃癌患者治疗效果和延长其生存期具有重要意义。
| [1] |
Bittoni A, Maccaroni E, Scartozzi M, et al. Chemotherapy for locally advanced and metastatic gastric cancer:state of the art and future perspectives[J]. Eur Rev Med Pharmacol Sci, 2010, 14(4): 309-314. |
| [2] |
McCracken M, Olsen M, Chen MS Jr, et al. Cancer incidence, mortality, and associated risk factors among Asian Americans of Chinese, Filipino, Vietnamese, Korean, and Japanese ethnicities[J]. CA Cancer J Clin, 2007, 57(4): 190-205. DOI:10.3322/canjclin.57.4.190 |
| [3] |
Yang L, Parkin DM, Ferlay J, et al. Estimates of cancer incidence in China for 2000 and projections for 2005[J]. Cancer Epidemiol Biomarkers Prev, 2005, 14(1): 243-250. |
| [4] |
Bonecchi R, Galliera E, Borroni EM, et al. Chemokines and chemokine receptors:an overview[J]. Front Biosci, 2009, 14(3): 540-551. |
| [5] |
Xiao G, Wang X, Yu Y. CXCR4/Let-7a axis regulates metastasis and chemoresistance of pancreatic cancer cells through targeting HMGA2[J]. Cell Physiol Biochem, 2017, 43(2): 840-851. DOI:10.1159/000481610 |
| [6] |
滕晓东, 来茂德. 胃肿瘤病理新进展-2010年消化系统肿瘤WHO分类解读[J]. 临床与实验病理学杂志, 2012, 28(2): 121-123. DOI:10.3969/j.issn.1001-7399.2012.02.001 |
| [7] |
Wang W, Sun XW, Li CF, et al. Comparison of the 6th and 7th editions of the UICC TNM staging system for gastric cancer:results of a Chinese single-institution study of 1503 patients[J]. Ann Surg Oncol, 2011, 18(4): 1060-1067. DOI:10.1245/s10434-010-1424-2 |
| [8] |
Kawasaki H, Altieri DC, Lu CD, et al. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer[J]. Cancer Res, 1998, 58(22): 5071-5074. |
| [9] |
Hernandez-Bedolla MA, Carretero-Ortega J, Valadez-Sanchez M, et al. Chemotactic and proangiogenic role of calcium sensing receptor is linked to secretion of multiple cytokines and growth factors in breast cancer MDA-MB-231 cell[J]. Biochim Biophys Acta, 2014, 1853(1): 166-182. |
| [10] |
Xu H, Wu Q, Dang S, et al. Alteration of CXCR7 expression mediated by TLR4 promotes tumor cell proliferation and migration in human colorectal carcinoma[J]. PLoS One, 2011, 6(12): e27399. DOI:10.1371/journal.pone.0027399 |
| [11] |
Gahan JC, Gosalbez M, Yates T, et al. Chemokine and chemokine receptor expression in kidney tumors:molecular profiling of histological subtypes and association with metastasis[J]. J Urol, 2012, 187(3): 827-833. DOI:10.1016/j.juro.2011.10.150 |
| [12] |
郑淑芳, 时丽芳, 展晓红, 等. NF-κB和CXCR4在大肠腺癌中的表达及临床意义[J]. 中国肿瘤临床, 2012, 29(16): 1172-1175. |
| [13] |
Escot S, Blavet C, Faure E, et al. Disruption of CXCR4 signaling in pharyngeal neural crest cells causes DiGeorge syndrome-like malformations[J]. Development, 2016, 143(4): 582-588. DOI:10.1242/dev.126573 |
| [14] |
Muller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis[J]. Nature, 2001, 410(3): 50-56. |
| [15] |
Ottaiano A, Franco R, Aiello Talamanca A, et al. Over-expression of both CXC chemokine receptor 4and vascular endothelial growth factor proteins predicts early distant relapse in stage Ⅱ-Ⅲ colorectal cancer patients[J]. Clin Cancer Res, 2006, 12(9): 2795-2803. DOI:10.1158/1078-0432.CCR-05-2142 |
| [16] |
季世强, 余盼攀, 张启瑜. AMD3100抑制胰腺癌细胞增殖和侵袭的体外实验[J]. 肝胆胰外科杂志, 2011, 23(4): 329-332. DOI:10.3969/j.issn.1007-1954.2011.04.025 |
| [17] |
Retz MM, Sidhu SS, Blaveri E, et al. CXCR4 expression reflects tumor progression and regulates motility of bladder cancer cells[J]. Int J Cancer, 2005, 114(2): 182-189. DOI:10.1002/ijc.v114:2 |
| [18] |
Eisenhardt A, Frey U, Tack M, et al. Expression analysis and potential functional role of the CXCR4 chemokine receptor in bladder cancer[J]. Eur Urol, 2005, 47(1): 111-117. DOI:10.1016/j.eururo.2004.10.001 |
| [19] |
朱元增, 孙培春, 吴刚, 等. 血管内皮生长因子C在胃癌中表达情况及对淋巴结转移作用[J]. 中华实用诊断与治疗杂志, 2010, 24(5): 433-435. |
| [20] |
Fischer T, Krüger T, Najjar A, et al. Discovery of novel substituted benzo anellated 4-benzylamino pyrrolopyrimidines as dual EGFR and VEGFR2 inhibitors[J]. Bioorg Med Chem Lett, 2017, 27(12): 2708-2712. DOI:10.1016/j.bmcl.2017.04.053 |
| [21] |
Lv J, Sun H, et al. Significance of vasculogenic mimiery formation in gastric carcinoma[J]. Oncol Res Treatment, 2017, 40(1/2): 35-41. |
| [22] |
Tabernero J, Ohtsu A, Muro K, et al. Exposure-response analyses of ramucirumab from two randomized, phase Ⅲ trials of second-line treatment for advanced gastric or gastroesophageal junction cancer[J]. Mol Cancer Ther, 2017, 16(10): 2215-2222. DOI:10.1158/1535-7163.MCT-16-0895 |
| [23] |
Chu CY, Cha ST, Lin WC, et al. Stromal cell-derived factorlalpha(SDF-lalpha/CXCL12) enhanced angiogenesis of human basal cell carcinoma cells involves ERK1/2-N F-kappaB/interleukin-6 pathway[J]. Carcinogenesis, 2009, 30(2): 205-213. DOI:10.1093/carcin/bgn228 |
| [24] |
Ceradini DJ, Kulkarni AR, Callaghan MJ, et al. Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J]. Nat Med, 2004, 10(8): 858-864. DOI:10.1038/nm1075 |
 2019, Vol. 34
2019, Vol. 34


