文章信息
- 龚耀, 沈寿平, 殷晓娟, 刘长龙, 刘晨, 张铁成
- Gong Yao, Shen Shouping, Yin Xiaojuan, Liu Changlong, Liu Chen, Zhang Tiecheng
- 胃癌根治术后静脉联合腹腔热灌注辅助化疗的临床疗效观察
- Efficacy of adjuvant intravenous chemotherapy combined with intraperitoneal hyperthermic chemotherapy in treatment of gastric cancer after radical gastrectomy
- 实用肿瘤杂志, 2019, 34(2): 140-145
- Journal of Practical Oncology, 2019, 34(2): 140-145
-
作者简介
- 龚耀(1980-), 男, 湖南岳阳人, 主治医师, 从事肿瘤化疗和放疗临床研究.
-
通信作者
- 张铁成, E-mail:13952383564@163.com
-
文章历史
- 收稿日期:2018-03-20
2. 南京医科大学附属淮安第一医院肿瘤内科, 江苏 淮安 223300
2. Department of Medical Oncology, Huai'an First Municipal Hospital, Affiliated to Nanjing Medical College, Huai'an 223300, China
胃癌是我国常见的恶性肿瘤之一,发病率位居所有恶性肿瘤第2位,死亡率居第3位[1]。多数患者早期无特异性症状,发现时处于中晚期,临床中发现Ⅲ期胃癌占50%。临床诊断的胃癌患者中14%~43%可能发生腹膜转移,而异时性腹膜转移率高达35%,胃癌根治术后仍有10%~54%可能发生腹膜转移[2]。因而腹膜转移是影响胃癌预后的主要原因之一。如何防止胃癌术后患者肿瘤腹腔内复发转移,改善预后是临床研究的热点。腹腔热灌注化疗是胃癌腹膜转移的有效治疗方法之一,目前已将其作为预防和治疗胃癌腹腔种植转移的标准方法[3]。多数研究集中于将其应用于术前、术中或肿瘤腹腔转移发生后[4-6],而应用于术后辅助化疗的研究少见[7]。本研究通过分别给予进展期胃癌D2淋巴结根治术后患者静脉联合腹腔内热灌注辅助化疗与单纯辅助化疗比较疗效差异,观察腹腔热灌注辅助化疗的疗效。
1 资料与方法 1.1 一般资料收集2009年11月至2012年11月新疆生产建设兵团第七师医院(55例)及南京医科大学附属淮安第一人民医院(84例)收治的139例胃癌根治术后患者。所有患者均行胃癌D2淋巴结根治术,淋巴结清扫数量≥15枚,术后病理明确诊断,经CT、MRI或PET/CT检查,根据美国癌症联合会(American Joint Committee on Cancer,AJCC) 2010版TNM分期标准进行临床分期[8],入组患者均为Ⅱ~Ⅲ期。其中男性96例,女性43例;年龄26~76岁,中位年龄51岁;印戒细胞癌17例,低分化腺癌78例,高、中分化腺癌37例,未分化癌3例,黏液腺癌4例。所有患者均无化疗禁忌证,体能状态(performance status,PS)评分0~2分。将139例患者根据随机数字表方法随机分为试验组(n=69)和对照组(n=70)。两组一般资料比较,差异均无统计学意义(均P>0.05,表 1)。本研究经新疆生产建设兵团第七师医院伦理委员会及南京医科大学附属淮安第一医院伦理委员会批准,入选所有患者均签署化疗知情同意书。
| 临床特征 | 试验组 (n=69) |
对照组 (n=70)> |
χ2/t值 | P值 |
| 年龄(岁,x±s) | 56.03±11.14 | 58.27±10.97 | -1.196 | 0.234 |
| 性别 | 0.244 | 0.621 | ||
| 男 | 49 | 47 | ||
| 女 | 20 | 23 | ||
| 肿瘤部位 | 0.176 | 0.916 | ||
| 胃底贲门 | 16 | 15 | ||
| 胃体 | 11 | 10 | ||
| 胃窦 | 42 | 45 | ||
| 病理分型 | 0.709 | 0.982 | ||
| 高分化腺癌 | 2 | 2 | ||
| 中分化腺癌 | 15 | 18 | ||
| 低分化腺癌 | 40 | 38 | ||
| 未分化癌 | 2 | 1 | ||
| 黏液腺癌 | 2 | 2 | ||
| 印戒细胞癌 | 8 | 9 | ||
| PS评分 | <0.01 | 0.986 | ||
| 0~1分 | 66 | 67 | ||
| 2分 | 3 | 3 | ||
| TNM分期 | 0.228 | 0.633 | ||
| Ⅱ期 | 22 | 25 | ||
| Ⅲ期 | 47 | 45 |
对照组化疗方案:多西他赛75 mg/m2,静脉滴注1 h,d1;奥沙利铂130 mg/m2,静脉滴注3 h,d1;氟尿嘧啶500 mg/m2,持续静脉滴注d1~d5;21 d为1个周期。
试验组患者先给予腹腔穿刺置管,腹腔置管前排除穿刺置管禁忌(局部皮肤或腹腔感染、有出血倾向、肠梗阻和腹腔黏连)。签署腹腔穿刺置管知情同意书,患者排空尿后,取仰卧位或半卧位,以麦氏点或反麦氏点为穿刺点,常规消毒铺巾,用2%利多卡因由皮肤逐层向腹腔内局部麻醉至壁腹膜,麻醉完毕后,在彩超引导下采用深静脉穿刺针自局麻处垂直于皮肤表面进针,遇突破感时停止,置入导丝后拔出穿刺针,沿导丝置入8F深静脉导管,彩超确认导管在腹腔无误后,将导管固定在皮肤上。化疗方案为:多西他赛75 mg/m2,静脉滴注1 h,d1;奥沙利铂130 mg/m2,静脉滴注3 h,d1;氟尿嘧啶2 500 mg/m2,加入0.9%氯化钠2 000 mL,加热至45℃后匀速灌入腹腔后封管;21 d为1个周期。
两组化疗前1 d开始常规使用地塞米松7.5 mg,口服,2次/d,连服3 d,预防多西他赛引起的水钠储留。使用奥沙利铂期间嘱患者忌生冷饮食,注意保暖,戴手套避免刺激。化疗期间给予止吐和护胃等常规支持对症治疗,治疗期间常规检测血常规、肝肾功能及心电图,出现异常给予相应处理。2个周期评价1次疗效,一般给予4~6个周期化疗。
1.3 不良反应评价不良反应按照世界卫生组织(World Health Organization, WHO)抗癌药物常见不良反应的分级标准进行评估[9]。
1.4 随访及观察指标患者化疗结束后定期随访,随访时间从化疗结束开始至死亡、失访或随访结束,随访截至2017年11月30日。随访5~8年,中位随访时间6.5年。观察两组患者肿瘤复发、转移及生存情况。
1.5 统计学分析采用SPSS 17软件分析数据。Kaplan-Meier法计算生存率。计量资料组间比较采用t检验。计数资料组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 化疗周期数及不良反应比较139例患者共完成678个化疗周期,其中试验组完成342个周期,对照组完成336个周期。7例仅完成2个周期化疗(试验组3例,对照组4例);64例完成4个周期化疗(试验组30例,对照组34例);68例完成6个周期化疗(试验组36例,对照组32例)。
两组患者主要不良反应为恶心、呕吐和白细胞减少等,均经对症治疗后缓解。试验组少数患者在治疗当天有轻度腹胀和腹部灼热感,数小时后可自行缓解。试验组0例发生腹腔内感染。两组患者不良反应发生率比较,差异均无统计学意义(均P>0.05,表 2)。试验组与对照组肠梗阻和肠黏连发生率比较,差异无统计学意义[5.8%(4/69) vs 4.3%(3/70),P=0.684]。
| 不良反应 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 不良反应发生率(例,%) | χ2值 | P值 |
| 白细胞减少 | 0.469 | 0.976 | |||||
| 试验组 | 26 | 24 | 7 | 1 | 58(84.1) | ||
| 对照组 | 28 | 23 | 7 | 2 | 60(85.7) | ||
| 血红蛋白减少 | 1.136 | 0.768 | |||||
| 试验组 | 41 | 6 | 0 | 0 | 47(68.1) | ||
| 对照组 | 43 | 6 | 1 | 0 | 50(71.4) | ||
| 血小板减少 | 0.742 | 0.863 | |||||
| 试验组 | 21 | 11 | 2 | 0 | 34(49.3) | ||
| 对照组 | 20 | 12 | 4 | 0 | 36(51.4) | ||
| 恶心、呕吐 | 1.468 | 0.690 | |||||
| 试验组 | 38 | 16 | 2 | 0 | 56(81.2) | ||
| 对照组 | 40 | 17 | 4 | 0 | 61(87.1) | ||
| 腹泻 | 0.787 | 0.853 | |||||
| 试验组 | 19 | 15 | 3 | 0 | 37(53.6) | ||
| 对照组 | 20 | 12 | 2 | 0 | 34(48.6) | ||
| 肝功能异常 | 0.045 | 0.997 | |||||
| 试验组 | 20 | 9 | 2 | 0 | 31(44.9) | ||
| 对照组 | 20 | 10 | 2 | 0 | 32(45.7) | ||
| 肾功能异常 | 0.104 | 0.747 | |||||
| 试验组 | 4 | 0 | 0 | 0 | 4(5.8) | ||
| 对照组 | 5 | 0 | 0 | 0 | 5(7.1) | ||
| 周围神经毒性 | 0.135 | 0.714 | |||||
| 试验组 | 5 | 0 | 0 | 0 | 5(7.2) | ||
| 对照组 | 4 | 0 | 0 | 0 | 4(5.7) | ||
| 水钠储留 | 0.001 | 0.981 | |||||
| 试验组 | 5 | 0 | 0 | 0 | 5(7.2) | ||
| 对照组 | 5 | 0 | 0 | 0 | 5(7.1) | ||
| 口腔黏膜炎 | 0.582 | 0.748 | |||||
| 试验组 | 15 | 5 | 0 | 0 | 20(28.9) | ||
| 对照组 | 15 | 3 | 0 | 0 | 18(25.7) |
随访过程中两组71例复发转移。试验组和对照组随访期间复发转移率分别为37.7%(29/69)和60.0%(42/70),差异具有统计学意义(P=0.034);其中腹膜转移率分别为11.6%(8/69)和25.7%(18/70),差异具有统计学意义(P=0.033);复发率分别为5.8%(4/69)和5.7%(4/70),差异无统计学意义(P=0.983)。两组肝、肺、淋巴结及其他部位转移情况比较,差异均无统计学意义(均P>0.05, 表 3)。试验组术后1、3和5年无瘤生存率(disease free survival,DFS)分别为95.6%、65.2%和57.9%,对照组分别为94.3%、48.6%和40.0%;两组整体DFS比较,差异具有统计学意义(P=0.031,图 1)。试验组和对照组出现复发转移的平均时间分别为26.8个月(95%CI:14.9~38.7)和24.9个月(95%CI:13.5~36.3)。
| 组别 | 复发及转移 | 手术野复发 | 肝转移 | 肺转移 | 腹膜转移 | 区域淋巴结转移 | 其他部位转移 |
| 试验组 | 29 | 4 | 4 | 4 | 8 | 8 | 1 |
| 对照组 | 42 | 4 | 7 | 3 | 18 | 9 | 1 |
| χ2值 | 4.491 | <0.01 | 0.842 | 0.166 | 4.566 | 0.038 | <0.01 |
| P值 | 0.034 | 0.983 | 0.359 | 0.684 | 0.033 | 0.845 | 0.992 |
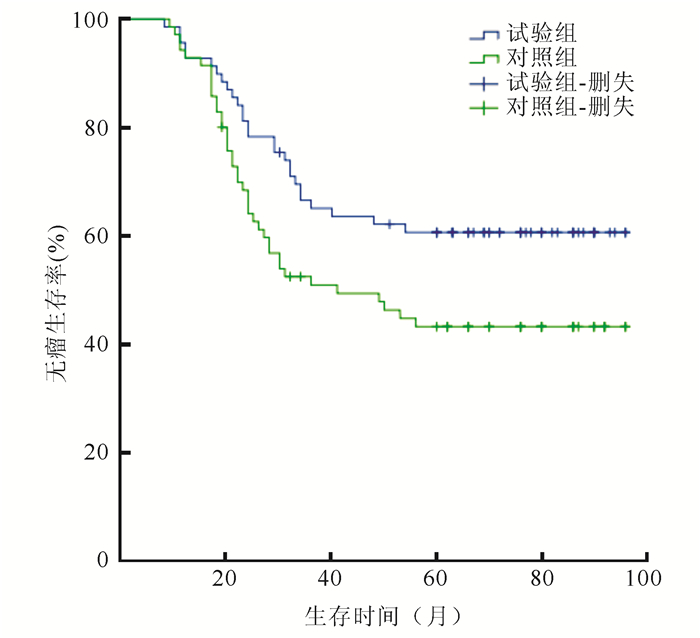
|
| 图 1 试验组和对照组胃癌患者无瘤生存曲线 Fig.1 Disease-free survival curves of the study group and the control group |
随访过程中66例死亡。试验组和对照组术后1、3和5年总生存率(overall survival, OS)分别为100.0%、81.1%、60.9%和100.0%、62.8%、42.9%;两组整体OS比较,差异具有统计学意义(P=0.025,图 2)。
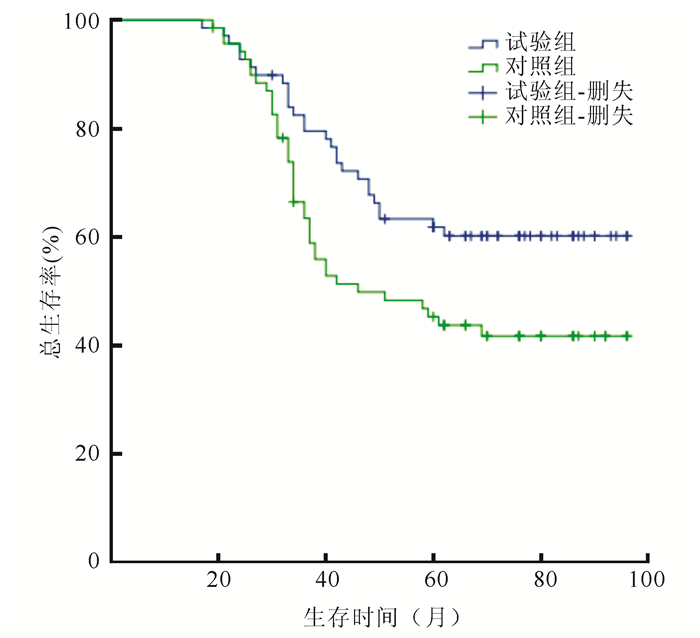
|
| 图 2 试验组和对照组胃癌患者总生存曲线 Fig.2 Overall survival curves of the study group and the control group |
目前胃癌的治疗原则是以手术为主的根治性切除辅以放、化疗的综合治疗模式。有报道指出,胃癌根治术后腹膜转移是最常见的复发类型,占45.4%[10]。腹腔转移造成患者死亡占胃癌死亡的50%。目前公认的腹膜转移机制为“种子与土壤学说”:术前或术中原发灶脱落的肿瘤细胞及淋巴结清扫过程中裸露的淋巴管向腹腔播散的肿瘤细胞作为“种子”,手术过程造成腹膜损伤以及创面修复组织释放的生长因子和纤维素沉着,伴随腹腔部分地方无间皮组织覆盖和血液残留物等构成适合肿瘤细胞种植的“土壤”[2, 11]。故有效消灭脱落在腹腔中的肿瘤细胞是减少术后肿瘤转移的重要因素。
腹腔灌注化疗是将化疗药物注入腹腔,由于存在腹膜屏障,腹腔化疗可使腹膜局部病灶药物浓度提高,造成位于腹盆腔的肿瘤长期暴露于化疗药物中,从而更好地杀伤肿瘤细胞[12]。并且绝大部分药物通过门静脉系统进肝脏代谢,从而能够作用于门脉系统及肝脏中的微小转移病灶,药物在肝脏中代谢成无毒或低毒产物,从而可以减轻化疗药物对其他器官损害及全身的不良反应[13]。热疗可以增强肿瘤细胞对化疗药物的敏感性。热疗可以扩张肿瘤组织中血管并增加血管及肿瘤细胞通透性,从而使化疗药物更易进入肿瘤细胞,使肿瘤细胞内药物达到高浓度。此外,热疗还可以通过增强化疗对相关细胞凋亡基因的表达发挥增敏作用[14]。因此热疗与腹腔灌注化疗有协同作用。有研究分析45例腹膜转移癌患者腹腔热灌注化疗前、后腹腔灌洗液细胞学检查及相关肿瘤标志物的变化发现,腹腔热灌注化疗可以有效杀灭腹腔游离肿瘤细胞[15]。
5-氟尿嘧啶是胃癌化疗的基础用药,是细胞周期特异性药物,主要作用于S期,在体内转化成氟尿嘧啶脱氧核苷酸,干扰核苷及DNA合成,其代谢产物又能影响DNA功能,从而影响细胞增殖各期,其相对分子质量小,对细胞膜穿透能力强,腹腔内化疗优于静脉化疗。有研究表明,腹腔热灌注5-氟尿嘧啶后药物峰浓度和平均浓度分别是股静脉血的167.7倍和180.4倍,门静脉血峰浓度和平均浓度分别是股静脉血的5.4倍和6.7倍[16]。其药代动力学为胃癌术后5-氟尿嘧啶腹腔热灌注化疗预防腹膜转移及肝转移提供依据。本研究结果显示,在复发及转移方面中,试验组和对照组腹腔转移率比较,差异具有统计学意义(P<0.05),试验组肝转移率有低于对照组的趋势,但两组比较,差异无统计学意义(P>0.05)。分析其原因可能为肝脏为富血供脏器,转移瘤形成过程中由肝动脉或门静脉供血,因此肿瘤血供丰富;而通过腹腔热灌注化疗提高门静脉血峰浓度并不足以克服富血供造成的化疗抵抗。
Koga等[6]在国际上最早报道腹腔热灌注化疗预防胃癌术后腹膜转移疗效。该研究纳入38例局部进展期胃癌根治术后给予丝裂霉素腹腔热灌注化疗的患者以及55例仅行根治术的局部进展期胃癌患者,发现采取腹腔热灌注化疗的患者3年生存率高于对照组(73.7% vs 52.7%,P<0.05),同时腹膜转移率低于对照组(36.8% vs 50.9%,P=0.180)。詹宏杰等[17]对60例局部进展期胃癌行根治术治疗,术中行预防性腹腔热灌注化疗与单纯行手术治疗的患者3年生存率分别为63.3%和40.0%(P<0.05)。郭明浩[18]将120例患者分为两组各60例,观察组行术后腹腔热灌注化疗(术后3 d内)+术后辅助化疗,对照组术后单纯行术后辅助化疗,随访3年,两组复发率分别为30.0%和50.0%(P<0.05),生存率分别为81.7%和58.3%(P<0.05)。以上研究均在围手术期(术中或术后)行预防性腹腔热灌注化疗。本研究对139例进展期胃癌根治术后(D2)患者行辅助化疗,试验组给予静脉联合腹腔热灌注双途径化疗,对照组给予单纯静脉化疗。试验组与对照组复发转移率分别为37.7%和60.0%(P=0.034),其中腹膜转移率比较,差异具有统计学意义(11.6% vs 25.7%,P=0.033),复发率及其他部位的转移率比较,差异均无统计学意义(均P>0.05)。试验组和对照组术后DFS比较,差异具有统计学意义(P=0.031),术后OS比较,差异具有统计学意义(P=0.025)。目前认为腹腔转移是胃癌的主要致死因素。本研究提示,辅助静脉联合腹腔热灌注双途径辅助化疗可通过减少腹腔转移提高患者DFS和OS。
精准控温是腹腔热灌注化疗的重要因素[19]。而本研究在没有精确的控温热灌注设备下通过与术后辅助化疗同步腹腔热灌注化疗同样取得较好的肿瘤控制率及远期生存率。其可能原因为:(1)每次灌注的化疗药物全部留在腹腔内;(2)灌注次数多;(3)灌注时间跨度长。
本研究中,对照组血液学毒性(Ⅲ~Ⅳ级)及恶心、呕吐发生率稍高于试验组,但两组比较,差异均无统计学意义(均P>0.05);其余不良反应发生率比较,差异也均无统计学意义(均P>0.05)。试验组少数患者在治疗当天有轻度腹胀和腹部灼热感,数小时后可自行缓解,0例发生腹腔内感染。两组肠梗阻及肠黏连发生率相当。试验组除第1次治疗给予腹腔置入深静脉导管费用外,其余治疗周期并不增加费用。
综上所述,对于进展期胃癌D2淋巴结根治术后患者,给予静脉联合腹腔热灌注化疗经济、安全、有效,能降低转移率,提高远期生存率。
| [1] |
韩光锋. 晚期胃癌的内科治疗现状和进展[J]. 实用肿瘤杂志, 2017, 32(6): 569-574. |
| [2] |
Fidler IJ. The pathogenesis of cancer metastasis:the "seed and soil" hypothesis revisited[J]. Nat Rev Cancer, 2003, 3(6): 453-458. DOI:10.1038/nrc1098 |
| [3] |
朱志, 王振宁. 胃癌腹膜转移的诊治研究进展[J]. 实用肿瘤杂志, 2018, 33(3): 204-208. |
| [4] |
Polom K, Marano L, Roviello G, et al. Evolution and emerging future of cytoreducxtive surgery and hyperthermic intraperitoneal chemoperfusion in gastric cancer:From treating the incurable to preventing recurrence[J]. Int J Hyperthermia, 2016, 32(2): 173-179. DOI:10.3109/02656736.2015.1111432 |
| [5] |
Seshadri RA, Glehen O. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in gastric cancer[J]. World J Gastroenterol, 2016, 22(3): 1114-1130. DOI:10.3748/wjg.v22.i3.1114 |
| [6] |
Koga S, Hamazoc R, Macta M, et al. Prophaylactic therapy for peritoneal recurrence of gastric cancer by continuous hyperthermic peritoneal with mitomycin[J]. Cancer, 1988, 61(2): 232-237. DOI:10.1002/(ISSN)1097-0142 |
| [7] |
Kodera Y, Takahashi N, Yoshikawa T, et al. Feasibility of weekly intraperitoneal versus intravenous paclitaxel therapy delivered from the day of radical surgery for gastric cancer:a preliminary safety analysis of the INPACT study, a randomized controlled trial[J]. Gastric Cancer, 2017, 20(1): 190-199. DOI:10.1007/s10120-016-0598-0 |
| [8] |
Washington K. 7th edition of the AJCC cancer staging manual:stomach[J]. Ann Surg Oncol, 2010, 17(12): 3077-3079. DOI:10.1245/s10434-010-1362-z |
| [9] |
Akazawa S, Yamashina T, Konuma Y, et al. Management of anticancer drug adverse reactions[J]. Nihon Rinsho, 2001, 59(Suppl 4): 409-414. |
| [10] |
Sasako M, Sakuramoto S, Katai H, et al. Five-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage Ⅱ or Ⅲ gastric cancer[J]. J Clin Oncol, 2011, 29(33): 4387-4393. DOI:10.1200/JCO.2011.36.5908 |
| [11] |
Yonemura Y, Bandou E, Kawamura T, et al. Quantitative prognostic indicators of peritoneal dissemination of gastric cancer[J]. Eur J Surg oncol, 2006, 32(6): 602-606. DOI:10.1016/j.ejso.2006.03.003 |
| [12] |
Braam HJ, Schellens JH, Boot H, et al. Selection of chemotherapy for hyperthermic intraperitoneal use in gastric cancer[J]. Crit Rev Oncol Hematol, 2015, 95(3): 282-296. DOI:10.1016/j.critrevonc.2015.04.004 |
| [13] |
Wu X, Li Z, Li Z, et al. Hyperthermic intraperitoneal chemotherapy plus simultaneous versus staged cytoreductive surgery for gastric cancer with occult peritoneal metastasis[J]. J Surg Oncol, 2015, 111(7): 840-847. DOI:10.1002/jso.23889 |
| [14] |
Sheshadri DB, Chakravarthy MR. Anaesthetic considerations in the perioperative management of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. Indian J Surg Oncol, 2016, 7(2): 236-243. DOI:10.1007/s13193-016-0508-2 |
| [15] |
姬忠贺, 孙建华, 武海涛, 等. 腹腔热灌注化疗对腹腔游离癌细胞杀灭效果的评价[J]. 中国肿瘤临床, 2015, 42(19): 963-968. DOI:10.3969/j.issn.1000-8179.2015.19.848 |
| [16] |
林爱德, 孙怀玉, 曲牟文, 等. 大容积加温低渗5-Fu腹腔化疗预防胃癌术后复发和肝转移的药代动力学研究[J]. 癌症, 2002, 21(4): 424-429. |
| [17] |
詹宏杰, 梁寒, 王宝贵, 等. 60例进展期胃癌术中腹腔热灌化疗的临床观察[J]. 中国肿瘤临床, 2010, 37(4): 229-232. DOI:10.3969/j.issn.1000-8179.2010.04.015 |
| [18] |
郭明浩. 腹腔镜胃癌D2根治术联合腹腔内热灌注化疗治疗胃癌的疗效研[J]. 腹腔镜外科杂志, 2017, 22(1): 42-45. |
| [19] |
腹腔热灌注化疗技术临床应用专家协作组. 腹腔热灌注化疗技术临床应用专家共识(2016版)[J]. 中华胃肠外科杂志, 2016, 19(2): 121-125. DOI:10.3760/cma.j.issn.1671-0274.2016.02.001 |
 2019, Vol. 34
2019, Vol. 34


