文章信息
- 任敬, 陈谦, 许建新, 杨新宇, 郭再玉
- Ren Jing, Chen Qian, Xu Jianxin, Yang Xinyu, Guo Zaiyu
- 微导管介入化疗治疗肺癌小脑转移瘤的近期疗效观察
- Short-term efficacy of microcatheter interventional chemotherapy in cerebellar metastasis of lung cancer
- 实用肿瘤杂志, 2019, 34(2): 130-134
- Journal of Practical Oncology, 2019, 34(2): 130-134
-
基金项目
基金项目:天津市滨海新区卫生计生委重点支持科技项目(2015BWKZ005)
-
作者简介
- 任敬(1980-), 女, 天津人, 主治医师, 硕士生, 从事呼吸内科常见疾病和肺部恶性肿瘤的综合治疗研究.
-
通信作者
- 郭再玉, E-mail:tedagzy@126.com
-
文章历史
- 收稿日期:2018-03-12
2. 天津市泰达医院神经外科, 天津 300457;
3. 天津医科大学总医院神经外科, 天津 300052
2. Department of Neurosurgery, Tianjin Teda Hospital, Tianjin 300457, China;
3. Department of Neurosurgery, Tianjin Medical University General Hospital, Tianjin 300052, China
脑实质转移瘤最常见的发生部位为大脑半球,其次为小脑和脑干[1]。小脑转移瘤在病变初期的症状极不典型,生长至1~2 cm左右,往往仅表现为头晕或轻度的共济不稳,门诊头部CT检查示后颅窝显影不清,很容易漏诊而按照周围性眩晕治疗,患者症状加重进一步检查时已是晚期,病灶进展伴有水肿。肺癌脑转移患者预后差,自然平均生存时间仅1~2个月[2]。即使是单发小脑转移瘤,后颅窝开颅也难以让患者接受,全脑放疗或全身化疗有效率较低[3],全身反应和认知损伤较大,小脑位于后颅窝,空间较小,周围毗邻脑干和诸多神经血管,极易发生脑水肿而重残或者危及生命,因此整体治疗效果欠佳[4]。前循环颅内转移瘤的介入灌注治疗中位生存时间可延长至7个月[5]。但造影导管置于颈内动脉或者椎动脉起始部,甚至主动脉弓内灌注化疗药物,无法达到超选择性灌注化疗,严重影响介入治疗颅内转移瘤的疗效。笔者首次对肺癌小脑单发转移瘤的患者采用微导管在大脑中动脉2~3级分支进行化疗,取得良好的近期疗效,不良反应轻微可控[6]。对于后循环转移瘤,由于椎动脉较颈动脉纤细易痉挛,椎基底动脉穿支血管众多,老年患者椎动脉开口处易发生硬化迂曲,甚至开口狭窄,因此造影导管难以到达病变部位且导管内化疗风险极高,严重限制小脑转移瘤介入治疗的应用。
本研究将神经介入领域的材料和方法应用在肿瘤介入治疗中,中间导管技术具备极高的顺应性和可通过性,对于血管内膜的损伤极小,解决了椎动脉颅外段的通过性问题。微导管技术更是能够到达小脑上动脉和小脑后下动脉,直达病灶局部,因此笔者尝试采用必要时中间导管辅助的微导管技术在小脑上动脉和小脑后下动脉进行化疗药物的灌注治疗,近期疗效满意。对天津市泰达医院2014年9月至2017年8月间收治的符合入组标准的17例肺腺癌小脑单发转移患者进行研究,经微导管或造影导管灌注化疗肺部肿瘤,经微导管灌注化疗小脑转移瘤,分析近期疗效和不良反应发生情况,现报道如下。
1 资料与方法 1.1 一般资料纳入标准:(1)经病理证实的肺腺癌患者,采用经皮穿刺活检或支气管镜活检,未采用开胸手术切除的肺癌患者;(2)颅内小脑转移瘤经影像学诊断,增强MRI或PET-CT检查确诊为转移瘤;(3)小脑转移瘤为可测量的单发病灶,直径0.5~3 cm;(4)脑血管造影证实颅内转移瘤为后循环供血,即椎基底动脉的分支供血,而非前循环经交通动脉供血;(5)介入治疗前未接受过静脉化疗和放疗等抗肿瘤治疗,拒绝肺部和小脑肿瘤的外科手术治疗;(6)Karnofsky功能状态(Karnofsky performance status,KPS)评分≥60分,即生活至少部分自理;(7)无严重的脏器功能不全,无凝血异常和血常规异常;(8)知情同意并签字。符合以上标准,经医院伦理委员会批准,共17例患者入组并全部完成本研究。
收集2014年9月至2017年8月间收治的肺腺癌小脑单发转移患者17例,住院接受数字减影血管造影(digital subtraction angiography,DSA)下经导管支气管动脉灌注化疗肺部肿瘤,和经微导管灌注化疗小脑转移瘤。其中男性10例,女性7例;年龄35~73岁,中位年龄57岁。12例为就诊神经科发现小脑转移瘤,胸部CT检查发现肺内占位,经支气管镜或经皮穿刺活检病理证实肺腺癌;另5例为就诊呼吸科发现肺腺癌,进行全身检查时发现颅内转移瘤,头部增强MRI检查确诊。所有患者肺部肿瘤病理均为肺腺癌,第1次治疗前常规腹部B型超声等检查未发现全身其他部位转移。颅内转移瘤均为单发,最大直径0.5~3 cm,其中15例最大直径<2 cm,2例最大直径为2~3 cm。位于左侧小脑半球9例,位于右侧小脑半球8例。KPS评分60分3例,70分6例,80分5例,90分3例。
1.2 介入治疗方法患者于DSA下行肺癌和小脑转移瘤的灌注化疗。以肿瘤染色和术前影像学检查相吻合辅助判断肿瘤的滋养动脉。颅内转移瘤的动脉内灌注化疗使用替尼泊苷(teniposide,VM-26)、卡莫司汀(carmustine,BCNU)、卡铂(carboplatin,CBP)和吡柔比星(pirarubicin,THP)等联合化疗方案。根据患者的体表面积个体化用药剂量。采用Seldinger法穿刺右侧股动脉,置入6F动脉鞘,以5F JL4.5导管置于腹主动脉的肠系膜动脉附近,缓慢推入恩丹司琼8 mg,后选择双侧支气管动脉或相关的肋间动脉,造影可见肿瘤染色和胸部CT检查所示肿瘤部位相符(图 1A),尝试以SilverSpeed-14微导丝引导Echelon-10 45°(微导管超选择支气管动脉分支,避开向对侧的分支或者共干的肋间动脉,微导管造影可见肿瘤染色明显(图 1B),微导丝引导微导管可以深入肿瘤内部进行造影和灌注治疗(图 1C~1D),17例中9例微导管到位顺利,8例尝试微导管到位困难,予以支气管动脉灌注。以高压注射器2 mL/min依次灌注20 mL生理盐水或葡萄糖稀释后的依托泊苷(etoposide, VP-16)、THP和顺铂(cisplatin,CDDP)。灌注过程中注意X线片下观察导管或者微导管头端位置,如可疑移位,及时再次血管造影,保证灌注血管的准确性。全脑血管造影采用5F单弯导管,根据头部MRI检查所示肿瘤部位供血区域对血管进行微导管超选,到达椎动脉颅内段小脑后下动脉分支血管(图 1E~1F),17例中13例单弯造影导管进入椎动脉颅外段顺利,微导管微导丝经过单弯造影导管进行超选灌注,4例椎动脉开口处迂曲(2例)、纤细(1例)或狭窄(1例),行6F导引导管到达锁骨下动脉提供支撑,微导丝和微导管引导5F Navien中间导管通过迂曲狭窄部后导引导管到达椎动脉V2~V3段提供稳定的支撑,微导丝引导微导管进行小脑后下动脉分支血管的超选。脑血管造影发现小脑转移灶肿瘤染色不明显,主要根据血管的供血区域和头部MRI检查的匹配进行超选小脑后下动脉即可完成小脑转移瘤的血运覆盖。注意必要时进行微导管的手推造影,确定微导管处于血管真腔,颅内导管操作要小心,注意微导丝或微导管进入血管夹层的可能性。在进行微导管操作的同时导引导管内以6 mL/min灌注0.3%罂粟碱注射液预防脑血管痉挛,以高压注射器3 mL/min依次灌注20%甘露醇30 mL、地塞米松10 mg和20 mL生理盐水或葡萄糖稀释后的VM-26、BCNU、THP和CBP。灌注过程中观察椎动脉血管痉挛情况,调整罂粟碱的用量。灌注结束后缓慢撤出微导管和中间导管,拔除动脉鞘压迫止血。术后注意患者的意识和查体变化,必要时复查头部CT,予以对症治疗,术后1周出院。上述治疗方法每4周进行1次,连续治疗2次,最后1次治疗后4周复查胸部增强CT和头部增强MRI进行近期疗效评价。
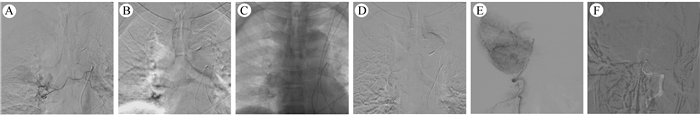
|
| 注 A:支气管动脉造影可见右肺上叶异常血管影;B:微导管超选后造影,可见肿瘤染色明显;C:微导丝引导微导管深入肿瘤内部; D:微导管在肿瘤内部造影,可见肿瘤血管显影; E:椎动脉造影可见小脑后下动脉分支走形异常紊乱,动脉晚期肿瘤染色形成;F:微导丝引导微导管超选择进入小脑后下动脉. 图 1 经微导管一次手术依次灌注化疗肺内原发灶和小脑转移灶 Fig.1 The primary lung lesion and cerebellar metastasis were treated in turn by perfusion chemotherapy with microcatheter |
采用2009年实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[7],根据可测量病灶最大直径总和之变化,分为:完全缓解(complete remission,CR),全部病灶消失并维持>4周;部分缓解(partial remission,PR),病灶缩小≥30%并维持>4周;疾病进展(progressive disease,PD),单发病灶长径总和增加>20%,绝对值增加>5 mm或出现新的病灶;疾病稳定(stable disease,SD),介于PR和PD之间。客观有效率(objective response rate,ORR)为CR+PR。疾病控制率(disease control rate,DCR)为CR+PR+SD。
1.3.2 药物不良反应评价根据2003年美国国立癌症研究所(National Cancer Institute,NCI)制订的通用不良反应术语标准(Common Terminology Criteria Adverse Events,CTCAE)4.0版本进行分级[8],对治疗期间或随访期间出现的各种不良事件进行评价。
1.3.3 脑血管并发症评价对手术操作中和术后出现的脑血管并发症进行评价,主要包括以下3个方面:(1)脑卒中,颅内血管发生不可逆性的缺血或出血事件,头部CT或MRI检查可显影;(2)脑血管痉挛,一过性脑缺血表现,经治疗后短期可完全恢复,头部CT或MRI检查不显影;(3)脑水肿,转移瘤周围正常脑组织可出现水肿,化疗有可能加重脑水肿,头部CT或MRI检查可进行比较和评价。
1.4 统计学分析采用SPSS 19.0软件进行数据分析。计数资料以频数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 近期疗效本组17例患者均完成2次动脉灌注化疗,最后1次治疗后生存均>4周,采用胸部增强CT和头部增强MRI评价近期疗效。结果显示,CR 4例(23.5%),PR 5例(29.4%),SD 7例(41.2%),PD 1例(5.9%)。ORR为52.9%(9/17),DCR为94.1%(16/17)。对患者临床特征和近期疗效进行分析显示,男性和女性患者的疾病控制率比较,差异无统计学意义(P>0.05)。
2.2 药物不良反应17例患者均行2次介入治疗,每次治疗后记录其药物不良反应及并发症发生情况,共记录34例次。患者的化疗药物有关的不良反应发生率为11.8%(4/34),其中胃肠道反应8.8%(3/34),白细胞下降为主的血液毒性反应2.9%(1/34)。所有化疗药物不良反应均为1~2级,且经对症治疗能够恢复,未发生≥3级化疗药物不良反应。KPS评分<70分的4例患者不良反应发生情况和KPS评分>70分的13例患者比较,差异无统计学意义[12.5%(1/8) vs 11.5%(3/26),P>0.05]。
2.3 颅内并发症颅内并发症发生率8.8%(3/34),未出现术后缺血性或出血性卒中事件。脑血管痉挛发生率为5.9%(2/34),2例次均发生在椎动脉,术中发现造影剂的滞留,造影证实脑血管痉挛,予以调整导管位置和头端方向,罂粟碱灌注治疗后好转。脑水肿发生率为2.9%(1/34),术后予以甘露醇治疗。
3 讨论 3.1 肺部原发灶和小脑转移瘤的同时治疗对于转移瘤的治疗,目前尚缺乏整体化治疗解决方案,即对于原发灶和转移灶的同时有效治疗。治疗转移瘤的同时,原发灶的治疗是非常重要的[9],但是由于肺癌支气管动脉的解剖特点,有些肺癌由肋间动脉供血,或者支气管动脉由肋间动脉发出,而胸段脊髓动脉多与肋间动脉共干[10],或者支气管动脉或肋间动脉存在与脊髓动脉相沟通的小分支,灌注化疗时注射压力过高或速度过快有可能造成化疗液逆流入脊髓动脉而产生并发症,甚至截瘫[11],用微导管进行超选择性灌注避免发生脊髓损伤就显得非常重要[12],但是部分患者微导管难以到位,本研究微导管到位率仅52.9%(9/17),因此单纯肺癌灌注治疗使用微导管和微导丝尝试超选可能造成患者的经济负担。本研究从1次介入治疗手术同时灌注化疗原发灶和转移灶出发,股动脉穿刺1次治疗肺部和小脑2个部位,减轻患者的痛苦。微导管和微导丝可以重复用在肺部原发灶和小脑转移灶,避免贵重耗材的浪费,减轻患者的经济负担。
3.2 微导管技术和中间导管技术的应用微导管技术在肝癌的介入灌注化疗和栓塞治疗中应用较多[13-14],技术成熟,在肾癌、肺癌和子宫肿瘤的介入治疗中也见报道[15-16]。肺癌的支气管动脉微导管超选技术上并不困难,但受限于支气管动脉的解剖特点,部分患者确实难以到位。对于小脑半球转移瘤的超选择化疗,目前国内外未见报道。主要是椎动脉纤细以及开口处迂曲和狭窄等问题,常规导管技术极易发生脑血管痉挛,栓塞甚至血管闭塞和脑梗死等严重并发症。随着近年来神经介入材料学和应用技术的发展提高,微导丝和微导管的塑形技术和中间导管应用于颅内动脉瘤栓塞和颅内血管狭窄等治疗已经非常普及,中间导管对脑血管的损伤较小,为微导管的进一步超选提供有力支撑。本研究中心采用中间导管和微导管技术治疗大量脑血管病患者,积累丰富的操作经验,因此从技术上克服了小脑转移瘤血管超选择的难题。经过实践证实,微导管超选择到位小脑后下动脉是完全可行的,但要注意颅内操作动作轻柔,严防微导管进入血管夹层,确认血管真腔后方可灌注化疗,材料选择准确和技术操作熟练情况下,几乎没有并发症。
3.3 小脑转移瘤超选择性灌注化疗安全可行本研究17例小脑转移瘤患者,CR 4例(23.5%),ORR为52.9%(9/17),DCR为94.1%(16/17)。ORR和DCR虽未明显优于采用同样治疗方法的前循环转移瘤,但CR率高于大脑半球转移瘤患者,笔者分析可能由于后颅窝体量较小,小脑半球为椎动脉发出的小脑后下动脉供血,供血途径较为单一,微导管位于小脑后下动脉内灌注即可直接灌注转移瘤内,药物利用率较高。罂粟碱在灌注化疗药物的过程中持续泵入起到缓解脑血管痉挛和扩张肿瘤供血动脉的作用[17]。小脑转移瘤灌注后药物不良反应轻微可控,均为1~2级,主要是胃肠道反应和白细胞下降,对症治疗后即可好转,因此超选择性灌注化疗小脑转移瘤是安全可行的。
对于小脑单发转移瘤的治疗,目前主流治疗方案仍然是手术切除+全脑放疗,由于小脑转移瘤位于后颅窝,毗邻脑干和诸多重要的神经血管,手术切除风险较高,术后恢复困难,单纯全脑放疗存在对脑组织广泛的放射性损伤和疗效较差的弊端,可出现神经功能缺失且中位生存期≤6个月[18],也无法同时治疗原发病灶和小脑转移灶。而经微导管动脉内化疗,血管造影可以根据肿瘤染色和影像学资料确定肿瘤范围和一支或多支的供血动脉,应用甘露醇等药物开放血-脑脊液屏障[19],微导管到达静脉化疗难以达到的用药部位,肺癌原发灶微导管超选灌注支气管动脉,小脑转移瘤超选择灌注小脑后下动脉,1次股动脉穿刺减轻患者痛苦,1套微导管和微导丝用于肺部和小脑,减轻患者经济负担, 并且短期疗效明显,增强患者进一步治疗的信心和围治疗期的生活质量。通过对其近期疗效进行评价,经灌注化疗后可缩小肿瘤以满足立体定向放射治疗的要求,对于近期疗效不佳的患者可尽早进行放疗或厄洛替尼等分子靶向药物治疗[20]及多学科综合治疗[21]。因此微导管灌注化疗作为一种科学、精准的血管靶向治疗小脑转移瘤的选择,可单独或配合放疗或手术治疗,以达到提高患者远近期疗效,提高生活质量的目标。经微导管动脉内灌注化疗联合放疗的远期疗效观察还有待进一步研究。
| [1] |
Eichler AF, Loeffler JS. Multidisciplinary management of brain metastases[J]. Oncologist, 2007, 12(7): 884-898. DOI:10.1634/theoncologist.12-7-884 |
| [2] |
石远凯, 孙燕, 于金明, 等. 中国肺癌脑转移诊治专家共识(2017年版)[J]. 中国肺癌杂志, 2017, 20(1): 1-13. |
| [3] |
Wu YL, Zhou L, Lu Y. Intrathecal chemotherapy as a treatment for leptomeningeal metastasis of non-small cell lung cancer:A pooled analysis[J]. Oncol Lett, 2016, 12(2): 1301-1314. DOI:10.3892/ol.2016.4783 |
| [4] |
李墨, 张国荣. 肺癌脑转移瘤的治疗进展[J]. 疾病监测与控制, 2011, 5(5): 285-287. |
| [5] |
马春华, 郭志. 颅内动脉灌注化疗治疗肺癌脑转移临床观察[J]. 介入放射学杂志, 2011, 20(9): 692-695. DOI:10.3969/j.issn.1008-794X.2011.09.007 |
| [6] |
陈谦. 微导管介入化疗肺癌脑转移的近期疗效观察[J]. 实用肿瘤杂志, 2015, 30(3): 255-259. |
| [7] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumors:Revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [8] |
皋文君, 刘砚燕, 袁长荣. 国际肿瘤化疗药物不良反应评价系统-通用不良反应术语标准4.0版[J]. 肿瘤, 2012, 32(2): 142-144. |
| [9] |
毕良文, 张丽珍, 赵滑峰, 等. 转移性Ⅳ期非小细胞肺癌患者的生存状况及预后分析[J]. 实用肿瘤杂志, 2018, 33(5): 421-425. |
| [10] |
张瑞珍, 江涛. 支气管动脉灌注化疗联合全身静脉化疗治疗中晚期肺癌的疗效观察[J]. 实用肿瘤杂志, 2010, 24(1): 45-47. |
| [11] |
Hohenforst-Schmidt W, Zarogoulidis P, Stopek J, et al. Enhancement of intratumoral chemotherapy with cisplatin with or without microwave ablation and lipiodol.Future concept for local treatment in lung cancer[J]. J Cancer, 2015, 6(3): 218-226. DOI:10.7150/jca.10970 |
| [12] |
赵强德, 丁剑午. 介入治疗在肺癌中的应用[J]. 实用肿瘤杂志, 2013, 28(5): 558-562. |
| [13] |
徐小炉, 陈勇强, 王青. 微导管超选择插管治疗多发肝癌34例[J]. 介人放射学杂志, 2012, 21(3): 252-255. |
| [14] |
汪盛参, 曾庆乐, 陈勇, 等. 微导管超选择插管介入治疗小肝癌的疗效[J]. 实用医学杂志, 2012, 28(11): 1850-1852. DOI:10.3969/j.issn.1006-5725.2012.11.039 |
| [15] |
Li H, Yang S, Wang Y, et al. Application of microcatheter superselective catheterization in interventional treatment on primary uterine fibroids[J]. J Med Imaging, 2013, 23(3): 1092-1094. |
| [16] |
李红伟, 杨思福, 王勇, 等. 微导管超选择插管在子宫肌瘤介入治疗中的应用[J]. 医学影像学杂志, 2013, 23(7): 1092-1094. DOI:10.3969/j.issn.1006-9011.2013.07.034 |
| [17] |
Ghanem MA, Shabana AM. Effects of Milrinone continuous intravenous infusion on global cerebral oxygenation and cerebral vasospasm after cerebral aneurysm surgical clipping[J]. Egypt J Anaesth, 2014, 30(4): 73-82. |
| [18] |
Mahmood U, Kwok Y, Regine WF, et al. Whole-brain irradiation for patients with brain metastases:still the standard of care[J]. Lancet Oncol, 2010, 10(11): 221-222. |
| [19] |
Fortin D. The blood-brain barrier:its influence in the treatment of brain tumors metastases[J]. Curr Cancer Drug Targets, 2012, 12(3): 247-259. DOI:10.2174/156800912799277511 |
| [20] |
马春华, 郭志. 厄洛替尼治疗动脉灌注化疗后进展的肺腺癌脑转移的临床分析[J]. 介入放射学杂志, 2012, 21(8): 641-644. DOI:10.3969/j.issn.1008-794X.2012.08.007 |
| [21] |
郁佳, 吴凤英, 张世佳, 等. EGFR突变晚期NSCLC患者MDT诊治报道[J]. 实用肿瘤杂志, 2017, 32(4): 291-296. |
 2019, Vol. 34
2019, Vol. 34


