文章信息
- 蒙念龙, 王海利, 贠田, 原旭涛, 宋攀龙, 姜波, 李从洋, 王仰坤
- Meng Nianlong, Wang Haili, Yun Tian, Yuan Xutao, Song Panlong, Jiang Bo, Li Congyang, Wang Yangkun
- 胃炎性肌纤维母细胞肿瘤病理特征及鉴别诊断
- Pathological features and differential diagnosis of gastric inflammatory myofibroblastic tumor
- 实用肿瘤杂志, 2019, 34(2): 125-129
- Journal of Practical Oncology, 2019, 34(2): 125-129
-
基金项目
基金项目:河南省重点科技攻关计划基金(132102310008)
-
作者简介
- 蒙念龙(1979-), 男, 河南洛阳人, 住院医师, 从事消化系统疾病临床研究.
-
通信作者
- 王仰坤, E-mail:dr.wyk@163.com
-
文章历史
- 收稿日期:2017-12-19
2. 洛阳电力医院检验科, 河南 洛阳 471003;
3. 解放军第159医院病理科, 河南 驻马店 463000;
4. 解放军第152医院病理科, 河南 平顶山 467000;
5. 南方医科大学深圳医院病理科, 广东 深圳 518100
2. Clinical Laboratory, Luoyang Electric Power Hospital, Luoyang 471003, China;
3. Department of Pathology, The 159 th Hospital of Chinese PLA, Zhumadian 463000, China;
4. Department of Pathology, The 152 th Hospital of Chinese PLA, Pingdingshan 467000, China;
5. Department of Pathology, Southern Medical University Shenzhen Hospital, Shenzhen 518100, China
胃炎性肌纤维母细胞肿瘤(inflammatory myofibroblastic tumor,IMT)是一种少见而独特的间叶性肿瘤,表现低度恶性或交界性肿瘤特点。近年世界卫生组织(World Health Organization, WHO)提出此命名,已逐渐得到认可[1-3]。IMT多发生于儿童和年轻人。最常见的部位是肠系膜、网膜、后腹膜和盆腔,其次是肺、纵隔以及头颈部等[4-5],发生于胃少见。胃IMT主要表现为消化道出血及胃内结节性肿块,与恶性肿瘤表现相似,易误诊[6-8]。本组收集5例胃IMT,探讨其临床病理特征、免疫表型及鉴别诊断,以提高胃IMT诊断率、减少漏诊和误诊率。
1 资料与方法 1.1 一般资料收集解放军第150医院病理科(1例)、南方医科大学深圳医院病理科(2例)、解放军第152医院病理科(1例)和解放军第159医院病理科(1例)于2011年2月至2015年2月经活检及手术切除明确诊断的5例胃IMT。按照胃肿瘤病理学[9]和2010年版WHO消化系统肿瘤胃癌组织学分类[1]的组织学诊断标准诊断胃IMT。5例胃IMT中,男性3例,女性2例;年龄12~41岁,中位年龄22岁。
1.2 方法手术标本离体后30 min内固定,经新鲜配置的4%甲醛固定8~48 h,固定液与组织体积比为10:1。切取肿瘤组织4~6块(常规切取近端和远端切缘,肿瘤及临近胃黏膜等处组织标本块不包括在内),包括最深浸润点及最邻近浆膜层,分别进行HE染色和免疫组织化学检查。
1.3 免疫组织化学染色采用EnVision两步法,所用一抗Vimentin(V9)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)(1A4)、desmin(D33)、calponin、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK) p80(多克隆)、细胞角蛋白(广谱)[cytokeratin(pan),CKpan](AE1/AE3)、CD117(MX041)、DOG1(SP31)、S-100(4C4.9)和Ki-67(SP6)购自福州迈新公司。石蜡切片脱蜡,水化,自来水冲洗。根据一抗要求对组织进行相应的抗原修复,具体步骤参照试剂盒说明书进行。染色过程中设阳性和阴性对照。阳性对照用已知阳性切片,阴性对照用PBS液代替一抗。结果判断:以细胞相应部位出现黄棕色反应为阳性。阳性细胞数计数<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。显色强度不表达为0分,淡黄色为1分,黄或深黄色为2分,褐或棕褐色为3分。阳性细胞数与显色强度计分相加,0分为阴性(-),2分弱阳性(+),3~4分中度阳性(++),5~6分强阳性(+++)。
2 结果 2.1 病理学特征3例位于胃窦,2例位于胃体。所有肿瘤均形成突向胃腔内的隆起型肿物,2例累及胃壁全层,3例累及黏膜下层及固有肌层。3例表面黏膜光滑,2例表面黏膜溃疡形成伴有坏死。所有肿瘤界限清楚,无包膜或包膜不完整,呈结节或旋涡状,质稍硬,切面灰白色鱼肉状或黏液性。肿瘤直径1.6~13.2 cm,平均直径4.3 cm。组织形态特征:肿瘤主要由梭形肌纤维母细胞、纤维母细胞和炎症细胞构成。组织形态有3个结构特点:(1)肥胖或梭形肌纤维母细胞疏松排列(图 1A),周围有水肿性黏液样背景,其中有大量血管和浆细胞、淋巴细胞及嗜酸性粒细胞浸润,类似肉芽组织或其他反应性病变(图 1B);(2)增生的梭形细胞紧密束状排列,伴有不同程度的黏液样和胶原化区域以及独特的弥漫性炎症细胞浸润、浆细胞小灶性聚集和淋巴细胞结节,类似纤维瘤病、纤维组织细胞瘤或平滑肌肿瘤。2例病例梭形肌纤维母细胞围绕血管或突入管腔,类似婴儿型肌纤维母细胞瘤病;以上2种结构特点常见神经节样肌纤维母细胞,核空泡状、核仁嗜酸性、胞质丰富嗜双染;(3)类似瘢痕或韧带样型纤维瘤病(图 1C),有板形胶原,细胞密度低、炎症细胞成分相对稀少,有浆细胞和嗜酸细胞。偶见粗大的或砂砾体性钙化和骨化生。胃腔表面黏膜光滑(图 1D)或形成溃疡伴有坏死。细胞学形态大部分较温和,较少的细胞轻度异型,核分裂相1~2个/10 HPF。
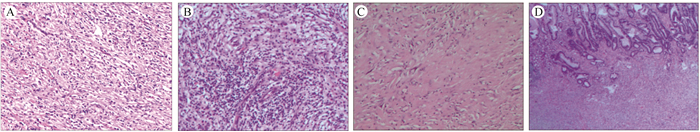
|
| 注 A:肿瘤细胞呈梭形,排列疏松,细胞密度低;B:部分梭形细胞间有大量血管和炎症细胞,类似肉芽组织;C:炎症细胞成分相对稀少,有板形胶原,类似瘢痕或韧带样型纤维瘤病;D:胃黏膜胃腺与肿瘤之间边界清,但无包膜,常有交错排列,且胃腺体常有增生. 图 1 胃炎性肌纤维母细胞肿瘤组织形态特征(HE×10) Fig.1 Morphological characteristics of gastric inflammatory myofibroblastic tumor(HE×10) |
5例胃IMT均阳性表达Vimentin和SMA,3例阳性表达ALK,4例局灶阳性表达CKpan、desmin和calponin,Ki-67阳性表达5%~15%,2例局灶性阳性表达CD34,S-100、DOG1和CD117均为阴性(图 2)。
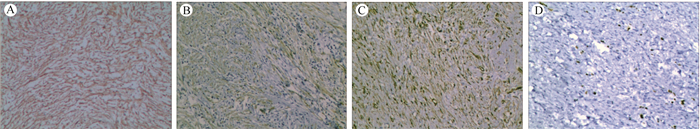
|
| 注 A:Vimentin阳性表达(EnVision×10);B:SMA阳性表达(EnVision×10);C:ALK阳性表达(EnVision×10);D:细胞增殖指数Ki-67阳性细胞5%~15%(EnVision×20). 图 2 胃炎性肌纤维母细胞肿瘤免疫表型 Fig.2 Immunophenotype of gastric inflammatory myofibroblastic tumor |
通过电话方式随访,随访时间24~44个月,1例术后3年6个月在原发灶5 cm内局部复发。其他4例未见肿瘤复发和转移。
3 讨论IMT的报道最早始于1939年的2例肺梭形细胞良性肿瘤,1954年有学者提出肺梭形细胞增生是炎性反应后肿瘤的观点,后命名为炎性假瘤,成为疾病分类学的1个病种;20世纪80年代后陆续发现,炎性假瘤与某些真正肿瘤关系密切,浆细胞肉芽肿、纤维黄色肉芽肿、黏液样错构瘤、假肉瘤和炎性假肉瘤样肌纤维母细胞肉瘤等名称都曾用来描述本病[1-5]。最初的个案报道到近年来的大宗病例的积累研究用以探讨其临床表现和病理学特征[6-8]。WHO软组织肿瘤病理学及遗传学分类中将其命名为IMT,定义为由分化的肌纤维母细胞性梭形细胞组成,并伴有大量炎症细胞的一种间叶性肿瘤,表现低度恶性或交界性肿瘤特点[9-10]。IMT多发生于儿童和年轻人。最常见的部位是肠系膜、网膜、后腹膜和盆腔,其次是肺、纵隔以及头颈部等。WHO(2010年)消化系统肿瘤病理学及遗传学分类将其列入胃肿瘤组织学分类[1, 9]。胃IMT常发生于胃窦,肿瘤形成突向胃腔内的隆起型肿物,累及胃壁,表面黏膜光滑或形成溃疡及坏死。肿瘤呈结节,质稍硬,切面灰白色且具有黏液性。本研究中,肿瘤直径1.6~14.4 cm,平均直径4.3 cm。病理组织学诊断要点:(1)肿瘤界限清楚,但多无包膜或包膜不完整;(2)肿瘤组织主要由梭形肌纤维母细胞、纤维母细胞、各种炎症细胞构成;(3)肥胖或梭形肌纤维母细胞疏松排列,有水肿性黏液样背景;(4)细胞学上,肿瘤细胞形态呈梭形,细胞基质丰富,细胞核肥胖梭形,有小的核仁,一些区域的细胞轻度异型;(5)阳性表达Vimentin和SMA之外,局灶阳性表达CKpan、desmin、calpomin和CD34,半数病例阳性表达ALK。
胃IMT病因尚不清楚。IMT可能起源于胃间质中向肌纤维母细胞分化的干细胞,相关致病因素有手术、创伤、炎性反应、异常修复或特殊的感染等[11]。IMT在遗传学上存在异质性,50%~70%的儿童或年轻患者有克隆性细胞遗传学重排,受累的染色体是2p23,该片段上的ALK基因与多种伙伴基因tropomyosin gene (TPM3)、tropomyosin alpha-4 chain (TPM4)、Ran-binding protein 2(RANBP2)等融合,这种改变在>40岁患者中不常见[12-13]。ALK融合基因导致ALK蛋白C末端的酪氨酸激酶区激活和过表达,此改变仅限于肿瘤性肌纤维母细胞。应用免疫组织化学染色ALK蛋白C末端是确定IMT中存在ALK基因重排的最有效手段。胃IMT通过免疫组织化学染色50%~60%ALK蛋白阳性。本组5例胃IMT患者中2例ALK阴性,且年龄均>35岁,同已有报道一致[12-13]。
胃IMT在临床上无特异性表现,病理学诊断需与以下良、恶性梭形细胞肿瘤及瘤样病变相鉴别。(1)炎性纤维性息肉(inflammatory fibroid polyp, IFP)是由梭形细胞、小血管和炎症细胞(特别是嗜酸性粒细胞)混合组成的间质增生。发病年龄通常为60~75岁。平均直径为1.5 cm,表现为无蒂且质硬的息肉样肿物,组织学上炎性纤维性息肉由松散结缔组织构成,主要成分是梭形纤维母细胞,同时混杂数量不等的炎症细胞及增生的薄壁血管,区域性水肿或黏液样背景。炎症细胞主要为淋巴细胞和嗜酸性粒细胞,有时嗜酸性粒细胞是炎性反应的主要成分,常围绕在血管周围。有时可见增生的间质细胞围绕在小血管和中型血管周围,形成一个同心圆结构。免疫组织化学染色阳性表达Vimentin和CD34,局灶性表达SMA,ALK阴性[14]。(2)胃肠道间质瘤(gastrointestinal stromal tumour,GIST)是胃最常见的间叶性肿瘤,老年患者多见, 中位年龄60~65岁。胃GIST可发生在胃的任何部位,从最小的附壁结节到大的复杂性肿块伴有腔内和腔外。胃GIST组织学有多种,多数为梭形细胞型,少数为上皮样细胞型以及梭形细胞-上皮样细胞为主的混合型,还有少数特殊形态,显示肉瘤样特征,伴有大量核异型和核分裂相,为多形性细胞型。多数胃GIST阳性表达CD117和DOG1;部分阳性表达CD34和S-100。而胃IMT中CD117和DOG1阴性,部分病例表达ALK[15-17]。(3)胃原发性侵袭性纤维瘤病,组织学上肿瘤边界不清,常浸润至邻近组织。由分化好的纤维母细胞构成,其间有数量不等的胶原纤维,细胞成分较单一,炎症细胞数量少。免疫组织化学染色Vimentin、SMA和β-catenin阳性,尤其是β-catenin细胞核显著阳性表达;不表达CKpan、CD34、S-100蛋白、desmin和ALK。(4)胃恶性孤立性纤维性肿瘤(solitary fibrous tumor, SFT),肿瘤为无固定的组织构成,组织学特征有肿瘤细胞稀少区和肿瘤细胞丰富区不规则分布,两者之间有较多致密瘢痕样胶原纤维沉积和分支状血管外周细胞瘤样血管分隔(血管外皮瘤样区域)。胃恶性SFT肿瘤细胞丰富,肿瘤细胞至少中度至重度异型,有肿瘤组织坏死。胃恶性SFT发生淋巴结转移。免疫表型为肿瘤细胞CD99、CD34、Bcl-2和Vimentin阳性表达;CKpan、EMA、SMA、S-100蛋白和desmin局灶性弱阳性表达。不表达ALK、CD68、CD163、CD21、CD23、β-catenin、CD117和DOG1[18]。(5)神经鞘瘤(Schwannoma),核呈栅栏状排列。免疫表型S-100阳性表达,GFAP通常也阳性;CD117、ALK、desmin和SMA阴性。(6)滑膜肉瘤,是一种不同程度显示上皮样分化的恶性间叶性肿瘤,具有特征性染色体易位t(X;18)(p11;q11)及其导致的SS18-SSX基因融合[19]。免疫表型CK和EMA阳性表达。
综上所述,胃IMT少见,具有独特组织病理学改变,表现低度恶性或交界性肿瘤特点,需要与多种梭形细胞肿瘤及瘤样病变鉴别,建立随访机制以提高胃IMT诊断率、减少漏诊和误诊率。
| [1] |
Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system[M]. Lyon: International Agency for Research on Cancer, 2010: 45-79.
|
| [2] |
Lemale J, Boudjemaa S, Parmentier B, et al. A pseudotumoral lesion revealing Meckel's diverticulum[J]. Arch Pediatr, 2016, 23(11): 1157-1160. DOI:10.1016/j.arcped.2016.08.002 |
| [3] |
Wang YK, Chen Z, Yun T, et al. Human epidermal growth factor receptor 2 expression inmixed gastric carcinoma[J]. World J Gastroenterol, 2015, 21(15): 4680-4687. DOI:10.3748/wjg.v21.i15.4680 |
| [4] |
王仰坤. 肿瘤早期诊断与临床[M]. 北京: 人民军医出版社, 2007: 85-112.
|
| [5] |
齐广伟, 郑佳, 杨泽. 然胃丛状纤维黏液瘤临床病理特征分析[J]. 实用肿瘤杂志, 2017, 32(5): 464-466. |
| [6] |
Mohammad Hoseini-Azar M, Mokhtare M, Zare-Mirzaie A, et al. Fever, weight loss and early satiety due to gastric inflammatory myofibroblastic tumor; case report and literature review[J]. Middle East J Dig Dis, 2016, 8(2): 138-142. DOI:10.15171/mejdd.2016.19 |
| [7] |
王仰坤, 赵伟, 郝艳, 等. 伴有明显间质纤维化的胆囊腺癌19例临床病理分析[J]. 癌症, 2006, 25(7): 896-900. |
| [8] |
王思思, 李嘉江慧, 梁英智, 等. 消化系统恶性肿瘤中环状RNA研究进展的系统综述[J]. 实用肿瘤杂志, 2018, 33(4): 334-339. |
| [9] |
王仰坤.胃肿瘤病理学[M]//高春芳, 王仰坤.消化系统肿瘤学.北京: 人民军医出版社, 2012: 296-404.
|
| [10] |
Shen L. Gastrointestinal cancer research in the era of precision medicine[J]. Oncol Transl Med, 2017, 3(1): 1-2. |
| [11] |
Coffin CM, Watterson J, Priest JR, et al. Extrapulmonary infammatory myofibroblastic tumor (inflammatory pseudotumor).A clinicopathologic and immunohistochemical study of 84 cases[J]. Am J Surg Pathol, 1995, 19(8): 859-872. DOI:10.1097/00000478-199508000-00001 |
| [12] |
Marino-Enriquez A, Wang WL, Roy A, et al. Epithelioid inflammatory myofibroblastic sarcoma:an aggressive intra-abdominal variant of infammatory myofibroblatic tumor with nuclear membrane or perinuclear ALK[J]. Am J Surg Pathol, 2011, 35(1): 135-144. DOI:10.1097/PAS.0b013e318200cfd5 |
| [13] |
Cleason BC, Hornick JL. Inflammatory myofibroblastic tumours:where are we now?[J]. J Clin Pathol, 2008, 61(4): 428-437. DOI:10.1136/jcp.2007.049387 |
| [14] |
Lee JE, Choi SY, Lee HK, et al. Computed tomographic features of inflammatory myofibroblastic tumour of the stomach in adult patients:An analysis of five multicentre cases with literature review[J]. J Med Imaging Radiat Oncol, 2018, 62(6): 769-776. DOI:10.1111/jmiro.2018.62.issue-6 |
| [15] |
赵伟, 王仰坤, 马丽. 胃肠道间质瘤23例临床病理分析[J]. 实用医药杂志, 2006, 22(6): 732-734. |
| [16] |
王冉, 陈建新, 杨伟, 等. 胃间质瘤多层螺旋CT双期扫描的诊断价值[J]. 实用肿瘤杂志, 2010, 25(4): 425-428. |
| [17] |
鲁科斌, 黄小娥, 周小栋, 等. 胃间质瘤87例临床特征与预后的关系[J]. 实用肿瘤杂志, 2015, 30(4): 379-380. |
| [18] |
Bosković T, Zivojinov M, Sabo JI, et al. Rare solitary fibrous tumor of the stomach:A case report[J]. Vojnosanit Pregl, 2015, 72(11): 1035-1038. DOI:10.2298/VSP140131098B |
| [19] |
Ogino S, Konishi H, Ichikawa D, et al. Detection of fusion gene in cell-free DNA of a gastric synovial sarcoma[J]. World J Gastroenterol, 2018, 24(8): 949-956. DOI:10.3748/wjg.v24.i8.949 |
 2019, Vol. 34
2019, Vol. 34


