文章信息
- 孙卢浩然, 卢敏
- Sun Luhaoran, Lu Min
- SERCA3在结直肠癌细胞中异常表达及其临床意义
- Abnormal expression and clinical significance of SERCA3 in colorectal cancer cells
- 实用肿瘤杂志, 2019, 34(2): 122-124
- Journal of Practical Oncology, 2019, 34(2): 122-124
-
基金项目
基金项目:辽宁省科技厅科学技术项目(2015020489)
-
作者简介
- 孙卢浩然(1991-), 男, 辽宁沈阳人, 硕士生, 从事实时RT-PCR检测与分析研究.
-
通信作者
- 卢敏, E-mail:supermanslhr@163.com
-
文章历史
- 收稿日期:2017-12-28
2. 中国医科大学附属第一医院肛肠外科, 辽宁 沈阳 110001
2. Department of Anorectal Surgery, The First Affiliated Hospital of China Medical University, Shenyang 110001, China
结直肠癌是全球发病率最高的癌症之一,具有较高的死亡率。目前其发病机制尚有待进一步研究。肌浆网/内质网钙离子转运ATP酶3(sarcoendoplasmic reticulum Ca2+ transporting ATPase 3,SERCA3)参与钙离子从内质网到细胞质的转运,并与细胞代谢、神经细胞塑化、基因转录、细胞生长、分化、凋亡、蛋白质折叠和癌变密切相关。为研究SERCA3与结直肠癌发生和发展的关系,本研究收集40例结直肠癌组织标本及癌旁正常组织检测其SERCA3表达,分析其与结直肠癌临床病理特征的关系。
1 资料与方法 1.1 一般资料收集2009年1月至2013年4月间中国医科大学附属第一医院胃肠外科收治的40例结直肠癌患者。患者均行结直肠癌根治术,40例术后切除标本均经病理检查确诊为腺癌。纳入标准:(1)术前肠镜及病理检查证实为结直肠癌并成功行手术切除的患者;(2)术前未行新辅助化疗或其他生物免疫治疗等。其中男性27例,女性13例;年龄41~76岁,中位年龄57岁。根据世界卫生组织(World Health Organization,WHO)2010分级标准[1],高分化7例,中分化24例,低分化9例。根据国际抗癌联盟(International Union Against Cancer, UICC)第8版(2017)TNM分期[2],Ⅰ期为7例,Ⅱ期19例,Ⅲ期12例,Ⅳ期(肝转移)2例。取所有患者的癌旁正常组织为对照。
1.2 方法 1.2.1 RNA抽提从1~10 mg新鲜组织样品中抽提RNA:加入800 μL的Trizol试剂至样品中,样品裂解后,室温孵育5 min;取1 mL上述液体加入0.2 mL氯仿,剧烈振荡后,室温孵育2~3 min。12 000 r/min离心15 min后,取上清无色水相,加异丙醇沉淀RNA;用75%乙醇进行RNA清洗,用无RNase水重新溶解RNA沉淀。获得的RNA溶液保存于-70℃。
1.2.2 实时PCR检测SERCA3委托中国Takara公司设计并合成SERCA3相关的实时PCR引物,检验引物特异性后,加入PCR微阵列相应的反应孔。用Trizol提纯RNA,DNase Ⅰ消化RNA样品以除去可能存在的基因组DNA,其后RNA纯化使用RNeasy MinEluteTM纯化试剂盒(德国Qiagen公司),通过琼脂糖电泳和紫外吸收测定法检测RNA的质量、浓度和纯度,最后以RNA为模板,应用SuperScript.Ⅲ逆转录酶(美国Invitrogen公司)合成cDNA,20 μL反应体系加入1.5 μg RNA。PCR微阵列的每孔加入cDNA与SuperArray PCR master mix(美国应用生物系统公司Cat.No.PA-112)充分混合,加10 μL至PCR Array对应的每个孔中。实时定量PCR程序设置为变性95℃10 min,扩增40个循环,95℃ 15 s,60℃ 1 min,采集荧光后分析溶解曲线。数据分析采用ΔΔCt方法。荧光阈值设定为0.15,取PCR Array管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的阈值循环数(cycle threshold,Ct)均值为本底,计算ΔCt=Ct均值-管家基因的Ct均值,计算ΔΔCt=ΔCt结直肠癌组-ΔCt对照组。通过2-ΔΔCt计算结直肠癌组与对照组对应基因的表达差异[3]。基因芯片实验由康成生物工程有限公司(中国上海)提供技术服务。
1.3 统计学分析采用SPSS 12.0软件进行数据分析。组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 RNA样品提纯鉴定结直肠癌组和对照组反映RNA样品纯度的紫外吸光度(absorbance,A)比值A260/A280分别为2.01和2.00。检测RNA样品质量的变性琼脂糖凝胶电泳结果见图 1。结直肠癌组和对照组的28 S核糖体RNA带均亮而浓,前者密度高于后者,可看到一片弥散的EB染色物质,可能是由mRNA和其他异型RNA组成。
|
| 图 1 RNA样品的变性琼脂糖凝胶电泳鉴定 Fig.1 Assessing RNA samples by denaturing agarose gel electrophoresis |
实时RT-PCR检测显示,40例结直肠癌组织中SERCA3 mRNA水平较其癌旁正常组织低(P<0.05,图 2)。
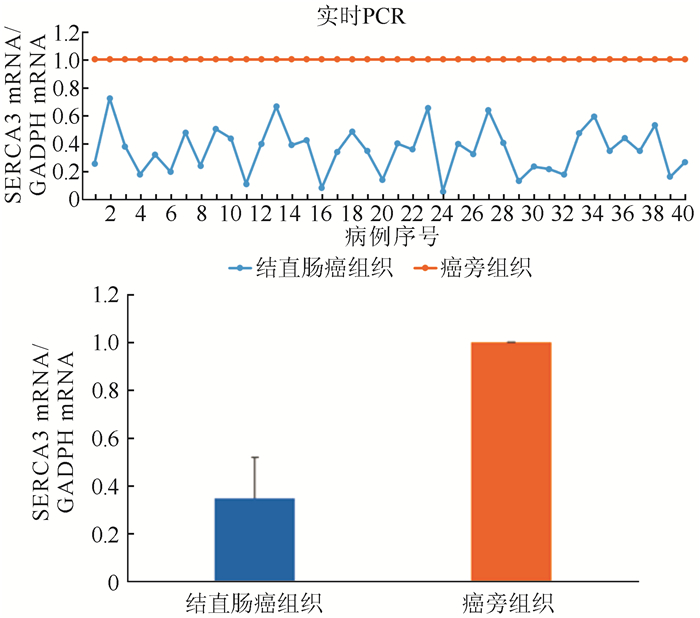
|
| 图 2 结直肠癌及癌旁组织中SERCA3 mRNA水平检测 Fig.2 Analyzing the mRNA level of SERCA3 in colorectal carcinoma and paracarcinoma tissues |
结直肠癌患者SERCA3 mRNA表达在淋巴结转移和TNM分期方面比较,差异均具有统计学意义(均P<0.05,表 1)。
| 临床病理特征 | 例数 | mRNA表达值(Ct) | 结直肠癌组2-ΔΔCt/ 对照组2-ΔΔCt |
P值 |
| 年龄 | ||||
| <60岁 | 29 | 28.36 | 0.343 | 0.243 |
| ≥60岁 | 11 | 27.92 | 0.347 | |
| 性别 | ||||
| 男 | 27 | 28.73 | 0.335 | 0.104 |
| 女 | 13 | 28.90 | 0.330 | |
| 肿瘤部位 | ||||
| 结肠 | 16 | 28.81 | 0.336 | 0.095 |
| 直肠 | 24 | 28.20 | 0.341 | |
| 淋巴结转移 | ||||
| 有 | 14 | 27.30 | 0.343 | 0.021 |
| 无 | 26 | 27.38 | 0.314 | |
| TNM分期 | ||||
| Ⅰ~Ⅱ期 | 26 | 27.15 | 0.339 | 0.034 |
| Ⅲ期 | 12 | 27.69 | 0.325 | |
| Ⅳ期(肝转移) | 2 | 27.03 | 0.311 | |
| 肿瘤组织分化程度 | ||||
| 中 | 24 | 27.34 | 0.339 | 0.073 |
| 低 | 9 | 28.52 | 0.338 | |
| 高 | 7 | 27.02 | 0.344 | |
| 肿瘤大小 | ||||
| <5 cm | 30 | 28.13 | 0.347 | 0.102 |
| ≥5 cm | 10 | 28.42 | 0.344 | |
| 大体病理类型 | ||||
| 肿块型 | 31 | 27.93 | 0.338 | 0.213 |
| 浸润型 | 2 | 28.14 | 0.337 | |
| 溃疡型 | 7 | 27.02 | 0.340 |
SERCA是内质网膜上的跨膜蛋白,亚型包含SERCA 1~3,通过水解ATP将钙离子从细胞质中转移到内质网腔内[4]。SERCA通过控制内质网内外的钙离子浓度变化的频率幅度调控钙离子稳态(calcium homeostasis),参与多个通路的信号转导,影响细胞内几乎所有的重要生理过程[5-6]。SERCA3的异常表达与结直肠腺癌和结肠癌的发展密切相关。既往研究表明,与癌旁正常组织比较,结肠癌组织中SERCA3水平有所下降[7]。结肠癌SERCA3表达水平的降低与结肠癌恶性程度密切相关[6, 8]。Gou等[9]通过RT-PCR检测发现,SERCA3 mRNA表达在结肠癌中较原位癌低(P<0.05);免疫组织化学检查显示,SERCA3表达在淋巴结侵袭方面,差异具有统计学意义(P<0.05)。本研究采用实时PCR微阵列测定结直肠癌组织SERCA3的mRNA表达情况发现,结直肠癌SERCA3 mRNA表达较癌旁组织低(P<0.05),其表达在淋巴结转移和TNM分期方面比较,差异均具有统计学意义(均P<0.05),与上述结果相符[6, 8-10]。本研究结果提示,SERCA3异常表达与结直肠癌的发展密切相关,但其影响结直肠癌的确切机制仍有待进一步研究。
| [1] |
中华人民共和国国家卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2017年版)[J]. 中国实用外科杂志, 2018, 56(4): 241-258. |
| [2] |
姚宏伟, 吴鸿伟, 刘荫华. 从传统"群体化"诊治到精准"个体化"医疗:AJCC第八版结直肠癌分期系统更新解读[J]. 中华外科杂志, 2017, 55(1): 24-27. DOI:10.3760/cma.j.issn.0529-5815.2017.01.007 |
| [3] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [4] |
Monteith GR, McAndrew D, Faddy HM, et al. Calcium and cancer:targeting Ca2+ transport[J]. Nat Rev Cancer, 2007, 7(7): 519-530. DOI:10.1038/nrc2171 |
| [5] |
Elaib Z, Saller F, Bobe R. The calcium entry-calcium refilling coupling[J]. Adv Exp Med Biol, 2016, 898: 333-352. DOI:10.1007/978-3-319-26974-0 |
| [6] |
Toyoshima C, Nomura H, Tsuda T. Lumenal gating mechanism revealed in calcium pump crystal structures with phosphate analogues[J]. Nature, 2004, 432(7015): 361-368. DOI:10.1038/nature02981 |
| [7] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [8] |
Gélébart P, Kovàcs T, Brouland JP, et al. Expression of endomembrane calcium pumps in colon and gastric cancer cells induction of SERCA3 expression during differentiation[J]. J Biol Chem, 2002, 277(29): 26310-26320. DOI:10.1074/jbc.M201747200 |
| [9] |
Gou WF, Niu ZF, Zhao S, et al. Aberrant SERCA3 expression during the colorectal adenoma-adenocarcinoma sequence[J]. Oncol Rep, 2014, 31(1): 232-240. DOI:10.3892/or.2013.2837 |
| [10] |
Brouland JP, Gélébart P, Kovàcs T, et al. The loss of sarco/endoplasmic reticulum calcium transport ATPase 3 expression is an early event during the multistep process of colon carcinogenesis[J]. Am J Pathol, 2005, 167(1): 233-242. DOI:10.1016/S0002-9440(10)62968-9 |
 2019, Vol. 34
2019, Vol. 34


