文章信息
- 李鑫宝, 姬忠贺, 于洋, 张彦斌, 刘刚, 李兵, 张凯, 李雁
- Li Xinbao, Ji Zhonghe, Yu Yang, Zhang Yanbin, Liu Gang, Li Bing, Zhang Kai, Li Yan
- 肿瘤细胞减灭术加腹腔热灌注化疗治疗阑尾腺癌腹膜癌的临床研究
- Clinical study on cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy on patients with peritoneal carcinomatosis from appendiceal adenocarcinoma
- 实用肿瘤杂志, 2019, 34(1): 66-71
- Journal of Practical Oncology, 2019, 34(1): 66-71
-
基金项目
基金项目:北京市医院管理局“登峰”人才培养计划(DFL20180701);首都临床特色应用研究与成果推广项目(Z161100000516077);北京市优秀人才培养资助集体项目(2017400003235J007);首都医科大学附属北京世纪坛医院重点学科建设项目(2016fmzlwk);北京市自然科学基金(7172108)
-
作者简介
- 李鑫宝(1992-), 男, 河北邢台人, 硕士生, 从事腹膜癌临床研究.
-
通信作者
- 李雁, E-mail:liyansd2@163.com
-
文章历史
- 收稿日期:2017-09-17
阑尾腺癌(appendiceal adenocarcinoma)较为罕见,年发病率约为1/百万[1],但我国人口众多,每年发病例数仍有数千例。阑尾腺癌极易侵袭阑尾浆膜,穿透阑尾壁,形成腹盆腔腹膜种植转移,即腹膜癌(peritoneal carcinomatosis,PC)。目前国际上,对于胃癌、结直肠癌和卵巢癌来源的PC,肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)可延长患者生存期,临床疗效显著;并逐渐开展对阑尾腺癌腹膜癌的临床疗效研究。本院自2003年起,开展CRS+HIPEC为核心的综合诊疗技术,治疗各种原发性和继发性PC[2-3],并建立完善大样本数据库。本文旨在总结42例阑尾腺癌腹膜癌的治疗经验。
1 资料与方法 1.1 一般资料本院数据库2004年1月至2017年7月已纳入645例腹膜癌患者信息,其中病理学诊断为阑尾腺癌患者42例,纳入本回顾性研究。研究指标包括症状体征、实验室检查、医学影像学检查和围手术期相关信息等,重点分析疗效和安全性数据。
1.2 CRS+HIPEC主要过程CRS+HIPEC由腹膜癌治疗专科团队实施。全麻下取腹正中切口,开腹后从膈肌腹膜至盆腔腹膜探查肿瘤侵犯程度,依据Sugarbaker评估及记录系统,评估腹膜癌指数(peritoneal cancer index,PCI)[4],同时详细记录腹腔积液性质及量。根据Sugarbaker制定的CRS手术程序,按区域切除腹膜肿瘤、受累器官或组织、清扫淋巴结,凡能完全缩瘤者行根治性切除,不能完全缩瘤者行最大程度CRS,并进行肿瘤减灭程度(completeness of cytoreduction,CC)评分[5]。
CRS完成后行开放式HIPEC。液体输入管置于腹盆腔浅处,输出管置于深处,安装环形腹壁牵开器牵开腹部切口,一次性手术切口保护膜封闭,连接并启动保瑞医疗(Bright Medical,BRM)体腔热灌注治疗系统(BR-TRG-Ⅱ购自广州保瑞医疗技术有限公司),设置相关参数。每种化疗药物加入3 L生理盐水中,加热至(43±0.5)℃,以400 mL/min的流速持续灌注,持续30 min。HIPEC化疗药物方案包括:丝裂霉素30 mg+顺铂120 mg或多西他赛120 mg+顺铂120 mg。
HIPEC完成后,吸净化疗药液,进行消化道和泌尿道等器官重建。术野止血,放置引流管后关腹。安返病房,监护治疗。
1.3 术后化疗及随访患者手术恢复出院后,均完成6~8个周期的FOLFOX方案(奥沙利铂85 mg/m2静脉滴注d1,亚叶酸钙400 mg/m2静脉滴注d1,氟尿嘧啶400 mg/m2静脉滴注d1,氟尿嘧啶2 400 mg/m2静脉滴注持续46~48 h;21 d为1个周期)或FOLFIRI方案(伊立替康180 mg/m2静脉滴注d1,亚叶酸钙400 mg/m2静脉滴注d1,氟尿嘧啶400 mg/m2静脉滴注d1,氟尿嘧啶2 400 mg/m2静脉滴注持续46~48 h;21 d为1个周期)化疗;免疫组织化学法检测支持时[如细胞黏附分子34(cell adhesion molecule 34, CD34)阳性和血管内皮生长因子(vascular endothelium growth factor, VEGF)阳性],联合应用靶向药物(贝伐珠单抗5 mg/kg静脉滴注d1,21 d为1个周期)。化疗途径为全身静脉联合腹腔化疗。
所有患者电话或门诊定期随访,随访内容包括生存状态、不良事件、肿瘤标志物及腹盆腔医学影像学复查情况等。
1.4 统计学分析采用SPSS 21.0软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,组间比较采用t检验或秩和检验。计数资料采用频数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier法作生存曲线。生存单因素分析采用Log-rank检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 主要临床病理特征42例阑尾腺癌腹膜癌患者中男性23例(54.8%),女性19例(45.2%)。年龄24~81岁,中位年龄50岁;PCI 1~39分,中位31分;CC 0~3分,中位2分。组织病理类型:中低分化腺癌1例(2.4%),中分化腺癌2例(4.8%),黏液腺癌39例(92.8%)。术后30 d严重不良事件(serious adverse event,SAE)6例(14.3%)。具体临床病理特征见表 1。
| 临床病理特征 | 例数(%) |
| 年龄 | |
| 中位值(范围,岁) | 50(24~81) |
| 性别 | |
| 男性 | 23(54.8) |
| 女性 | 19(45.2) |
| 组织病理类型 | |
| 中低分化腺癌 | 1(2.4) |
| 中分化腺癌 | 2(4.8) |
| 黏液腺癌 | 39(92.8) |
| PCI | |
| 中位值(范围,分) | 31(1~39) |
| <20分 | 10(23.8) |
| ≥20分 | 32(76.2) |
| CC | |
| 中位值(范围,分) | 2(0~3) |
| 0分 | 10(23.8) |
| 1分 | 9(21.4) |
| 2分 | 10(23.8) |
| 3分 | 13(31.0) |
| SAE | |
| 有 | 6(14.3) |
| 无 | 36(85.7) |
| 注 PCI:腹膜癌指数(peritoneal cancer index);CC:肿瘤减灭程度(completeness of cytoreduction);SAE:严重不良事件(serious adverse event). | |
42例阑尾腺癌腹膜癌患者CRS+HIPEC手术时间为95~960 min,中位657.5 min;腹腔积液0~20 000 mL,中位500 mL;切除器官数为0~8个,中位3个;术中出血量为100~5 000 mL,中位600 mL;术中红细胞输注量为0~20 U,中位2 U;术中血浆输注量为0~1 600 mL,中位800 mL;术中液体输注量为3 700~14 050 mL,中位6 175 mL;术中尿量为500~5 000 mL,中位1 600 mL。具体手术相关信息见表 2。
| 项目 | 中位值(范围) | 均数±标准差(x±s) |
| 手术时间(min) | 657.5(95~960) | 646.4±204.5 |
| 腹腔积液量(mL) | 500(0~20 000) | 2 377.4±3 984.3 |
| 切除器官(个) | 3(0~8) | 3.1±2.0 |
| 出血量(mL) | 600(100~5 000) | 885.2±1 023.1 |
| 红细胞输注量(U) | 2(0~20) | 3.3±4.4 |
| 血浆输注量(mL) | 800(0~1 600) | 685.7±473.5 |
| 液体输注量(mL) | 6 175(3 700~14 050) | 6 684.6±2 574.4 |
| 尿量(mL) | 1 600(500~5 000) | 1 857.7±1 003.3 |
42例阑尾腺癌腹膜癌患者,随访时间为1~61月,中位18.3个月,18例(42.9%)死亡,24例(57.1%)生存,中位生存时间为40.0个月(95% CI:32.2~47.8个月)。1、3和5年生存率分别为75.3%、52.8%和29.7%(图 1)。
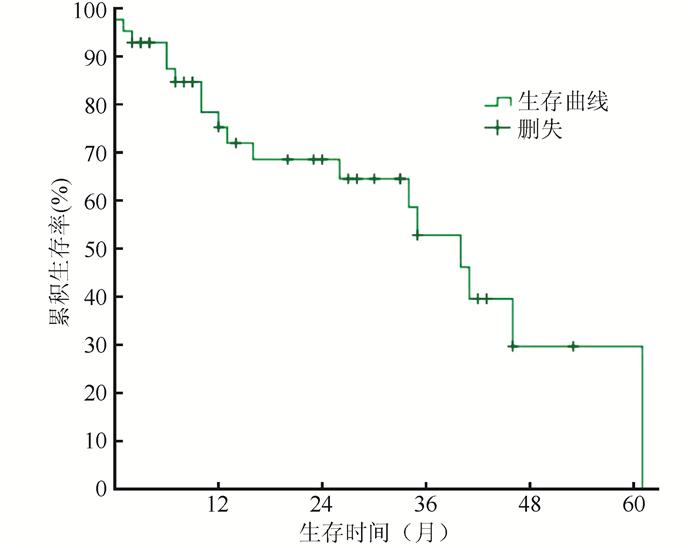
|
| 图 1 42例阑尾腺癌腹膜癌患者生存曲线分析 Fig.1 Survival curve of 42 patients with PC from appendiceal adenocarcinoma |
对42例阑尾腺癌腹膜癌患者的年龄(<60岁 vs ≥60岁)、性别(男 vs 女)、PCI(<20分 vs ≥20分)、CC(0~1分 vs 2~3分)、器官切除数量和SAE(有 vs 无)进行生存单因素分析显示,患者生存情况仅在CC和SAE方面比较,差异具有统计学意义(均P<0.05,图 2),提示CC≤1分和无SAE是预后较好相关因素。
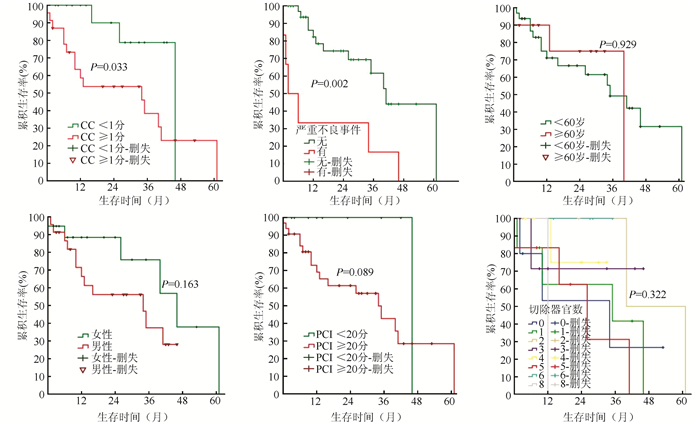
|
| 图 2 42例阑尾腺癌腹膜癌患者生存单因素分析 Fig.2 Univariate survival analysis of 42 patients with PC from appendiceal adenocarcinoma |
在CRS+HIPEC术后30 d内,42例患者中6例(14.3%)出现严重不良事件:切口感染裂开1例,CRS致腹壁薄弱,行人工补片修补,术后10 d切口中部感染裂开,经清创、引流和抗感染治疗后7 d愈合;肠吻合口瘘4例,分别发生于术后6、7、16和21 d,均经腹腔引流管窦道置入双套管冲洗负压引流,禁食水、胃肠减压、抑制胃肠分泌、肠外营养、加强全身抗感染治疗,1例于2周后行全消化道造影证实痊愈,3例继发腹腔感染、脓毒症、多器官功能衰竭,分别于术后1、2和3.5个月死亡;术后第2天急性心肌梗死死亡1例。
3 讨论PC是指腹膜原发和(或)继发的一类恶性肿瘤,原发性的典型代表是原发性腹膜癌和腹膜恶性间皮瘤,继发性的典型代表是胃肠肿瘤和妇科肿瘤形成的腹膜种植转移。临床研究表明,对于胃肠道肿瘤腹膜癌和妇科肿瘤腹膜癌等,CRS+HIPEC可延长生存期,改善生活质量,少数患者甚至达临床治愈,是目前最有效的治疗策略[2-3, 6-11]。阑尾腺癌较为罕见,约占胃肠道肿瘤的0.2%~0.5%[12],但年发病率逐年增长[13]。多数阑尾腺癌患者确诊时已形成腹膜种植转移,有报道表明CRS+HIPEC可取得较好临床疗效[13-15]。
该治疗方案较传统的姑息性手术和化疗等有明显的优势:(1)CRS通过器官切除、腹膜切除,清除肉眼可见的肿瘤组织,最大程度降低肿瘤负荷;(2)HIPEC杀灭微转移灶和游离癌细胞,以彻底消灭腹腔内的原发瘤和转移灶。HIPEC治疗PC的主要机制在于:(1)腹膜-血浆屏障限制了腹膜对大分子药物的吸收,延缓化疗药物代谢,使得腹腔内药物浓度维持在较高水平,是血液中浓度的10~1 000倍,增大腹腔内肿瘤杀伤力;(2)热效应在组织水平可导致肿瘤组织内微血管栓塞、肿瘤细胞变性坏死,在细胞水平破坏肿瘤细胞自稳机制、干扰肿瘤细胞代谢、激活溶酶体,在分子水平干扰肿瘤细胞蛋白质、DNA和RNA合成;(3)热效应与化疗药物有协同作用,且在42℃时明显增强;(4)灌注过程中,液体流动剪切力可直接导致肿瘤细胞死亡,冲刷组织导致肿瘤细胞发生失巢凋亡[16-17]。
HIPEC的实施方法主要有2种:开腹灌注法和闭合灌注法。本单位采用开腹灌注法,最主要原因在于胃肠道结构重建是在HIPEC之后,这样能最大程度减少吻合口复发,同时能够保证吻合口状态良好。此外,开腹灌注法还有其他优势:(1)操作便利;(2)保证热化疗液与腹腔结构的充分、均匀接触;(3)避免腹压增高对患者呼吸和循环系统的影响。
本研究分析42例阑尾腺癌腹膜癌患者接受CRS+HIPEC治疗的临床数据。结果表明,患者中位生存时间为40.0个月,中位随访时间18.3个月,1、3和5年生存率分别为75.3%、52.8%和29.7%。Jimenez等[18]报道125例CRS+HIPEC治疗阑尾黏液腺癌腹膜癌患者中位随访时间36个月,5年生存率为41%;El Halabi等[19]报道77例CRS+HIPEC治疗阑尾黏液腺癌腹膜癌患者中位随访时间18个月,1、3和5年生存率分别为88%、56%和40%;Sardi等[20]报道16例多次CRS+HIPEC治疗阑尾黏液腺癌腹膜癌患者,第1次CRS+HIPEC术后中位随访时间41个月,5年生存率为32%。本研究未及这些报道的生存率,考虑原因包括:阑尾腺癌恶性程度高、侵及腹膜范围广(PCI≥20分占76.2%)、肿瘤减灭程度低(CC≥2分占54.8%)和纳入研究病例数较少等。生存单因素分析发现,CC≤1分和CC>1分患者中位生存时间分别为46.0个月和34.0个月(P=0.033),有SAE和无SAE患者中位生存时间分别为41.0个月和2.0个月(P=0.002),提示CC≤1分和无SAE为预后较好相关因素。Yang等[21]报道PCI≤20分、CC≤1分和淋巴结转移阴性是预后较好相关因素。Jimenez等[18]报道预后不良相关因素包括淋巴结转移阳性、组织病理学高级别和PCI≥20分;El Halabi等[19]报道PCI≥20分组与PCI<20分组中完全肿瘤减灭(CC≤1分)的5年生存率分别达到45%和66%,PCI≥20分组中不完全肿瘤减灭(CC>1分)的3和5年生存率仅分别为27%和0%。Votanopoulos等[15]报道,淋巴结转移阳性、CC>1分和围手术期并发症为预后不良相关因素。本研究表明,CRS过程中,尽可能达到CC≤1分即完全CRS、完全清扫淋巴结,以及患者术后无严重不良事件发生,将使患者明显受益。
CRS+HIPEC综合治疗策略的切除范围广和吻合口多等特点使术后不良事件风险增高。本研究术后不良事件发生率14.3%,其中发生率较高的是肠瘘,最为严重的是急性心肌梗死和脓毒症。Jimenez等[18]报道术后出现胰瘘、肺炎、肺栓塞和深静脉血栓等并发症,未出现围手术期死亡。Park等[22]报道围手术期不良事件发生率为74.2%,较为常见的是白细胞和血小板减少、胸腔积液、输尿管狭窄和肠梗阻;Wong等[23]报道切口感染裂开、肌酐增高和腹腔脓肿等不良事件较为常见。本研究不良事件发生率低,所有患者术前完善评估心、肺、肝、肾等重要脏器功能以及肿瘤标志物、全消化道造影、腹部CT增强扫描和腹部大血管MR等,以明确肿瘤侵袭、转移范围及胃肠道、血管受侵情况,术中、术后需输注红细胞、血浆、强效抗生素和维持内环境稳定,降低围手术期不良事件发生率,安全度过围手术期。
总之,本研究显示,对于阑尾腺癌腹膜癌,CRS+HIPEC综合诊疗技术有效可行。本研究不足之处在于纳入研究病例数少、生存相关因素分析局限以及非前瞻性随机对照研究。进一步证实CRS+HIPEC的疗效、提高安全性将使更多阑尾腺癌腹膜癌患者受益。
| [1] |
赵福光, 周娟娣, 陈杰, 等. 阑尾原发恶性肿瘤临床病理特征分析[J]. 中华全科医学, 2017, 15(4): 593-596. |
| [2] |
杨肖军, 李雁, 杨国樑, 等. 细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜癌[J]. 武汉大学学报:医学版, 2010, 31(5): 635-639. |
| [3] |
黄超群, 周云峰, 谢丛华, 等. 细胞减灭术加腹腔热灌注化疗治疗结直肠癌腹膜转移癌病例对照研究[J]. 中国肿瘤临床, 2013, 40(16): 979-983. DOI:10.3969/j.issn.1000-8179.20130155 |
| [4] |
Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis[J]. Cancer Treat Res, 1996, 82: 359-374. DOI:10.1007/978-1-4613-1247-5 |
| [5] |
Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome[J]. Eur J Surg Oncol, 2001, 27(3): 239-243. DOI:10.1053/ejso.2000.1038 |
| [6] |
Huang CQ, Yang XJ, Yu Y, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival for patients with peritoneal carcinomatosis from colorectal cancer:A phase Ⅱ study from a Chinese center[J]. PLoS One, 2014, 9(9): e108509. DOI:10.1371/journal.pone.0108509 |
| [7] |
Mirnezami R, Moran BJ, Harvey K, et al. Cytoreductive sugrey and intraperitoneal chemotherapy for colorectal peritoneal metastases[J]. World J Gastroenterol, 2014, 20(38): 14018-14032. DOI:10.3748/wjg.v20.i38.14018 |
| [8] |
Cripe J, Tseng J, Eskander R, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for recurrent ovarian carcinoma:analysis of 30-day morbidity and mortality[J]. Ann Surg Oncol, 2015, 22(2): 655-661. DOI:10.1245/s10434-014-4026-6 |
| [9] |
Huo YR, Richards A, Liauw W, et al. Hyperthermic intraperitoneal chemotherapy (HIPEC) and cytoreductive surgery (CRS) in ovarian cancer:A systematic review and meta-analysis[J]. Eur J Surg Oncol, 2015, 41(12): 1578-1589. DOI:10.1016/j.ejso.2015.08.172 |
| [10] |
杨肖军, 黄超群, 熊斌. 胃肠道肿瘤腹膜转移的综合防治[J]. 实用肿瘤杂志, 2018, 33(3): 198-203. |
| [11] |
朱志, 王振宁. 胃癌腹膜转移的诊治研究进展[J]. 实用肿瘤杂志, 2018, 33(3): 204-208. |
| [12] |
钱红, 张莉萍, 许青. 阑尾恶性肿瘤16例临床诊疗分析[J]. 现代肿瘤医学, 2010, 18(10): 2006-2008. DOI:10.3969/j.issn.1672-4992.2010.10.45 |
| [13] |
Marmor S, Portschy PR, Tuttle TM, et al. The rise in appendiceal cancer incidence:2000-2009[J]. J Gastrointest Surg, 2015, 19(4): 743-750. DOI:10.1007/s11605-014-2726-7 |
| [14] |
Glehen O, Bakrin N, Passot G. Peritoneal carcinomatosis from appendiceal cancer:early adequate therapeutic management for long-term survival[J]. Ann Surg Oncol, 2011, 18(6): 1522-1523. DOI:10.1245/s10434-011-1718-z |
| [15] |
Votanopoulos KI, Russell G, Randle RW, et al. Peritoneal surface disease (PSD) from appendiceal cancer treated with cytoreductive surgery (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC):overview of 481 cases[J]. Ann Surg Oncol, 2015, 22(4): 1274-1279. DOI:10.1245/s10434-014-4147-y |
| [16] |
Li Y, Zhou YF, Liang H, et al. Chinese expert consensus on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies[J]. World J Gastroenterol, 2016, 22(30): 6906-6916. DOI:10.3748/wjg.v22.i30.6906 |
| [17] |
中国抗癌协会妇科肿瘤专业委员会, 中国妇科腹腔热灌注化疗技术临床应用专家协作组. 妇科恶性肿瘤腹腔热灌注化疗临床应用专家共识[J]. 中国实用妇科与产科杂志, 2017, 33(9): 926-932. |
| [18] |
Jimenez W, Sardi A, Nieroda C, et al. Predictive and prognostic survival factors in peritoneal carcinomatosis from appendiceal cancer after cytoreductive surgery with hyperthermic intraperitoneal chemotherapy[J]. Ann Surg Oncol, 2014, 21(13): 4218-4225. DOI:10.1245/s10434-014-3869-1 |
| [19] |
El Halabi H, Gushchin V, Francis J, et al. The role of cytoreductive surgery and heated intraperitoneal chemotherapy (CRS/HIPEC) in patients with high-grade appendiceal carcinoma and extensive peritoneal carcinomatosis[J]. Ann Surg Oncol, 2012, 19(1): 110-114. DOI:10.1245/s10434-011-1840-y |
| [20] |
Sardi A, Jimenez WA, Nieroda C, et al. Repeated cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in peritoneal carcinomatosis from appendiceal cancer:analysis of survival outcomes[J]. Eur J Surg Oncol, 2013, 39(11): 1207-1213. DOI:10.1016/j.ejso.2013.08.017 |
| [21] |
Yang XJ, Li Y, Yonemura Y. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy to treat gastric cancer with ascites and/or peritoneal carcinomatosis:Results from a Chinese center[J]. J Surg Oncol, 2010, 101(6): 457-464. DOI:10.1002/jso.v101:6 |
| [22] |
Park EJ, Baik SH, Hur H, et al. Cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for appendiceal and colorectal cancer with peritoneal carcinomatosis:Clinical outcomes at 2 tertiary referral centers in Korea[J]. Medicine (Baltimore), 2017, 96(21): e6632. DOI:10.1097/MD.0000000000006632 |
| [23] |
Wong EYT, Tan GHC, Chia CSL, et al. Morbidity and mortality of elderly patients following cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC)[J]. Asia Pac J Clin Oncol, 2018, 14(2): e193-202. DOI:10.1111/ajco.2018.14.issue-2 |
 2019, Vol. 34
2019, Vol. 34


