文章信息
- 熊瑜琦, 蒋莉莉
- Xiong Yuqi, Jiang Lili
- 射频消融治疗原发性肝细胞癌患者的MRI影像变化研究
- Alterations of MRI images of primary hepatocellular carcinoma patients treated by radiofrequency ablation
- 实用肿瘤杂志, 2019, 34(1): 39-42
- Journal of Practical Oncology, 2019, 34(1): 39-42
-
作者简介
- 熊瑜琦(1978-), 男, 辽宁锦州人, 副主任医师, 从事CT及MRI影像诊断研究.
-
文章历史
- 收稿日期:2018-01-30
原发性肝癌是我国常见恶性肿瘤之一,死亡率高,并且在早期无明显症状。患者出现症状时肿瘤已经较大,病势进展迅速,通常在数周内恶化,几个月至1年内即衰竭死亡[1]。因此,早期的实验室检查至关重要。近年来,MRI检查在肝癌诊断中的作用日益受到重视,其诊断价值已超过CT检查。其优点为无电离辐射、能获得横断面\冠状面\矢状面3种图像以及对软组织的分辨力高等。MRI检查对>2 cm的肝癌的检出率为97.5%,≤2 cm者为33.3%,检出最小的肝癌为1.5 cm,对指导临床治疗意义重大[2-3]。肝癌治疗的传统方法是首选手术切除,但不是所有的肝癌患者都适合手术。只有心肺功能较好、肝脏肿瘤较局限和没有转移条件的患者才适宜手术。手术治疗创伤大、风险高且出血量大,并不是最佳的治疗方式。随着微创消融技术的发展,射频消融术已成为治疗肝癌的首选方法。本研究观察188例原发性肝细胞癌患者射频消融治疗前、后MRI成像的变化情况,探讨MRI在临床诊断中的应用价值。
1 资料与方法 1.1 一般资料选取2014年3月至2016年3月于本院就诊的188例原发性肝细胞癌患者。其中,男性107例,女性81例。年龄56~70岁,(60.35±6.12)岁,中位年龄64岁;病程(8.3±1.2)个月。临床分期根据国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)2010版[4],Ⅰ~Ⅱ期62例,Ⅲ~Ⅳ期126例。188例患者共190个肝癌病灶行射频消融术,共进行射频消融术196次。所有患者治疗前2 d行MRI检查,治疗后3、6和12个月进行复查。本研究经医院伦理委员会批准,患者及家属知情并同意参与本研究。
1.2 纳入及排除标准纳入标准:依据原发性肝癌诊疗规范(2011)版的病理诊断标准[5],肿瘤个数≤3个,最大直径 < 3 cm,无肝外转移;初次进行射频消融治疗;肝功能分级为Child-Pugh A或B级;患者自愿接受治疗。排除标准:治疗前接受化疗、介入治疗的患者;出现淋巴结转移、肝外转移;凝血机制障碍;合并心脏病、糖尿病等患者。
1.3 方法 1.3.1 MRI检查[6-7]射频消融前2 d行MRI检查。采用Siemens Verio 3.0T扫描仪,腹部相控阵线圈,患者仰平卧,扫描T1WI、T2WI、动态增加及弥散加权成像(diffusion-weighted imaging, DWI)序列。具体扫描参数为:T1WI采用快速扰相梯度回波(fast scrambling gradient echo,FSPGR)序列,TE 2.3 ms,TR 80 ms,矩阵256×134,层厚5 mm,间隔1 mm。T2WI采用快速自旋回波(fast spin echo,TSE)序列进行扫描,TE 95 ms,TR 5 000 ms,层厚5 mm,矩阵168×256,间隔1 mm,激励次数1次。DWI采用单次激发扩散加权成像序列和平面回波成像技术,层厚5 mm,TR 5 000 mm,间隔1 mm,矩阵320×224,TE根据b值的变化作调整,b=1 000 s/mm2。动态增强T1WI采用肝脏快速容积采集(liver acquisition with volume acceleration,LAVA)序列,TE 1.5 ms,TR 3.94 ms,矩阵288×192,层厚5 mm,间距0.5 mm,激励次数1次。对比剂采用钆喷酸葡胺注射液,右肘静脉注射0.1 mmol/kg,注射后30 s、1 min和5 min分别进行扫描。
1.3.2 射频消融治疗采用美国RITA射频消融治疗系统(RF-1500),在CT引导下行射频消融术。在穿刺点注射5 mL 2%利多卡因进行局部麻醉,部分患者预计治疗时间长、肿瘤位于疼痛较敏感部位的采用全身麻醉。术前行MRI检查,根据病灶位置及大小选择进针路径并确定射频参数[8],进针时要注意避开胆管及大血管。经皮经肝进行穿刺,穿刺过程重复进行CT扫描,适时调整穿刺角度,射频针插入要超过肿瘤0.5~1 cm的消融边缘。常规退针时针道消融。
1.4 影像资料分析在Syngo工作平台上进行影像分析。由2名MRI检查医师对188例患者的MRI影像(包括T1WI、T2WI、动态增加及DWI序列)进行分析,根据患者影像中过渡组织情况、活性区信号的强度和正常肝组织的信号进行判断。
1.5 表观扩散系数(apparent diffusion coefficient,ADC)值的测量 1.5.1 过渡区ADC值的测量注意避开坏死区和肝脏血管,在相同的部位连续层面选取3次感兴趣区(region of interest, ROI),选取的ROI面积要保持一致,然后测量ADC值,取其平均值即为过渡区的ADC值。
1.5.2 病灶实质ADC的测量同样要注意避开坏死区,选取病灶实质信号较均匀的部位,作为ROI进行测量,同样在相同的部位连续层面选取3次ROI,选取的ROI面积要保持一致,然后测量ADC值,取其平均值即为病灶实质的ADC值。
1.6 统计学分析采用SPSS 15.0统计学软件分析数据。计量资料以均数±标准差(x±s)表示。同一病灶相同层面的射频消融术前和术后的ADC值的比较采用配对t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 射频消融术前和术后病灶MRI影像患者射频消融术后病灶MRI检查示,vibe平扫信号增强,DCE-vibe 30 s信号减弱,所有患者的动态增强扫描均未出现动脉期强化(图 1)。
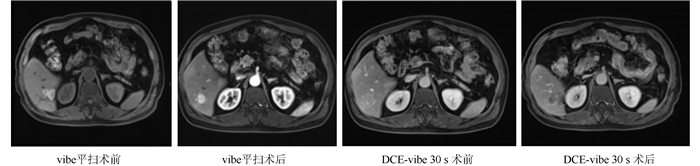
|
| 图 1 肝细胞癌患者射频消融术前和术后病灶MRI影像表现 Fig.1 MRI images of the lesions in patients with hepatocellular carcinoma before and after radiofrequency ablation |
治疗后坏死灶的ADC值有所增高,与治疗前比较,差异具有统计学意义(P < 0.05)。治疗后手术部位过渡区的ADC值也升高,与治疗前比较,差异具有统计学意义(P < 0.05,表 1)。
| 治疗部位 | 成对差分 | t值 | P值 | |||
| 均差 | 标准差 | 均值的标准误 | 差分的95% CI | |||
| 术前病灶-术后病灶 | -305.07 | 342.52 | 75.84 | -149.02~466.01 | 4.21 | 0.02 |
| 术前肝脏-术后肝脏 | -147.00 | 300.94 | 63.97 | -7.19~282.83 | 3.31 | 0.01 |
| 术前过渡-术后过渡 | 50.97 | 218.11 | 46.95 | 150.27~46.87 | 4.57 | 0.02 |
| 术前病灶-术前过渡 | -213.79 | 240.97 | 53.22 | -105.31~323.79 | 5.36 | 0.03 |
| 术前病灶-术前肝脏 | -404.17 | 201.61 | 44.13 | -311.62~494.83 | 3.15 | 0.01 |
| 术前过渡-术前肝脏 | -189.15 | 295.23 | 65.01 | -53.01~322.46 | 4.22 | 0.04 |
| 术后病灶-术后边缘 | -54.05 | 331.24 | 72.09 | 95.78~205.89 | 4.73 | 0.51 |
| 术后病灶-术后肝脏 | -43.88 | 356.12 | 77.15 | 115.77~207.08 | 5.34 | 0.46 |
| 术后过渡-术后肝脏 | 9.11 | 262.54 | 57.29 | 127.93~110.69 | 3.84 | 0.37 |
根据治疗前、后MRI影像分析显示,治疗前正常部位的ADC值与病灶部位和过渡部位比较均较大,过渡部位ADC值较病灶部位大,三者两两比较,差异均具有统计学意义(均P < 0.05)。术后三者ADC值比较,差异无统计学意义(P>0.05,表 2)。
| 部位 | 病灶数 | 治疗前 | 治疗后 |
| 正常部位 | 190 | 1 261.24±180.01 | 1 203.44±178.67 |
| 过渡部位 | 190 | 1 076.15±233.81 | 1 215.17±255.38 |
| 病灶部位 | 190 | 866.47±150.19 | 1 198.35±350.66 |
| t值 | 4.36 | 3.67 | |
| P值 | 0.02 | 0.15 |
原发性肝细胞癌在恶性肿瘤死亡率中居第3位[9]。原发性肝细胞癌早期隐蔽性较高,发现时常处于中晚期。原发性肝癌的早期发现、早期诊断和早期治疗对改善患者预后意义重大。近年来,肝癌诊断得到充分发展,影像学的发展提高了定位诊断的水平,使肝癌的鉴别诊断水准也大为提高[10-13]。MRI检查在临床诊断肝癌中的作用日益凸显。
本研究188例原发性肝细胞癌患者共190个病灶行射频消融治疗。治疗前行MRI检查显示,T1WI均为低信号,T2WI有121个不均匀混杂稍高信号,69个较均匀稍高信号。T1WI呈低信号、T2WI表现为较高信号是肝癌信号的典型特点[14-16]。术前MRI影像示,动态扫描显示为信号增高,动脉期强化明显,门静脉期强化减退。DWI均为高信号;ADC均为低信号。动脉期出现强化明显、门脉期和延迟期信号减退也可以确诊为肝癌,平扫和动态增强扫描也可以提高诊断率。MRI还可以通过注射对比剂进行动态增强扫描,增强肝癌组织与正常肝组织的对比,进而准确诊断肝癌[17-19]。本研究中治疗后MRI检查显示,T1WI信号增高,T2WI信号下降,ADC图像均有所增高。DWI除27个高信号外,其余均有所降低。治疗前正常部位的ADC值最大,其次是过渡部位,病灶部位ADC值最小。肝癌细胞生长密集、核浆比高,自由水较少,水分子扩散受限,ADC值就会下降。本组患者MRI检查还显示,治疗后坏死灶的ADC值和手术部位过渡区的ADC值均高于治疗前。治疗后肝癌细胞死亡或减少,自由水增加,ADC值就会升高。由此可知,ADC值可以评估细胞中水分子的扩散情况,从而发现病变的组织,提高诊断肝癌的敏感度和准确率。
综上所述,MRI成像可对病变内部结构进行分析,了解肿瘤的血供情况,结合动态增强扫描、ADC值和DWI对原发性肝细胞癌的临床诊治具有重要的指导意义。
| [1] |
刘江伟, 黄建钊, 孙倩, 等. 射频消融术和手术治疗原发性肝癌对照分析[J]. 中国医学计算机成像杂志, 2016, 22(5): 444-450. DOI:10.3969/j.issn.1006-5741.2016.05.011 |
| [2] |
王小玲, 赵振华, 王伯胤, 等. MRI功能成像对肝动脉化疗栓塞治疗肝细胞肝癌的疗效评价[J]. 临床放射学杂志, 2017, 36(5): 700-704. |
| [3] |
王喜功, 潘吉荣, 张峰. 超声引导下经皮射频消融与微波消融治疗原发性肝细胞癌的比较[J]. 中国医学影像学杂志, 2015, 23(8): 606-609. DOI:10.3969/j.issn.1005-5185.2015.08.011 |
| [4] |
陕飞, 李子禹, 张连海, 等. 国际抗癌联盟及美国肿瘤联合会胃癌TNM分期系统(第8版)简介及解读[J]. 中国实用外科杂志, 2017, 8(1): 20-22. |
| [5] |
中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011, 20(11): 929-946. |
| [6] |
王松, 冯健, 陈永卫, 等. 腹腔镜辅助超声引导下射频消融治疗膈顶部原发性肝细胞癌疗效评价[J]. 解放军医学杂志, 2017, 42(5): 452-455. |
| [7] |
Koda M, Tokunaga S, Okamoto T, et al. Clinical usefulness of the ablative margin assessed by magnetic resonance imaging with Gd-EOB-DTPA for radiofrequency ablation of hepatocellular carcinoma[J]. J Hepatol, 2015, 63(6): 1360-1365. DOI:10.1016/j.jhep.2015.07.023 |
| [8] |
苗同国, 王立静, 马立伟, 等. 射频消融治疗对原发性肝癌患者T细胞免疫功能的影响[J]. 中国微创外科杂志, 2016, 16(6): 538-540. DOI:10.3969/j.issn.1009-6604.2016.06.017 |
| [9] |
王金娥, 姜慧杰. 二乙基亚硝胺诱导的大鼠实验性原发性肝细胞癌模型建立及应用[J]. 癌症进展, 2011, 9(6): 683-687. DOI:10.3969/j.issn.1672-1535.2011.06.017 |
| [10] |
孙文兵. 射频消融在肝细胞癌综合治疗中的作用[J]. 中华肝胆外科杂志, 2015, 21(9): 591-595. |
| [11] |
刘绍平, 罗汉传, 林源, 等. 射频消融治疗复发性肝癌的应用价值[J]. 中国普通外科杂志, 2015, 24(1): 23-26. |
| [12] |
龙莉玲, 彭鹏, 黄仲奎. 原发性肝癌的早期影像学诊断[J]. 中华肝脏病杂志, 2017, 25(5): 103-106. |
| [13] |
谢玉海, 余永强, 钱银锋, 等. 扩散加权成像在鉴别肝细胞肝癌和周围型胆管细胞癌中的价值[J]. 临床放射学杂志, 2016, 35(6): 887-890. |
| [14] |
方家杨, 于德新, 马祥兴, 等. MRI长时间延迟增强扫描在肝脏孤立性坏死结节诊断和鉴别诊断中的应用价值[J]. 临床放射学杂志, 2017, 36(4): 511-516. |
| [15] |
孙惠川, 王征, 周俭, 等. 2017年版中国肝癌诊断和治疗规范解读[J]. 实用肿瘤杂志, 2018, 33(1): 1-3. |
| [16] |
Kang TW, Rhim H, Lee J, et al. Magnetic resonance imaging with gadoxetic acid for local tumour progression after radiofrequency ablation in patients with hepatocellular carcinoma[J]. Eur Radiol, 2016, 26(10): 1-10. |
| [17] |
吕婷婷, 刘爱连, 汪禾青. 磁共振功能成像对肝癌介入术后评估的进展[J]. 介入放射学杂志, 2016, 25(11): 1021-1025. DOI:10.3969/j.issn.1008-794X.2016.11.023 |
| [18] |
Wang XL, Li K, Su ZZ, et al. Assessment of radiofrequency ablation margin by MRI-MRI image fusion in hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(17): 5345-5351. DOI:10.3748/wjg.v21.i17.5345 |
| [19] |
Vogl TJ, Farshid P, Naguib NN, et al. Ablation therapy of hepatocellular carcinoma:a comparative study between radiofrequency and microwave ablation[J]. Abdominal Imaging, 2015, 40(6): 1829-1837. DOI:10.1007/s00261-015-0355-6 |
 2019, Vol. 34
2019, Vol. 34
