文章信息
- 曹强, 杨扬, 许瑞彬, 刘延风, 任清泉
- Cao Qiang, Yang Yang, Xu Ruibin, Liu Yanfeng, Ren Qingquan
- WT1基因在NSCLC中的表达及其临床意义
- Expression and clinical significance of WT1 gene in non-small-cell lung cancer
- 实用肿瘤杂志, 2019, 34(1): 23-26
- Journal of Practical Oncology, 2019, 34(1): 23-26
基金项目
- 陕西省卫计委科技计划(2016D065)
-
作者简介
- 曹强(1980-), 男, 陕西安塞人, 副主任医师, 硕士, 从事肺癌诊治研究.
-
通信作者
- 任清泉, E-mail: 453764286@qq.com
-
文章历史
- 收稿日期:2017-06-01
据2018年美国癌症研究学会肿瘤年度报告显示,在亚裔美国人中,肺癌患者死亡率在所有癌症中排名第1位[1]。肺癌主要包括小细胞肺癌和非小细胞肺癌(non-small-cell lung cancer, NSCLC),其中NSCLC约占80%。同其他癌症一样,早发现、早诊断是治疗NSCLC的最佳方法,但是肺癌的早期诊断尚无精确的诊断指标,现有的影像学诊断方法(X线片、CT或者MRI检查)仅能反映肺癌的病理形态,无法直接判断组织类型,无法判断肿瘤迁移能力及预后情况。现有的组织病理染色仍然是诊断肺癌病理分期和推断肺癌分化阶段的主要方法,但是其对患者预后的判断有限。现代肿瘤分子生物学方法可以通过检测血液及癌变组织中基因的改变,如B-cell lymphoma(BCL)家族和p53等基因表达情况,诊断肺癌病理分期及患者预后,但是存在阳性率不高,特异度较低的问题。本研究通过检测Wilms tumor gene 1(WT1)在癌旁组织、癌前病变及各期NSCLC组织中表达水平,对各期NSCLC患者进行生存期分析,揭示WT1表达水平与患者预后的关系,为临床判断患者预后提供理论依据及数据支持。
1 资料与方法 1.1 一般资料收集2010年1月1日至2016年1月1日延安大学附属医院NSCLC患者组织石蜡标本100例。患者年龄27~82岁,中位年龄52.5岁;男性78例,女性22例;鳞癌32例,腺癌44例,组织未分化型为24例;采用国际抗癌联盟(Union for International Cancer Control, UICC)2016标准[2]TNM分期,Ⅰ+Ⅱ期为59例,Ⅲ+Ⅳ期为41例; 高分化为32例,中分化为34例,低分化为34例。收集同期住院患者癌旁组织40例和良性病变组织40例(其中,肺支气管硬化性血管瘤5例,肺结核10例,支气管纤维瘤4例,肺大疱4例,肺外伤17例)作为对照。上述患者在年龄和性别等一般资料方面比较,差异均无统计学意义(均P>0.05),且患者术前未接受放疗和化疗等抗肿瘤治疗,所有标本取得均征求过患者及家属同意并签署知情同意书。
1.2 随访每6个月电话随访1次,随访至2016年12月, 无失访病例。记录NSCLC患者生存情况。
1.3 RT-PCR法检测mRNA表达水平采用GenElute石蜡包埋组织RNA纯化试剂盒(SIGMA公司,美国)抽提组织总RNA,石蜡包埋组织厚度为20 μm,具体操作步骤按照试剂盒说明书。
RT-PCR反应反转录体系为20 μL:dNTP mix(10 mmol/L)0.15 μL,反转录酶(50 U/μL)1 μL, 10×RT缓冲液2 μL, RNA酶抑制剂(20 U/μL)0.19 μL, RNase-free water 4.2 μL, 模板RNA 1 μg。
实时PCR仪器为ABI 7900(ABI公司,美国)。反应体系10 μL:2×SYBR MIX(ABI公司, 美国)5 μL, 引物(10 μmol/L) 0.2 μL,灭菌水3.8 μL, RNA(100 ng/μL) 1 μL;反应条件:预变性94℃ 3 min,变性94℃ 30 s,退火60℃ 30 s,延伸72℃ 30 s,30个循环,总延伸72℃ 5 min。引物序列:WT1上游引物5′-CACAGCACAGGGTACGAGAG-3′,下游引物5′-CAAGAGTCGGGGCTACTCCA-3′,条带长度为133 bp; β-actin上游引物5′-AGAGCTACGAGCTGCCTGAC-3′,下游引物5′-AGCACTGTGTTGGCGTACAG-3′,条带长度为100 bp。
以癌旁组织WT1基因mRNA相对表达量为内参对照组,记录各组Ct值,按照2-ΔΔCt法计算各组WT1基因相对表达量,癌组织相对表达量高于对照组表达量均值为高表达,反之为低表达。
1.4 统计学分析应用SPSS 17.0统计软件进行数据分析。计量数据采用均数±标准差(x±s)表示,组间比较采用两组独立样本t检验。采用Kaplan-Meier法作生存分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 NSCLC组织WT1 mRNA相对表达水平对照组WT1基因mRNA相对表达量为(1.001± 0.002),NSCLC组为(4.295±1.477);NSCLC组WT1基因mRNA相对表达量高于良性病变组,差异具有统计学意义(P<0.01)。
2.2 不同类型NSCLC组织WT1基因mRNA相对表达水平NSCLC患者组织标本在年龄和性别等方面比较,差异均无统计学意义(均P>0.05)。组织未分型组WT1基因mRNA相对表达水平高于鳞状细胞癌及腺癌组,差异具有统计学意义(P<0.01)。低分化组WT1基因mRNA相对表达水平高于中高分化组(P<0.01)。TNM分期Ⅲ+Ⅳ期组WT1基因mRNA相对表达水平高于Ⅰ+Ⅱ期组(P<0.05)。淋巴结转移阳性组WT1基因mRNA相对表达水平高于阴性组(P<0.01,表 1)。
| 临床特征 | 例数 | mRNA相对表达量 | F值 | P值 |
| 年龄 | 2.890 | 0.085 | ||
| >52.5岁 | 54 | 1.030±0.702 | ||
| <52.5岁 | 46 | 1.038±0.602 | ||
| 性别 | 0.197 | 0.675 | ||
| 男 | 78 | 1.029±0.390 | ||
| 女 | 22 | 1.038±0.297 | ||
| 病理类型 | 9.329 | <0.01 | ||
| 鳞癌/腺癌 | 76 | 4.132±0.576 | ||
| 组织未分型 | 24 | 6.118±0.525 | ||
| 分化程度 | 8.012 | <0.01 | ||
| 低分化 | 34 | 3.973±0.329 | ||
| 中高分化 | 66 | 5.683±0.383 | ||
| TNM分期 | 7.480 | 0.026 | ||
| Ⅰ+Ⅱ期 | 59 | 4.829±0.137 | ||
| Ⅲ+Ⅳ期 | 41 | 5.685±0.473 | ||
| 淋巴结转移 | 4.892 | <0.01 | ||
| 阳性 | 28 | 5.186±0.618 | ||
| 阴性 | 72 | 3.165±0.499 |
以对照组WT1表达量均值1.001为标准,NSCLC患者中表达≥1.001的患者为高水平表达组,<1.001的患者为低水平表达组。NSCLC患者中WT1 mRNA相对高水平表达组中位生存期为43个月,WT1 mRNA相对低水平表达组中位生存期为59个月,WT1 mRNA相对高水平表达组生存期低于低水平表达组(P=0.002,图 1)。提示NSCLC患者肿瘤组织WT1 mRNA表达水平与患者预后密切相关。
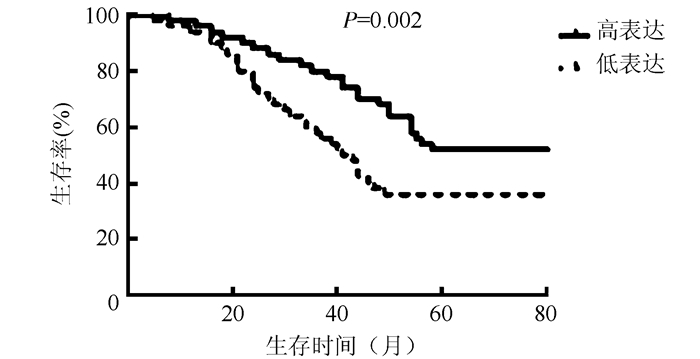
|
| 图 1 WT1 mRNA相对表达量对NSCLC患者总生存期的影响 Fig.1 Effect of WT1 mRNA relative expression on the overall survival of NSCLC patients |
全球每年有180万例被确诊为肺癌,每年有近160万例死于肺癌,其5年生存率仅为4%~17%[3]。现有的诊断手段也仅限于影像学和免疫组织化学等传统手段。现有的治疗手段也十分有限,手术治疗的指征也仅针对早、中期肿瘤患者,对于晚期肿瘤患者,放、化疗仍是仅有手段,早发现、早诊断依然是治疗NSCLC的金标准,因此寻找合适的肿瘤标志物迫在眉睫。
WT1基因定位于11q13,其基因序列包括10个外显子,其编码3 kb mRNA序列,由于其转录过程具有多种可变性剪切方式,因此具有多种mRNA变异体。WT1基因编码一类锌指结构转录因子,在细胞正常生理代谢中具有重要作用。人体胚胎形成阶段,在多种器官中WT1基因表达具有显著的时间和组织特异性,如肾脏[4]、造血器官[5]和神经系统发育[6]等。但是在人体多种实体肿瘤和血液系统肿瘤细胞中,WT1基因均存在特异性表达。关于WT1基因到底是抑癌基因还是原癌基因的争论一直没有停止。最初研究显示,在人类肾癌组织中,多数标本存在WT1基因突变,WT1基因的突变与白血病发生、发展及预后密切相关[7],因此WT1基因被认为是一种抑癌基因;但是在急性白血病[8]、骨髓增生异常综合症[8]、乳腺癌[9]和子宫内膜癌[10]等肿瘤组织中,WT1基因均出现特异性高表达,故WT1基因也可认为是一种原癌基因。miR-361通过下调WT1的表达,抑制NSCLC细胞的增殖[11-12]。本研究结果显示,与良性病变组织比较,NSCLC组织中WT1 mRNA相对表达水平增高,提示WT1基因可能与NSCLC发生与发展密切相关;而根据不同临床病理特征分类的NSCLC组织中,组织未分型、低分化和TNM分期Ⅲ+Ⅳ期肿瘤组织中,WT1基因mRNA相对表达水平均上调,提示WT1基因表达与NSCLC临床病理分期相关,WT1基因mRNA表达水平越高,临床病理分期恶性程度越高。Zheng等[12]研究显示,在WT1基因高表达急性髓系细胞性白血病患者2年生存率低于WT1低表达组,这与本研究结果相符。本研究中,NSCLC患者WT1 mRNA高表达组生存期43个月,低于低表达组的59个月,提示WT1 mRNA相对表达水平与NSCLC患者预后不良密切相关。本研究结果提示,WT1基因在NSCLC组织中作为一类癌基因,WT1 mRNA表达水平越高,肿瘤病理分期呈现低分化等恶性程度越高,患者预后不良。
现有的研究理论认为,肿瘤的发生可能是由于肿瘤细胞单克隆演变而来的,也就是肿瘤干细胞理论,而肿瘤干细胞与癌症的发生与发展、肿瘤细胞的耐药以及免疫耐受息息相关。WT1基因在CD34+CD38-CD123+白血病干细胞中呈现高表达[13],提示WT1基因参与白血病干细胞的信号调控。在急性髓细胞性白血病细胞中,WT1基因通过激活Janus kinase/signal transducers and activators of transcription(JAK/STAT)、核转录因子κB(nuclear factor κB,NF-κB)、Wnt/catenin和microRNA等信号通路[14],调控白血病干细胞干性、侵袭和耐药等功能。在NSCLC组织中,JAK/STAT等信号通路呈现过度激活,因此WT1基因可能在非小细胞肺癌干细胞调控中发挥重要作用。在NSCLC细胞中miR-361通过下调WT1基因的表达,抑制NSCLC细胞的增殖[11],因此WT1调控NSCLC的肿瘤增殖过程。在乳腺肿瘤组织中, WT1表达与上皮细胞间质化过程密切相关[9]。WT1基因在NSCLC组织中的作用机制可能通过激活JAK/STAT、NF-κB和Wnt/catenin等信号通路维持肿瘤干细胞干性,刺激肿瘤细胞增殖、诱导肿瘤细胞侵袭与迁移,从而促进肿瘤的发生与发展。
综上所述,WT1基因可通过多种途径刺激肿瘤细胞的增殖,诱导肿瘤细胞侵袭及迁移过程。在NSCLC组织中,WT1基因普遍存在高表达现象,且WT1基因表达水平与非小细胞肺癌临床病理分期及患者总生存期密切相关。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Akaza H, Kawahara N, Fukuda T, et al. UICC-ARO symposium at the UICC 2016 World Cancer Congress how can we mobilize action to realize UHC in Asia?[J]. Asian Pac J Cancer Prev, 2017, 18(11): 2897-2901. |
| [3] |
夏冰, 江洪, 王利民, 等. 肺癌30年临床研究进展[J]. 实用肿瘤杂志, 2016, 31(4): 296-300. |
| [4] |
Wang Z, Shao M, Liu Y. Promotion of Wilms' tumor cells migration and invasion by mono-2-ethyhexyl phthalate (MEHP) via activation of NF-κB signals[J]. Chem-Biol Interact, 2017, 270: 1. DOI:10.1016/j.cbi.2017.04.004 |
| [5] |
Xiang L, Zhou J, Weiying GU, et al. Changes in expression of WT1 during induced differentiation of the acute myeloid leukemia cell lines by treatment with 5-aza-2'-deoxycytidine and all-trans retinoic acid[J]. Oncol Lett, 2016, 11(2): 1521. DOI:10.3892/ol.2015.4052 |
| [6] |
Wilm B, Muñoz-Chapuli R. The role of WT1 in embryonic development and normal organ homeostasis[J]. Methods Mol Biol, 2016, 1467: 23-39. DOI:10.1007/978-1-4939-4023-3 |
| [7] |
李木青, 白春林, 覃艳红, 等. WT1突变与急性髓系白血病预后关系的Meta分析[J]. 中华临床医师杂志:电子版, 2016, 10(21): 3217-3222. |
| [8] |
Niavarani A, Herold T, Reyal Y, et al. A 4-gene expression score associated with high levels of Wilms Tumor-1(WT1)expression is an adverse prognostic factor in acute myeloid leukaemia[J]. Br J Haematol, 2016, 172(3): 401-411. DOI:10.1111/bjh.13836 |
| [9] |
Artibani M, Sims AH, Slight J, et al. WT1 expression in breast cancer disrupts the epithelial/mesenchymal balance of tumour cells and correlates with the metabolic response to docetaxel[J]. Sci Rep, 2017, 7: 45255. DOI:10.1038/srep45255 |
| [10] |
Tamura I, Shirafuta Y, Jozaki K, et al. Novel function of a transcription factor WT1 in regulating decidualization in human endometrial stromal cells and its molecular mechanism[J]. Endocrinology, 2017, 158(10): 3696. DOI:10.1210/en.2017-00478 |
| [11] |
Yang S, Zhang Y, Zhao X, et al. microRNA-361 targets Wilms' tumor 1 to inhibit the growth, migration and invasion of non-small-cell lung cancer cells[J]. Mol Med Rep, 2016, 14(6): 5415-5421. DOI:10.3892/mmr.2016.5858 |
| [12] |
Zheng YT, Li BX, Sun YJ, et al. Expression of WT1 gene in bone marrow of patients with acute myeloid leukemia and its influence on prognosis[J]. J Exp Hematol, 2016, 24(3): 649-654. |
| [13] |
Lyu Y, Lou J, Yang Y, et al. Dysfunction of the WT1-MEG3 signaling promotes AML leukemogenesis via p53 dependent and independent pathways[J]. Leukemia, 2017, 31(12): 627-635. |
| [14] |
Guo N, Guo J, Su D. MicroRNA-206 and its down-regulation of Wilms' Tumor-1 dictate podocyte health in adriamycin-induced nephropathy[J]. Ren Fail, 2016, 38(6): 989-995. DOI:10.3109/0886022X.2016.1165119 |
 2019, Vol. 34
2019, Vol. 34


