文章信息
- 张建斌, 贺艳锋
- Zhang Jianbin, He Yanfeng
- 102例前列腺癌根治术后Ki-67的表达与预后价值分析
- Ki-67 proliferative index in patients with prostate cancer following radical prostatectomy and its prognostic value
- 实用肿瘤杂志, 2019, 34(1): 16-22
- Journal of Practical Oncology, 2019, 34(1): 16-22
基金项目
- 陕西省自然科学基金(2013JM4016)
-
作者简介
- 张建斌(1972-), 男, 陕西渭南人, 副主任医师, 从事泌尿系统肿瘤诊治研究.
-
通信作者
- 贺艳锋, E-mail:454630482@qq.com
-
文章历史
- 收稿日期:2018-01-25
鉴于前列腺癌(prostate cancer,PC)在老年人口中的高发病率以及目前临床普遍存在的过度治疗情况,在进行具体治疗之前,医师需要事先区分无痛性和侵袭性PC。尽管肿瘤特征的临床和病理评估能够提供预后信息,但每例患者预后情况不尽相同导致难以准确预测。迄今为止还没有将基于组织的标记纳入常规临床实践中,但已经有许多研究在鉴定与PC行为相关的生物标志方面进行了大量工作[1]。本研究设计Canary前列腺癌预后组织微阵列(Canary tissue microarray prognosis,CTMAP),其主要目的是验证用于预测前列腺癌根治术(radical prostatectomy,RP) PC复发率的潜在生物标志物。综合性文献综述和近期一项有关预后PC生物标志物的meta分析表明,Ki-67是与PC临床结果联系最紧密的组织标志物[2-4]。Ki-67在前列腺穿刺活检、经尿道前列腺切除术和前列腺切除术标本中具有独立的预后价值,如与生化和临床复发独立关联(无论采取何种治疗手段)。此外,Ki-67作为一种较好的生物标志物,其有再现性、易获取及存在阳性对照的优势。Ki-67作为肿瘤增殖的标志物,已成功地应用于包括内分泌和神经内分泌肿瘤、乳腺癌、滋养细胞肿瘤、淋巴瘤、软组织和脑肿瘤在内的多种肿瘤的鉴别诊断、分级、预测和治疗反应的评估[5-7]。随着对有助于PC患者临床管理的生物标志物的需求日益增加,本研究试图探讨Ki-67表达是否与PC的特定不良预后相关。
1 资料与方法 1.1 一般资料采用数字随机方法选取2009年2月至2013年6月在本院接受RP治疗的有完整高质量Ki-67肿瘤数据的PC患者102例。年龄50~77岁,中位年龄63岁。其组织样本组成组织微阵列(tissue microarray,TMA)。该队列中所包含的PC患者,在随访期间,出现生化复发和非复发的样本数量大致相等。PC复发定义为满足以下任意1项:(1)RP后单个血清前列腺特异抗原(prostate specific antigen,PSA)水平>0.2 ng/mL>8周;(2)RP后接受抢救或二次治疗;(3)临床或影像学证据显示,RP后疾病转移。中位随访时间为3年(0.5~8年)。
TMA的目的是评估能够提供独立于临床和病理信息的预后的生物标志物。由于Gleason评分(Gleason score,GS)是有力的预后预测因子,对GS评分(3+3)和(3+4)复发病例以及GS评分(4+4)的非复发病例进行过采样。这种策略降低了GS的预后意义,能够验证与PC临床结果相关而与GS无关的生物标志物。本研究约200个4%甲醛固定和石蜡包埋的RP样品,每个样品分布在4个TMA块上。每个TMA块(规格11×16)由25个RP标本和8个健康对照人群的组织制成,包括扁桃体、前列腺、肾脏、结肠和肝脏。每个PC(通过1 mm穿孔机取样)包含3个癌核,癌核来源于显性肿瘤结节中的最高等级癌症。此外,从每例患者的组织学良性前列腺组织中获取1个核。本研究通过医院伦理审查委员会的批准。
1.2 Ki-67免疫组织化学染色应用在自动免疫染色仪(Bond Ⅲ,德国Wetzlar徕卡生物系统公司)上对未染色的4 μmol/L TMA切片进行脱蜡处理。首先应用脱蜡溶液对切片进行3次脱蜡处理,之后分别应用100%乙醇和Bond洗涤液对切片进行3次处理。免疫染色是在经CAP认证的诊断免疫组织化学实验室中按照标准化方案进行的。使用ER2缓冲液(pH 9.0)对Bond Ⅲ进行抗原回收30 min。在漂洗和内源过氧化物酶阻断之后,应用后初级IgG连接物,Bond洗涤液和去离子水反复冲洗切片。将具有小鼠单克隆IgG1抗体和Ki-67抗体(美国DAKO公司)的切片培养15 min。然后用Bond洗涤液多次冲洗切片,之后应用聚合物检测试剂孵育具有聚合物抗小鼠多HRP-IgG的切片8 min。反复冲洗切片,与3,3′-二氨基联苯胺四盐酸盐反应10 min,用苏木精对比染色5 min。通过省略初级抗体步骤,用非免疫小鼠血清代替等方法制备免疫染色的阴性对照。将每个TMA切片上存在的正常扁桃体组织核作为Ki-67染色的内部阳性对照。
1.3 自动图像分析TMA切片在Aperio扫描镜上以×200倍进行扫描(Aperio技术,美国Vista公司)。高分辨率数字图像文件被创建并保存在基于网络的Spectrum Plus(Aperio Technologies)数字切片管理器中使用TMALab分离高分辨率数字图像,从而对网状组织核进行进一步的自动分析。应用核定量算法确定每个核区肿瘤细胞的Ki-67染色,核定量算法由经验丰富的泌尿生殖病理学家调节,更好鉴别Ki-67阳性核和苏木精对比染色阴性核。手动校准肿瘤细胞大小和形状的阈值以最大限度地排除基质细胞和淋巴细胞。重复染后TMA切片中有弱或阴性内部对照病例(扁桃体组织)的病例被排除在进一步分析之外。应用软件对每张切片选择3个染色细胞核密集区域,计算各区域阳性染色细胞核所占百分比(%),取其平均值为该例患者Ki-67增殖指数(proliferative index, PI),取其最大值为Ki-67最大阳性率。所有患者各区域所获染色肿瘤细胞核个数为19~12 091个,中位数为302个。
1.4 统计学分析在临床数据集中收集患者特征,包括术前血清PSA水平、病理分期、GS、精囊浸润(seminal vesicle infiltration,SVI)、淋巴结外浸润(extracapsular extension,ECE)和手术切缘状况。总共102例患者有完整的高质量Ki-67肿瘤数据可供分析,且阳性对照可接受强均匀TMA染色。患者特征的汇总统计数据以频数(百分比)表示。应用均数、标准差和极差对Ki-67和术前PSA数据进行总结。
使用SAS 9.0软件进行统计学分析,Spotfire S+ 8.2制作图表。两组患者的Ki-67 PI比较采用Wilcoxon秩和检验或Kruskal-Wallis检验。应用Pearson相关试验评估Ki-67 PI与术前PSA的相关性。应用方差分量分析估计Ki-67阳性核的肿瘤间和肿瘤内变异。采用Kaplan-Meier曲线分析患者生存率。所有检验均为双侧检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 Ki-67 PI与临床病理特征的相关性通过Aperio系统的染色自动检测和阳性细胞核定量对102例RP手术获取的前列腺组织核中的Ki-67 PI进行测定。Ki-67 PI为0%~35.6%,中位值为2.19%。结果发现,Ki-67 PI在不同病理分期、SVI、ECE和GS之间比较,差异均具有统计学意义(均P < 0.05,表 1)。Ki-67 PI在病理分期为pT3/pT4和pT2的患者中升高(P < 0.01),在SVI(P=0.02)和ECE(P < 0.01)患者中同样升高。Ki-67 PI在GS评分方面比较,差异也具有统计学意义(P < 0.01)。针对Ki-67 PI和Ki-67最大阳性率进行的Kruskal - Wallis检验显示,高GS与高Ki-67 PI之间存在正相关(P<0.01)。相关分析显示,Ki-67 PI与术前PSM阳性或PSA阳性无相关(P=0.21和P=0.36)。肿瘤内Ki-67 PI的变异为0.39(95% CI:0.36~0.41),而肿瘤间变异为0.68(95% CI:0.61~0.76)。肿瘤间变异占总变异的64.2%。
| 临床病理特征 | 例数 | Ki-67%增殖指数 | P值 | |
| 均数±标准差(x±s) | 中位数(范围) | |||
| 手术切缘 | 0.210 | |||
| 丢失 | 17 | 3.31±3.16 | 2.53(0.07~23.00) | |
| 阴性 | 56 | 2.93±2.81 | 2.04(0.00~26.01) | |
| 阳性 | 29 | 3.22±3.08 | 2.23(0.00~25.50 | |
| 病理分期 | < 0.01 | |||
| 丢失 | 19 | 3.40±3.42 | 2.38(0.00~23.00) | |
| pT2 | 58 | 2.72±2.58 | 1.94(0.00~26.01) | |
| pT3/pT4 | 25 | 3.64±3.25 | 2.79(0.00~25.50) | |
| 精囊浸润 | 0.020 | |||
| 丢失 | 1 | 2.52±1.85 | 2.18(0.89~7.42) | |
| 无 | 93 | 3.03±2.95 | 2.14(0.00~26.01) | |
| 有 | 8 | 3.84±3.11 | 3.41(0.21~15.62) | |
| 转移淋巴结包膜外扩散 | < 0.01 | |||
| 丢失 | 1 | 2.09±1.63 | 1.46(0.57~5.30) | |
| 无 | 75 | 2.88±2.78 | 2.02(0.00~26.01) | |
| 有 | 26 | 3.67±3.38 | 2.69(0.00~25.50) | |
| Gleason评分 | < 0.01 | |||
| 丢失 | 1 | 3.27±4.44 | 1.36(0.56~13.63) | |
| ≤6 | 40 | 2.46±2.10 | 1.93(0.00~14.68) | |
| 3+4 | 37 | 3.09±2.59 | 2.42(0.00~23.00) | |
| 4+3 | 13 | 3.64±3.20 | 2.40(0.09~15.62) | |
| 8-10 | 11 | 4.74±5.12 | 2.77(0.22~26.01) | |
| 合计 | 102 | 3.07±2.95 | 2.19(0.00~26.01) | |
| 注 丢失指未纳入该组统计分析的例数;采用Wilcoxon秩和检验或Kruskal-Wallis检验. | ||||
单变量Cox比例风险模型显示Ki-67 PI与RFS(连续变量)(每增加1%,HR=1.04,P=0.002)以及Ki-67最大阳性率(每增加1%,HR=1.03,P=0.005)相关。与RFS事件相关的其他PC特征包括PSM、存在SVI、存在ECE以及将术前PSA作为连续变量的单位增量值[Log(PSA)](均P<0.01)。2个多变量Cox比例危险模型显示,在调整其他临床因素(PSM、SVI、GS、ECE和术前PSA)后,Ki-67 PI(模型1)和Ki-67最大阳性率(模型2)较高均与RFS较差相关(HR=1.07、1.04;均P < 0.05,表 2)。不同Cox比例风险模型的一致性指数显示,与单凭临床资料预测术后RFS比较,Ki-67值预测术后RFS的能力更好,在连续Ki-67 PI和Ki-67最大阳性率方面尤其明显。
| 模型 | 因素 | 比较 | 风险比 | 95% CI | P值 |
| RFS模型1(n=63,#events=28) | Ki-67 PI | 1%升高 | 1.07 | 1.03~1.11 | 0.001 |
| 手术切缘 | 阳性vs阴性 | 1.41 | 1.09~1.84 | 0.010 | |
| 精囊浸润 | 是vs否 | 1.85 | 1.23~2.80 | 0.003 | |
| Gleason评分 | (3+4) vs 6 | 1.22 | 0.90~1.66 | 0.005 | |
| (4+3) vs 6 | 1.88 | 1.33~2.66 | |||
| (8-10) vs 6 | 1.42 | 0.96~2.09 | |||
| 病理分期 | pT3/pT4 vs pT2 | 1.43 | 1.07~1.92 | 0.020 | |
| Log(PSA) | 升高1个单位 | 1.62 | 1.35~1.96 | <0.01 | |
| RFS模型2(n=63,#events=28) | Ki-67最大阳性率 | 1%升高 | 1.04 | 1.01~1.07 | 0.007 |
| 手术切缘 | 阳性vs阴性 | 1.40 | 1.08~1.83 | 0.010 | |
| 精囊浸润 | 是vs否 | 1.85 | 1.22~2.79 | 0.004 | |
| Gleason评分 | 3+4 vs 6 | 1.24 | 0.91~1.67 | 0.003 | |
| 4+3 vs 6 | 1.91 | 1.35~2.70 | |||
| 8-10 vs 6 | 1.46 | 0.99~2.15 | |||
| 病理分期 | pT3/pT4 vs pT2 | 1.44 | 1.07~1.93 | 0.020 | |
| Log(PSA) | 升高1个单位 | 1.61 | 1.34~1.95 | <0.01 | |
| OS(n=98,#events=10) | Ki-67 PI | 1%升高 | 1.09 | 1.01~1.16 | 0.020 |
| Gleason评分 | (3+4) vs ≤6 | 0.87 | 0.44~1.72 | 0.680 | |
| (4+3) vs ≤6 | 1.14 | 0.46~2.84 | 0.780 | ||
| (8-10) vs ≤6 | 3.28 | 1.65~6.51 | 0.001 | ||
| DSS(n=87,#events=5) | Ki-67 PI | 1%升高 | 1.10 | 1.02~1.18 | 0.020 |
| Log(PSA) | 升高1个单位 | 1.98 | 1.35~2.89 | 0.005 | |
| Gleason评分 | (3+4) vs ≤6 | 2.27 | 0.93~5.52 | 0.070 | |
| (4+3) vs ≤6 | 2.75 | 0.97~7.81 | 0.060 | ||
| (8-10) vs ≤6 | 5.13 | 1.92~13.75 | 0.001 | ||
| 注 DSS:疾病特异生存(disease-specific survival);OS:总生存(overall survival);RFS:无复发生存(recurrence-free survival);RFS事件被定义为任何复发、转移或PC死亡;模型1和模型2是分别使用Ki-67 PI和Ki-67最大阳性率的模型;OS事件被定义为任何原因的死亡;DSS事件被定义为PC转移或死亡;OS和DSS只有1个最终模型;最后的模型中只包含显著因素. | |||||
单变量Cox比例危险分析显示,OS较差与Ki-67 PI(P=0.003)、术前PSA(P=0.018)、患者处于pT3/pT4期与pT2期(P=0.01)、SVI(P < 0.01)、ECE(P=0.01)和GS[(8-10) vs ≤6,P=0.008]有关。DSS较差与Ki-67 PI(P=0.004)、术前PSA(P < 0.01)、PSM(P=0.02)、患者处于pT3/pT4期与pT2期(P < 0.01)、SVI(P=0.01)和GS[(8-10) vs ≤6,P < 0.01]密切相关。OS的多变量Cox比例风险模型中调整术前PSA、PSM、病理分期、SVI和ECE后,OS较差与Ki-67 PI增加1%(HR=1.09,P=0.02)或GS≥8(≥8 vs ≤6;HR=3.28,P=0.001)相关。使用相同的模型研究DSS显示,DSS较差与Ki-67 PI增加1%(HR=1.1,P=0.02)、术前PSA(HR=1.98,P=0.005)、GS≥8(≥8 vs ≤6;HR=5.13,P=0.001)相关(表 2)。
2.4 定义临床上适用的Ki-67 PI分界点用鞅残差分析研究Ki-67 PI和术前PSA的功能形式和潜在分界点。采用线性回归法和术前PSA的对数变换进行建模。鞅残差图显示没有离散的分界点[通过Log(PSA)或Ki-67 PI值进行二分样本预测]。因此,测试3个不同的Ki-67分界点以对病例进行等分,从而评估其与临床终点的相关性:Ki-67 PI中位值(2.19%)、Ki-67最大阳性率中位值(3.11%)和5%分界点,这些分界点已经成功地应用于先前的局部PC研究中。当根据2.19%对Ki-67 PI进行二分化时,单变量Cox比例风险模型显示Ki-67 PI与RFS有相关性(≥2.19% vs < 2.19%,HR=0.72,P=0.01);当根据3.11%对Ki-67最大阳性率进行二分化时,Ki-67最大阳性率与RFS无相关性(≥3.11% vs < 3.11%,HR=0.86,P=0.06)。对Ki-67 PI进行二分化的预后多变量Cox比例风险模型,与对Ki-67最大阳性率进行二分化的预后多变量Cox比例风险模型之间无相关性(HR=1.14,P=0.28;HR=1.31,P=0.08)。此外,无论是Ki-67分界点为2.19%还是3.11%,都没有监测到Ki-67与OS和DSS之间存在相关性。当5%为分界点时,Ki-67 PI的多变量Cox比例风险模型(模型1)和Ki-67最大阳性率的多变量Cox比例风险模型(模型2)均与RFS存在相关性:在调整术前PSA、手术切缘、SVI和GS后,肿瘤Ki-67 PI≥5%[HR=1.47,P=0.001(模型1)]或Ki-67最大阳性率≥5%[HR=1.31,P=0.030(模型2)]与RFS恶化相关。OS的多变量Cox比例风险模型结果显示,OS恶化和Ki-67 PI≥5%相关(HR=2.03,95% CI:1.09~3.80,P=0.030)。DSS分析显示, 其与GS(HR=2.60~8.11,P < 0.01)和Log术前PSA(HR=2.01,P=0.006)相关,但与Ki-67在5%分界点进行的二分化无相关性(HR=0.95,P=0.67)。按中心分层的RFS多变量Cox回归分析见表 3。
| 模型 | 因素 | 比较 | 风险比(HR) | 95% CI | P值 |
| RFS模型1(n=71,#events=32) | Ki-67 PI | ≥5% vs < 5% | 1.471 | 1.110~1.950 | <0.01 |
| 手术切缘 | 阳性vs阴性 | 1.598 | 1.248~2.047 | <0.01 | |
| 精囊浸润 | 是vs否 | 2.072 | 1.430~3.002 | <0.01 | |
| Gleason评分 | (3+4) vs 6 | 1.297 | 0.972~1.732 | 0.004 | |
| (4+3) vs 6 | 1.808 | 1.273~2.568 | |||
| (8-10) vs 6 | 1.626 | 1.126~2.348 | |||
| Log(PSA) | 升高1个单位 | 1.536 | 1.288~1.831 | <0.01 | |
| RFS模型1(n=71,#events=32) | Ki-67最大阳性率 | ≥5% vs < 5% | 1.314 | 1.033~1.672 | 0.030 |
| 手术切缘 | 阳性vs阴性 | 1.596 | 1.246~2.043 | <0.01 | |
| 精囊浸润 | 是vs否 | 2.119 | 1.462~3.070 | <0.01 | |
| (3+4) vs 6 | 1.317 | 0.986~1.757 | <0.01 | ||
| (4+3) vs 6 | 1.876 | 1.324~2.658 | |||
| (8-10) vs 6 | 1.670 | 1.159~2.406 | |||
| Log(PSA) | 升高1个单位 | 1.505 | 1.264~1.792 | <0.01 |
Kaplan-Meier分析显示,Ki-67 PI值高于中位数(2.19%)的患者,其RFS降低(P < 0.05),且在5%分界点时更为明显(P < 0.01,图 1)。此外,当以5%为分界点时,Kaplan-Meier生存曲线能够预测OS(P=0.045),但当分界点为2.19%或3.11%则无法进行预测(P=0.82)。本段落中的所有P值都是通过对数秩测试生成的。
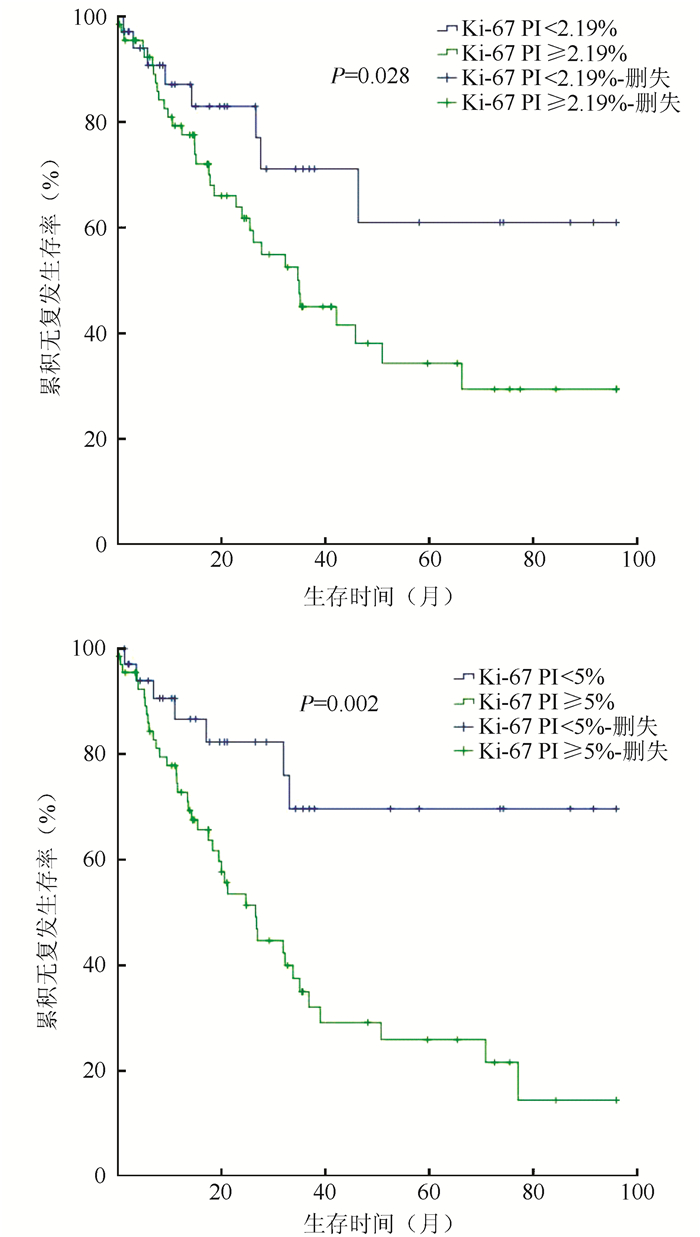
|
| 图 1 以Ki-67 PI中位数2.19%和5%为分界点的前列腺癌根治术后无复发生存曲线 Fig.1 Recurrence-free survival curves using median Ki-67 PI (2.19%) or 5% as Ki-67 PI cutoff-point after radical prostatectomy |
本研究根据原位杂交和免疫组织化学实验最低信息规范(minimum information specification for in situ hybridization and immunohistochemistry experiments,MISHFISHIE)和注释(肿瘤标志物预后研究的报告建议)在102例前列腺根治术治疗的患者中进行Ki-67验证研究[8],评估Ki-67测试是否能够有效预测患者预后,以及基于图像的自动评分系统是否满足临床应用标准。结果显示,Ki-67增加作为连续变量与pT3 /pT4期、SVI或ECE的存在以及高GS相关,但与PSM和(或)术前PSA水平无关。在对多变量分析的其他因素进行调整后,Ki-67(连续变量)在logistic回归模型和Cox比例风险模型中,依旧是无复发、整体和DSS的独立预测因素。这些发现证实,Ki-67是PC结果的独立预测性生物标志物。每例患者(热点相同)Ki-67 PI和Ki-67最大阳性率分界点分别为2.19%和3.11%。这些研究结果与其他几项研究具有可比性[9-13],而分界点的下限为2.4%~26%。这些研究中Ki-67 PI范围可以反映患者的风险概况、肿瘤异质性、分析前后变量、手动计数与自动计数的差异,以及根据平均值、中位值、最大值或四分位数确定合适的分界点时的不同统计方法[13-16]。本研究中Ki-67 PI相对较低的原因可能是研究人群多数来源于复发的低级别患者和非复发的高级别患者,这可能会导致研究对Ki-67 PI较低的病例进行过采样。研究人员应用使用自动化的自动细胞图像系统(antomated cellular imaging system,ACIS)评分对肿瘤放射治疗组PC患者进行研究(RTOG 94-08),研究得出的Ki-67 PI中位值与本研究十分接近(2.65%),虽然自动评分略低于在同一队列中手工评分的中位值(3.85%);手动评分可能产生更高的PI,因为手动评分通常计数的细胞核数量更少,且染色细胞核(热点)区域被过采样的可能性更高[11]。本研究中的中位Ki-67 PI(2.19%)与该研究结果一致,中位Ki-67最大阳性率(3.11%)与人工评分热点也十分接近。
本研究结果提示2种将Ki-67 PI纳入临床实践的替代方法。在多变量分析中,Ki-67 PI与Ki-67最大阳性率结合其他临床和病理参数能够独立预测RFS。在这种情况下,可以将Ki-67 PI结合到临床风险模型中,例如计算机辅助风险系统(computer assisted pest risk analysis,CAPRA)或其他列线图,尽管可能需要针对未选择的人群调整模型的适当权重。或者,应用具有纯二分输出(阳性或阴性)的生物标志物将患者分为高风险组和低风险组,使其更容易纳入临床使用的风险模型中[17-19]。尽管无法使用鞅残差的Lowess平滑图在数据集中定义Ki-67 PI的分界点,但本研究验证5%分界点确实能够独立预测RFS(先前研究的结论),其HR(1.47)与GS(HR=1.29~1.81)、手术切缘状态(HR=1.59)和多1个单位的Log(PSA)(HR=1.54)具有可比性,但略低于SVI(HR=2.07)。此外,Kaplan-Meier曲线显示,低Ki-67组和高Ki-67组之间在5%时存在强曲线分离,其结果优于患者的Ki-67 PI中位值或最大值。目前尚不清楚5%是否是理想的分界点。然而,Kaplan-Meier分析还显示,无法区分Ki-67 PI(≤1%)非常低的肿瘤与Ki-67 PI在1%~5%的肿瘤,这意味着分界点可能≥5%。
因为本研究属于回顾性研究,且基于根治性前列腺切除术样本,此外还设计了特定的参数来帮助识别独立于临床预测因素的预后生物标志物,导致生物标志物在预测结果中的相对权重不能合并到现有的算法中。选择TMA结构中最高级别的区域进行研究,可能会限制非选择性随机活组织检查,并进一步混淆肿瘤的异质性。此外在一元分析中,Ki-67 PI在有利和高危临床和病理结果之间存在相当大的重叠,使得临床解读十分困难。对临床相关情况的转化需要在前瞻性队列中进行测试,如在低危人群进行主动监测或高危局部疾病辅助治疗的选择。本研究是基于小样本的癌症患者,虽然在许多方面与标准前列腺穿刺活检相当,但由于前列腺穿刺活检中可能存在取样错误的问题,因此需要在活检样本上进行验证。使用多参数MRI成像进行图像引导活检也许能够改善预后生物标志物的性能,原因在于此类技术能够改进对最大偶发病变的采样。然而,此假设尚需验证。
综上所述,在前列腺癌根治术治疗中,除GS、病理分期和PSA水平之外,Ki-67 PI也可以为RFS、DSS和OS提供独立的预后价值。Ki-67 PI作为连续变量,其预测能力最佳,且可以被纳入现有的或新的预测列线图。此外,Ki-67 PI作为一个二分变量,在5%分界点可以实现局部PC的风险分层。应进一步研究Ki-67 PI作为预后生物标志物在其他临床相关组队列中的作用,例如在进行主动监测的患者中以及可能在进行图像引导活检的患者中进行研究。
| [1] |
Fisher G, Yang ZH, Kudahetti S, et al. Prognostic value of Ki-67 for prostate cancer death in a conservatively managed cohort[J]. Br J Cancer, 2013, 108(2): 271-277. DOI:10.1038/bjc.2012.598 |
| [2] |
Hawley S, Fazli L, McKenney JK, et al. A model for the design and construction of a resource for the validation of prognostic prostate cancer biomarkers:the Canary Prostate Cancer Tissue Microarray[J]. Adv Anat Pathol, 2013, 20(1): 39. DOI:10.1097/PAP.0b013e31827b665b |
| [3] |
Kachroo N, Gnanapragasam VJ. The role of treatment modality on the utility of predictive tissue biomarkers in clinical prostate cancer:a systematic review[J]. J Cancer Res Clin Oncol, 2013, 139(1): 1-24. DOI:10.1007/s00432-012-1351-7 |
| [4] |
Zhao L, Yu N, Guo T, et al. Tissue biomarkers for prognosis of prostate cancer:a systematic review and meta-analysis[J]. Cancer Epidem Biomar, 2014, 23(6): 1047. DOI:10.1158/1055-9965.EPI-13-0696 |
| [5] |
Vörös A, Csörgö E, Nyári T, et al. An intra-and interobserver reproducibility analysis of the Ki-67 proliferation marker assessment on core biopsies of breast cancer patients and its potential clinical implications[J]. Pathobiology, 2013, 80(3): 111-118. DOI:10.1159/000343795 |
| [6] |
Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system[M]. Geneva: International Agency for Research on Cancer, 2010: 1089.
|
| [7] |
Luporsi E, Andr F, Spyratos F, et al. Ki-67:level of evidence and methodological considerations for its role in the clinical management of breast cancer:analytical and critical review[J]. Breast Cancer Res Tr, 2012, 132(3): 895-915. DOI:10.1007/s10549-011-1837-z |
| [8] |
Deutsch EW, Ball CA, Berman JJ, et al. Minimum information specification for in situ hybridization and immunohistochemistry experiments (MISFISHIE)[J]. Nat Biotechnol, 2008, 26(3): 305-312. DOI:10.1038/nbt1391 |
| [9] |
吴惠, 孟宇宏, 路平, 等. WT-1, AR和Ki-67在睾丸穿刺活检组织病理诊断中的应用[J]. 临床与实验病理学杂志, 2015, 31(8): 846-849. |
| [10] |
Kristiansen G. Diagnostic and prognostic molecular biomarkers for prostate cancer[J]. Histopathology, 2012, 60(1): 125-141. DOI:10.1111/j.1365-2559.2011.04083.x |
| [11] |
Verhoven B, Yan Y, Ritter M, et al. Ki-67 is an independent predictor of metastasis and cause-specific mortality for prostate cancer patients treated on Radiation Therapy Oncology Group (RTOG) 94-08[J]. Int J Radiat Oncol Biol Phys, 2013, 86(2): 317-323. DOI:10.1016/j.ijrobp.2013.01.016 |
| [12] |
Newcomb LF, Thompson IM, Boyer HD, et al. Outcomes of active surveillance for clinically localized prostate cancer in the prospective, multi-institutional Canary PASS cohort[J]. J Urol, 2016, 195(2): 313-320. DOI:10.1016/j.juro.2015.08.087 |
| [13] |
Tollefson MK, Karnes RJ, Kwon ED, et al.Prostate cancer Ki-67(MIB-1) expression, perineural invasion, and gleason score as biopsy-based predictors of prostate cancer mortality: the Mayo model[C]//Mayo Clinic Proceedings. Amsterdam: Elsevier, 2014, 89(3): 308-318.
|
| [14] |
Goltz D, Montani M, Braun M, et al. Prognostic relevance of proliferation markers (Ki-67, PHH3) within the cross-relation of ERG translocation and androgen receptor expression in prostate cancer[J]. Pathology, 2015, 47(7): 629-636. DOI:10.1097/PAT.0000000000000320 |
| [15] |
Warth A, Cortis J, Soltermann A, et al. Tumour cell proliferation (Ki-67) in non-small cell lung cancer:a critical reappraisal of its prognostic role[J]. Br J Cancer, 2014, 111(6): 1222-1229. DOI:10.1038/bjc.2014.402 |
| [16] |
Kim SH, Park WS, Park BR, et al. PSCA, Cox-2, and Ki-67 are independent, predictive markers of biochemical recurrence in clinically localized prostate cancer:a retrospective study[J]. Asian J Androl, 2017, 19(4): 458. DOI:10.4103/1008-682X.180798 |
| [17] |
杨元强, 许斌, 陈明. AR, ki-67, P53, COX-2和EGFR在前列腺癌的表达及其临床意义[J]. 中国临床研究, 2015, 28(6): 761-763. |
| [18] |
Kachroo N, Gnanapragasam VJ. The role of treatment modality on the utility of predictive tissue biomarkers in clinical prostate cancer:a systematic review[J]. J Cancer Res Clin Oncol, 2013, 139(1): 1-24. DOI:10.1007/s00432-012-1351-7 |
| [19] |
Altman DG, McShane LM, Sauerbrei W, et al. Reporting recommendations for tumor marker prognostic studies (REMARK):explanation and elaboration[J]. BMC Med, 2012, 10(1): 51. DOI:10.1186/1741-7015-10-51 |
 2019, Vol. 34
2019, Vol. 34


