文章信息
- 陈自喜, 张孟哲, 朱兆伟, 相芬芬, 吴蓉, 康向东
- Chen Zixi, Zhang Mengzhe, Zhu Zhaowei, Xiang Fenfen, Wu Rong, Kang Xiangdong
- 结肠癌患者外周血microRNA-21、淋巴细胞亚群及炎性因子的相关性研究
- Correlation of peripheral blood microRNA-21, lymphocyte subsets and inflammatory cytokines in colon cancer patients
- 实用肿瘤杂志, 2021, 36(4): 314-319
- Journal of Practical Oncology, 2021, 36(4): 314-319
基金项目
- 国家自然科学基金青年项目(31800988);上海中医药大学附属普陀医院人才项目(2017216A)
-
通信作者
-
吴蓉,E-mail: rong701@126.com
康向东,E-mail:xd_kang@163.com
-
文章历史
- 收稿日期:2020-01-07
结肠癌是消化道系统中常见的恶性肿瘤,发病率和死亡率不断上升,但其发病机制目前仍不清楚。近年来随着肿瘤免疫学研究的不断深入,已经明确细胞免疫是机体抗肿瘤免疫的主要方式,肿瘤的发生、发展、侵袭、转移及预后等与机体的免疫功能状态密切相关。microRNA(miRNA)是一类广泛存在于动植物中高度保守的非编码小RNA,含18~25个核苷酸,通过诱导蛋白编码基因mRNA的降解,从而抑制蛋白质的合成,达到转录后调控基因表达的目的[1-3]。miRNA有广泛的生物学功能,其中也包括免疫调节功能,在固有免疫及适应性免疫中发挥重要作用[4-5]。miR-21是较早被发现在实体瘤中高表达的一种miRNA[6-7],可能在肿瘤的发生和发展中发挥癌基因的作用。而本研究组前期研究发现,结肠癌组织中miR-21表达上调。运用miRNA表达谱芯片筛查结肠癌患者外周血单个核细胞miRNA差异表达谱发现,结直肠癌患者中miR-21表达上调。但对于miR-21在结肠癌发生和发展中的免疫调节作用研究尚浅。淋巴细胞作为机体细胞免疫调节的主要成分,在机体免疫应答过程中发挥关键作用。研究表明,淋巴细胞亚群比例不仅能够反映机体的免疫功能状态,还可以评估肿瘤发展和化疗药物疗效,具有重要的临床价值[8-9]。研究证实,炎性细胞因子肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)和白细胞介素-6(interleukin-6,IL-6)与肿瘤的发生和发展密切相关[10-11]。因此,本研究检测结肠癌患者及健康对照者外周血中miR-21表达水平和淋巴细胞亚群细胞数,分析二者相关性,并同时分析其与炎性细胞因子IL-6和TNF-α的相关性,从而探讨结肠癌患者中细胞免疫功能状态变化,为临床治疗提供参考依据。
1 资料与方法 1.1 一般资料收集2017年6月至2018年12月于上海中医药大学附属普陀医院收治住院的经病理和影像学确诊为结肠癌的53例患者(结肠癌组),其中男性30例,女性23例;年龄50~70岁,(62.4±7.0)岁。收集患者的外周血及临床资料,所有患者术前均未进行化疗,也未发现患有其他恶性肿瘤疾病。收集同期上海中医药大学附属普陀医院53例健康体检者外周血作为对照组,年龄26~58岁,(39.4±8.4)岁;男性29例,女性24例。所有标本获取均经过家属知情同意,并获得上海中医药大学附属普陀医院伦理委员会的批准。
1.2 仪器与试剂miRNA提取试剂盒和miScript SYBR® Green Mix试剂盒购自北京天根生化有限公司。miR-21引物由上海天根生物有限公司合成。淋巴细胞亚群检测试剂(流式细胞仪法-6色)和BD Trucount绝对计数管购自BD(上海)有限公司。IL-6(E-EL-H0102c)和TNF-α(E-EL-H0109c)试剂购自武汉伊莱瑞特生物科技有限公司。荧光定量PCR仪为Applied Biosystems 7300,购自美国应用生物系统(上海)有限公司。流式细胞仪BD FACSCanto购自美国BD(上海)有限公司。
1.3 检测方法 1.3.1 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)方法检测miR-21的表达所有研究对象于清晨空腹抽取外周静脉血(EDTA抗凝管)5 mL,室温静止后,于4℃下3 500 r/min离心15 min,吸取血浆分装于1.5 mL EP管,放入-80℃冰箱保存备用。采用Trizol法从血浆中提取总RNA,并测定提取的浓度和纯度。本研究所提取总RNA的质量和浓度均符合PCR反应要求。以U6为内参基因,用qRT-PCR法检测血浆中总miR-21。反应条件为:95℃预变性30 s,95℃变性10 s,60℃退火20 s,70℃延伸10 s,共40个循环。利用2-ΔΔCt公式计算miR-21相对表达量。miR-21正向引物为5'-ACGTTGTGTAGCTTATCAGACTG-3',反向引物为5'-AATGGTTGTTCTCCACACTCTC-3'; U6 miRNA正向引物为5'-ATTGGAACGATACAGAGAAGATT-3',反向引物为5'-GGAACGCTTCACGAATTTG-3'。
1.3.2 流式细胞仪检测外周血淋巴细胞亚群细胞数所有研究对象于清晨空腹抽取5 mL外周静脉血于含EDTA的试管中,从试管中吸取50 μL全血加入绝对计数管中,并加入10 μL荧光素标记的鼠抗人单克隆抗体CD45/CD3/CD4/CD8/CD(16+56)/ CD19混匀,室温避光20 min,加入450 μL 1×BD溶血素混匀,1 h内上机检测。
1.3.3 采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测细胞因子含量所有研究对象于清晨空腹抽取外周静脉血(EDTA抗凝管)5 mL,室温静止后,于4℃下3 500 r/min离心15 min,吸取血浆分装于1.5 mL EP管,放入-80℃冰箱保存备用。采用ELISA法检测细胞因子IL-6和TNF-α含量,检测方法严格按人IL-6/TNF-α ELISA试剂盒(江苏科特生物科技有限公司)说明书操作。
1.4 统计学分析采用SPSS 21.0统计学软件分析数据。计量资料采用均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。相关性分析采用Pearson检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血浆miRNA-21的临床诊断价值。以P < 0.05为差异具有统计学意义。
2 结果 2.1 结肠癌组与对照组血浆miR-21表达水平比较结肠癌组血浆中miR-21表达水平高于对照组[(4.48±2.20)vs(1.68±1.18),t=8.691,P < 0.01]。
2.2 血浆miR-21表达水平与结肠癌患者临床病理特征的关系结肠癌患者血浆miR-21水平在患者组织分化程度、淋巴结转移及TNM分期方面差异均具有统计学意义(均P < 0.05),在年龄、性别和肿瘤大小方面差异均无统计学意义(均P>0.05,表 1)。
| 临床病理特征 | 例数 | miR-21相对表达水平(x±s) | P值 |
| 年龄 | 0.082 | ||
| ≤60岁 | 21 | 5.34±2.52 | |
| >60岁 | 32 | 4.20±2.05 | |
| 性别 | 0.074 | ||
| 男性 | 30 | 3.98±1.89 | |
| 女性 | 23 | 5.03±2.42 | |
| 肿瘤大小 | 0.556 | ||
| ≤5cm | 21 | 4.88±2.51 | |
| >5cm | 32 | 4.13±1.85 | |
| 分化程度 | 0.010 | ||
| 低分化 | 18 | 3.00±1.08 | |
| 中高分化 | 35 | 5.16±2.26 | |
| TNM分期 | 0.010 | ||
| Ⅰ~Ⅱ期 | 22 | 2.98±0.98 | |
| Ⅲ~Ⅳ期 | 31 | 5.54±2.21 | |
| 淋巴结转移 | 0.010 | ||
| 有 | 25 | 6.15±1.89 | |
| 无 | 28 | 2.80±0.65 |
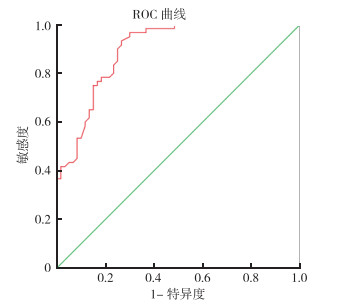
利用ROC曲线分析血浆miR-21的临床诊断价值发现,结肠癌患者区别于健康对照者ROC曲线下面积为89.5%,95% CI为0.84~0.95(图 1)。
|
| 图 1 血浆miR-21水平诊断结肠癌的ROC曲线 Fig.1 ROC curve of plasma miR-21 level for diagnosis of colon cancer |
结肠癌组外周血CD3+、CD4+和CD19+细胞数以及CD4+/CD8+比值均低于对照组,CD8+细胞数高于对照组(均P < 0.01)。结肠癌组与对照组自然杀伤细胞(natural killer cell,NK)细胞数比较,差异无统计学意义(P>0.05,表 2)。
| 监测指标 | 结肠癌组 | 对照组 | t值 | p值 |
| CD3+ | 907.09±167.68 | 1 272.18±201.26 | 10.150 | < 0.01 |
| CD4+ | 373.43±132.40 | 801.52±117.49 | 17.611 | < 0.01 |
| CD8+ | 494.50±113.45 | 410.55±109.67 | 3.872 | < 0.01 |
| CD4+/CD8+ | 0.81±0.37 | 2.07±0.56 | 13.611 | < 0.01 |
| NK | 321.89±236.16 | 366.24±134.63 | 1.192 | 0.238 |
| (CD16+CD56+) | ||||
| CD19+ | 140.74±89.71 | 218.91±87.47 | 4.542 | < 0.01 |
| 注 CD3:分化簇3(cluster of differentiation 3);NK:自然杀伤细胞(natural killer cell) | ||||
与Ⅰ~Ⅱ期比较,Ⅲ~Ⅳ期结肠癌患者的CD3+细胞数、CD4+细胞数、CD4+/CD8+比值、NK细胞数和CD19+细胞数降低,差异均具有统计学意义(P < 0.05);CD8+细胞数有升高的趋势,差异无统计学意义(P=0.911,表 3)。
| 检测指标 | Ⅰ~Ⅱ期 | Ⅲ~Ⅳ期 | t值 | p值 |
| CD3+ | 1 027.34±147.11 | 783.32±74.43 | 7.545 | 0.002 |
| CD4+ | 471.65±106.48 | 269.28±53.46 | 8.671 | 0.017 |
| CD8+ | 415.17±78.35 | 577.45±81.09 | 7.342 | 0.911 |
| CD4+/CD8+ | 1.17±0.34 | 0.48±0.11 | 10.080 | < 0.01 |
| NK(CD16+CD56+) | 497.36±216.93 | 142.37±54.44 | 8.092 | < 0.01 |
| CD19+ | 207.08±80.21 | 73.04±30.18 | 7.983 | 0.02 |
| 注 CD3:分化簇3(cluster of differentiation 3);NK:自然杀伤细胞(natural killer cell) | ||||
结肠癌组患者血浆中IL-6和TNF-α水平均高于对照组[(12.42±5.47)ng/L vs(4.33±1.34)ng/L,t=11.224,P < 0.01;(12.11±4.37)ng/L vs(6.52± 1.30)ng/L,t=9.560,P < 0.01]。
2.7 miR-21与IL-6和TNF-α相关性分析结肠癌患者血浆miR-21水平与IL-6水平呈正相关(r=0.48,P < 0.01),miR-21水平与TNF-α水平呈正相关(r=0.40,P < 0.01)。
2.8 淋巴细胞亚群细胞数与IL-6和TNF-α相关性分析结肠癌患者CD3+细胞数、CD4+细胞数、CD19+细胞数和CD4+/CD8+比值与IL-6水平呈负相关(r=-0.55,P < 0.01;r=-0.64,P < 0.01;r=-0.32,P=0.001;r=-0.58,P < 0.01),CD3+细胞数、CD4+细胞数、CD19+细胞数和CD4+/CD8+比值与TNF-α水平呈负相关(r=-0.46,P < 0.01;r=-0.54,P < 0.01;r=-0.34,P < 0.01;r=-0.50,P < 0.01),CD8+细胞数与TNF-α水平呈正相关(r=0.20,P=0.035)。
2.9 miR-21与淋巴细胞亚群细胞数相关性分析结直肠癌患者血浆miR-21水平与CD3+细胞数、CD4+细胞数、CD19+细胞数和CD4+/CD8+比值呈负相关(r=-0.57,P < 0.01;r=-0.59,P < 0.01;r=-0.43,P=0.020;r=-0.48,P < 0.01)。
3 讨论结肠癌是全球第三大恶性肿瘤,是导致癌症相关死亡的重要原因[12]。近年来我国结肠癌发病率和病死率逐年上升。结肠癌的发生、发展及侵袭转移是一个多因素和多步骤的复杂过程,多种蛋白、基因和细胞因子等参与其中,然而其确切机制目前尚不十分清楚。肿瘤患者普遍存在免疫功能低下,免疫细胞不能有效识别、排斥和杀灭肿瘤细胞是肿瘤发生和发展的关键原因。淋巴细胞亚群是反映机体免疫功能状态的关键指标,细胞之间的微平衡是维持机体免疫系统稳定的核心环节[13],一旦外周血中淋巴细胞亚群的数量和比例发生异常时,机体就会出现免疫功能紊乱并伴随一系列的病理性改变[14-15]。研究发现,T细胞亚群比例与乳腺癌、胃癌、肺癌、肝癌和鼻咽癌等的发生和发展有关[16-17],然而对于结肠癌的发生和发展与异常免疫指标之间的相关性研究报道仍较少。本研究探讨结肠癌患者淋巴细胞亚群和血浆miR-21水平与TNF-α和IL-6水平的关系以及miR-21水平与淋巴细胞亚群水平的关系。
外周血淋巴细胞计数能更准确反映机体免疫状态,对患者早期检测及术后预后的监测具有重要意义。本研究通过分析结肠癌者外周血淋巴细胞亚群细胞计数结果,并分析其与肿瘤分期的关系,探讨外周血淋巴细胞亚群细胞计数在结肠癌患者免疫状态评估中的临床价值。结果显示,在结肠癌患者淋巴细胞亚群中CD3+细胞数、CD4+细胞数、CD4+/CD8+比值以及CD19+细胞数均低于对照组,而CD8+细胞数则高于对照组。研究发现,早期恶性肿瘤的免疫应答以局部应答为主,全身免疫功能的变化较小,随着肿瘤的发生和发展全身免疫功能的抑制逐渐增强[18]。本研究发现,随着结肠癌患者病期的不断进展,从Ⅰ~Ⅱ期至Ⅲ~Ⅳ期结肠癌患者CD3+细胞数、CD4+细胞数、CD4+/CD8+比值、NK细胞数和CD19+细胞数逐渐降低,结果提示,随着结肠癌分期增加,细胞免疫功能下降,肿瘤的TNM分期与细胞免疫功能状态有关。随着患者病期的进展,结肠癌肿瘤不断生长,在此过程中机体对肿瘤细胞逐渐产生免疫耐受,由于机体不能产生有效的免疫应答来应对肿瘤抗原,且肿瘤生长过程中本身会产生一些免疫抑制因子和炎性细胞因子来抑制T细胞、B细胞及NK细胞的功能,从而导致机体免疫功能下降。TNF-α和IL-6可调节细胞免疫、诱导T细胞增殖分化、调节机体免疫应答和调节肿瘤生长,是调节炎性反应与肿瘤血管生成的重要炎性细胞因子,在多种肿瘤中高表达[19-20]。本研究显示,结肠癌患者血浆中炎性细胞因子IL-6和TNF-α水平升高,表明IL-6和TNF-α参与肿瘤发生和发展过程。通过对淋巴细胞亚群与炎性细胞因子IL-6和TNF-α水平的相关性进行分析发现,CD3+细胞数、CD4+细胞数、CD19+细胞数、CD4+/CD8+比值与炎性细胞因子IL-6和TNF-α水平均呈负相关;结肠癌患者TNM分期与免疫状态呈负相关。因此笔者推测,肿瘤细胞增殖越快,患者分期越晚,炎性反应信号通路激活异常,炎性因子上调更明显,免疫状态越差,预后越差,患者的免疫状态可间接揭示患者预后,且CD3+细胞数、CD4+细胞数、CD4+/CD8+比值、CD19+细胞数和NK细胞数在评估患者预后方面意义重大。
miRNA作为一种转录后调控基因表达的重要机制,在自身免疫性疾病、免疫细胞分化发育、感染、炎性反应和恶性肿瘤等的发生和发展过程中发挥重要的调控作用,可以通过影响下游基因的翻译和转录引起相关蛋白含量的改变,进而导致细胞内信号通路的激活,促进疾病的发生。miR-21是较早被发现在实体瘤中高表达的一种miRNA[6-7]。笔者在结肠癌患者组织中发现miR-21表达上调。本研究发现,结肠癌组患者血浆中miR-21水平高于对照组。进一步分析发现,组织分化程度高、有淋巴结转移和临床分期高的结肠癌患者血浆miR-21水平较高。同时ROC曲线分析血浆miR-21的临床诊断价值显示,血浆miR-21诊断结肠癌的ROC曲线下面积为0.895,95%CI为0.84~0.95,提示miR-21有较准确的诊断效能,miR-21可能在结肠癌早期诊断及预后评价中具有重要指导意义。本研究前期通过对淋巴细胞亚群的数据分析发现,CD3+、CD4+和CD8+等淋巴细胞亚群平衡被打破,导致T淋巴细胞免疫的紊乱,进而加剧结肠癌患者病情的进展。本研究进一步分析发现,结肠癌患者miR-21水平与CD3+细胞数、CD4+细胞数、CD19+细胞数和CD4+/CD8+比值均呈负相关。miR-21是具有调节免疫系统分化和免疫应答(包括天然免疫和适应性免疫)作用的miRNA之一[21]。miR-21可促进Th1和Th17极化细胞因子,进而促进炎性反应T细胞亚群的分化。转染miR-21的T细胞亚群可导致炎性反应因子TNF-α等表达上调[22]。本研究也发现,结肠癌患者miR-21水平与TNF-α和IL-6水平均呈正相关,提示miR-21的表达可能通过影响下游细胞炎性反应因子的表达或者T淋巴细胞亚群的改变,进而参与结肠癌发病过程。
综上所述,miR-21在结肠癌患者血浆中异常高表达,可以促进病情的进展,其机制可能与影响血浆中炎性细胞因子TNF-α和IL-6水平或淋巴细胞亚群等有关,因此外周血中淋巴细胞亚群细胞数目的变化及miR-21的表达对早期发现和早期诊断结肠癌具有一定的临床价值。通过检测不同淋巴细胞亚群的细胞数目及miR-21表达的变化,可以及时了解结肠癌患者的免疫状态,有助于指导临床治疗及预后评价。
| [1] |
Correia de Sousa M, Gjorgjieva M, Dolicka D, et al. Deciphering miRNAs' action through miRNA editing[J]. Int J Mol Sci, 2019, 20(24): 6249. DOI:10.3390/ijms20246249 |
| [2] |
Tiwari A, Mukherjee B, Dixit M, et al. MicroRNA key to angiogenesis regulation: miRNA biology and therapy[J]. Curr Cancer Drug Targets, 2018, 18(3): 266-277. DOI:10.2174/1568009617666170630142725 |
| [3] |
Dong J, Tai JW, Lu LF, et al. miRNA-microbiota interaction in gut homeostasis and colorectal cancer[J]. Trends Cancer, 2019, 5(11): 666-669. DOI:10.1016/j.trecan.2019.08.003 |
| [4] |
Goh SY, Chao YX, Dheen ST. Role of microRNAs in Parkinson's disease[J]. Int J Mol Sci, 2019, 20(22): 5649. DOI:10.3390/ijms20225649 |
| [5] |
李济馨, 谭文华. miRNA27a对子宫颈癌细胞迁移和侵袭的影响[J]. 实用肿瘤杂志, 2020, 35(3): 223-227. |
| [6] |
Saheb Sharif-Askari N, Saheb Sharif-Askari F, Guraya SY, et al. Integrative systematic review meta-analysis and bioinformatics identifies MicroRNA-21 and its target genes as biomarkers for colorectal adenocarcinoma[J]. Int J Surg, 2020, 73: 113-122. DOI:10.1016/j.ijsu.2019.11.017 |
| [7] |
Bai J, Xu J, Zhao J, et al. LncRNA NBR2 suppresses migration and invasion of colorectal cancer cells by downregulating miRNA-21[J]. Hum Cell, 2020, 33(1): 98-103. DOI:10.1007/s13577-019-00265-1 |
| [8] |
Flippe L, Bézie S, Anegon I, et al. Future prospects for CD8+ regulatory T cells in immune tolerance[J]. Immunol Rev, 2019, 292(1): 209-224. DOI:10.1111/imr.12812 |
| [9] |
Di Gennaro P, Gerlini G, Caporale R, et al. T regulatory cells mediate immunosuppresion by adenosine in peripheral blood, sentinel lymph node and TILs from melanoma patient[J]. Cancer letters, 2018, 417: 124-130. DOI:10.1016/j.canlet.2017.12.032 |
| [10] |
刘艳, 朱美琪. 可溶性IL-2R、IL-6及T细胞亚群测定在卵巢良恶性肿瘤诊断中的作用[J]. 实用肿瘤杂志, 2001, 16(1): 42-44. DOI:10.3969/j.issn.1001-1692.2001.01.017 |
| [11] |
Zhang H, Wu J, Shen FF, et al. Activated Schwann cells and increased inflammatory cytokines IL-1β, IL-6, and TNF-α in patients' sural nerve are lack of tight relationship with specific sensory disturbances in Parkinson's disease[J]. CNS Neurosci Ther, 2020, 26(5): 518-526. DOI:10.1111/cns.13282 |
| [12] |
程怡, 谭伊诺, 翁姗姗, 等. HER2变异结直肠癌临床研究进展[J]. 实用肿瘤杂志, 2020, 35(3): 193-201. |
| [13] |
罗俐梅, 罗娅, 蔡宜含, 等. 外周血淋巴细胞绝对计数在结直肠癌和食管癌肿瘤进展与治疗前后免疫状态评估的临床应用研究[J]. 中华临床实验室管理电子杂志, 2019, 7(3): 137-144. |
| [14] |
Yamashita H, Nakayama K, Ishikawa M, et al. Relationship between microsatellite instability, immune cells infiltration, and expression of immune checkpoint molecules in ovarian carcinoma: immunotherapeutic strategies for the future[J]. Int J Mol Sci, 2019, 20(20): 5129. DOI:10.3390/ijms20205129 |
| [15] |
Tokunaga A, Sugiyama D, Maeda Y, et al. Selective inhibition of low-affinity memory CD8+ T cells by corticosteroids[J]. J Exp Med, 2019, 216(12): 2701-2713. DOI:10.1084/jem.20190738 |
| [16] |
范引梅, 刘群群, 苗艳芳, 等. 结核病患者外周血单核细胞检测的临床意义[J]. 结核病与肺部健康杂志, 2017, 6(3): 246-249. DOI:10.3969/j.issn.2095-3755.2017.03.012 |
| [17] |
赵美淇, 梁新强, 刘海洲, 等. 肿瘤患者外周血T淋巴细胞亚群及NK细胞比例检测的临床意义[J]. 中国实验诊断学, 2019, 23(3): 381-385. DOI:10.3969/j.issn.1007-4287.2019.03.001 |
| [18] |
Whalen GF, Sharif SF. Locally increased metastatic efficiency as a reason for preferential metastasos of solid tumor stolymphnodes[J]. Ann Surg, 1992, 215(2): 166-171. DOI:10.1097/00000658-199202000-00012 |
| [19] |
Zhang C, Ma K, Li WY. IL-6 Promotes cancer stemness and oncogenicity in U2OS and MG-63 osteosarcoma cells by upregulating the OPN-STAT3 pathway[J]. J Cancer, 2019, 10(26): 6511-6525. DOI:10.7150/jca.29931 |
| [20] |
Zhao X, Jiang Y, Ping Y, et al. Associations between tumor necrosis factor-α and interleukin-6 polymorphisms and unexplained recurrent spontaneous abortion risk: A meta-analysis[J]. Medicine (Baltimore), 2019, 98(46): e17919. |
| [21] |
谢丽华, 杨芳英, 孙圣华. MiR-21在慢性阻塞性肺疾病患者外周血清和单个核细胞中的表达及临床意义[J]. 中南大学学报, 2016, 41(3): 238-243. |
| [22] |
Ando Y, Yang GX, Kenny T, et al. Overexpression of microRNA-21 is associated with elevated pro-inflammatory cytokines in dominant-negative TGF-receptor type Ⅱ mouset[J]. J Autoimmun, 2013, 41: 111-119. |
 2021, Vol. 36
2021, Vol. 36


