文章信息
- 徐明月, 陈媛媛, 赵丽, 王有龙, 林惠, 刘庆, 闻巍
- Xu Mingyue, Chen Yuanyuan, Zhao Li, Wang Youlong, Lin Hui, Liu Qing, Wen Wei
- 吲哚菁绿荧光成像在腹腔镜右半结肠癌术中淋巴结清扫中的应用
- Application of indocyanine green fluorescence imaging in lymphadenectomy for total laparoscopic right colon cancer surgery
- 实用肿瘤杂志, 2023, 38(6): 577-582
- Journal of Practical Oncology, 2023, 38(6): 577-582
基金项目
- 海南省自然科学基金面上项目(820MS125);中国人民解放军总医院科技创新苗圃基金项目(18KMM42)
-
通信作者
- 闻巍, E-mail: wenweiny@126.com
-
文章历史
- 收稿日期:2022-06-09
2. 解放军总医院海南医院全科医学科, 海南 三亚 570013;
3. 解放军总医院海南医院消化内科, 海南 三亚 570013
2. Department of General Medicine, Hainan Hospital of Chinese PLA General Hospital, Sanya 570013, China;
3. Department of Gastroenterology, Hainan Hospital of Chinese PLA General Hospital, Sanya 570013, China
吲哚菁绿(indocyanine green,ICG)荧光成像技术(ICG fluorescence imaging,ICG-FI)与腹腔镜的结合,在提高腹腔镜分辨率的同时,也使其具备术中实时评估吻合口血运和明确淋巴结清扫范围等功能。近年来,ICG-FI技术在眼科、肝胆外科和泌尿外科等专业得到广泛应用,在血管造影、肿瘤定位、胆管及泌尿系管道的示踪方面取得较好应用效果[1-2]。目前,ICG-FI在结直肠外科中的应用多集中于对吻合口血流的评估,实时和可视的吻合口荧光血流显像对于降低吻合口瘘的发生具有重要的作用[3],但对于肿瘤周边淋巴引流范围示踪特别是淋巴结的示踪方面研究较少。本文探讨ICG-FI在腹腔镜右半结肠癌术中淋巴引流范围示踪及淋巴结清扫中的作用,旨在进一步加深该技术在微创胃肠外科中的应用研究。
1 资料与方法 1.1 临床资料回顾性分析2018年1月至2021年6月本院普通外科同一手术组经结直肠外科医师行腹腔镜手术并经病理确诊的右半结肠癌患者的临床资料。纳入标准:(1)术前肠镜及影像学临床分期为cT1~T3无远处转移的患者;(2)术前无放射性治疗、化疗或其他免疫治疗者;(3)无其他影响凝血的疾病;(4)获得R0切除;(5)行全腹腔镜下右半结肠癌根治术,不包括扩大的右半结肠癌根治术。排除标准:(1)复发性肿瘤;(2)既往腹部手术史;(3)对碘剂或ICG过敏。根据应用荧光腹腔镜的情况进行分组,术中应用荧光腹腔镜的患者为荧光腹腔镜组,应用2D腹腔镜或3D腹腔镜的患者为对照组(传统腹腔镜组)。本研究已获本院伦理委员会批准,患者家属均签署知情同意书。
1.2 ICG标记方法注 射用ICG为沈阳丹东医创药业有限公司产品(25 mg)。ICG注射前完成肠道准备。术前注药方法:由消化内科医师在肠镜下分别于口侧和肛侧在瘤周上、下、左和右4个象限取2~4点采取黏膜下“三明治”法分别注射0.1 mL ICG溶液(1.25 mg/mL,图 1)。
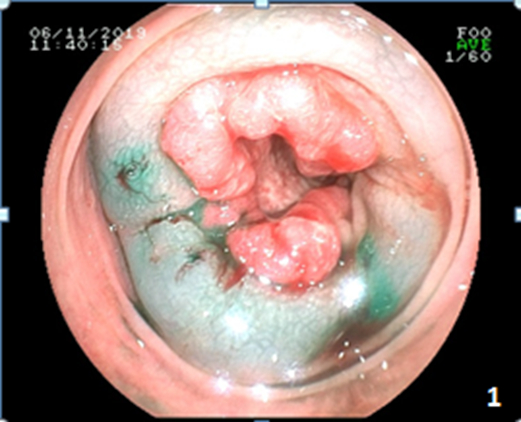
|
| 图 1 升结肠肿瘤患者肠镜下瘤周“三明治”法注射吲哚菁绿可见瘤周黏膜隆起 Fig.1 Endoscopic injection of indocyanine green using the "sandwich" method in ascending colon tumor causing mucosal protrusions around the tumor |
术中荧光腹腔镜系统采用欧谱曼迪高清荧光腹腔镜系统(佛山市广东欧谱曼迪科技有限公司)。所有患者均采用5孔法放置戳卡,行完整结肠系膜切除(complete mesocolic excision,CME)淋巴结清扫。参照《腹腔镜结直肠癌根治术操作指南(2018版)》,结肠癌切缘距离肿瘤≥10 cm[4]。消化道重建采用腹腔镜下回肠-结肠侧侧吻合,共同开口的关闭采用直线切割闭合器关闭的三角吻合或倒刺线手工缝合。术中根据荧光成像结果,标记引流区域所有荧光显像淋巴结,完成淋巴结清扫后,再次运用荧光腹腔镜观察清扫区域。如仍有荧光染色,淋巴结给予清除,直至清扫区域无荧光显示。如有超出指南规定清扫区域的淋巴结,则给予一并清除。消化道重建后,静脉推注3~5 mL ICG溶液(2.5 mg/mL),在标准荧光模式下约60 s~2 min内可见吻合口处肠管荧光显像,根据吻合口肠管荧光显色强度,采用Sherwinter评分系统[4]行吻合口处血供评估:1分,无荧光;2分,有斑片状无荧光部分;3分,荧光均匀;4分,荧光完全,且局部呈高荧光状态;5分,高荧光状态。吻合口处评分≥3分(荧光均匀或局部呈现高荧光状态)认为吻合口血运较好。
淋巴结分组方法参照第9版《日本大肠癌临床病理处理规范》[5]。肠旁淋巴结包括201、211和221组淋巴结,中间淋巴结包括202、212和222-rt组淋巴结,主淋巴结包括203、213和223组淋巴结。术后由手术医师和病理科医师一同对新鲜标本行挤压触诊法分离出各组淋巴结后进行送检,固定标本后病理科医师再次对剩余淋巴结进行筛检,对筛检出的淋巴结再次与手术医师确定对应组别。
1.4 统计学分析采用SPSS 20.0统计学软件进行数据分析。正态分布计量资料以均数±标准差(x±s)表示,组间比较采用t检验。计数资料以频数(百分比)表示,组间比较采用χ2检验或Fisher确切检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料共纳入103例患者,其中荧光腹腔镜组57例,传统腹腔镜组46例。荧光腹腔镜组所有患者术中及术后均未出现ICG过敏反应。研究初期采用荧光腹腔镜的患者共入组63例,其中4例因肿瘤致肠腔狭窄无法通过,仅于肛侧缘注射;2例术中荧光显像示腹腔弥漫性荧光现象,无法观察淋巴结情况,考虑ICG注射过量或外溢;遂将上述6例剔除,最终纳入57例患者。
57例荧光腹腔镜组患者术前ICG注药时间为术前16~24 h,(21.2±3.1)h。荧光腹腔镜组中,男性37例,女性20例;年龄34~86岁,(61.4±11.7)岁。传统腹腔镜组中,男性30例,女性16例;年龄34~84岁,(62.5±13.8)岁。两组患者在年龄、性别、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级和肿瘤直径等方面比较,差异均无统计学意义(均P > 0.05,表 1)。
| 临床特征 | 荧光腹腔镜组 (n=57) |
传统腹腔镜组 (n=46) |
t/χ2值 | P值 |
| 年龄(岁,x±s) | 61.4±11.7 | 62.5±13.8 | 0.465 | 0.643 |
| 性别 | 0.001 | 0.974 | ||
| 男性 | 37(64.9) | 30(65.2) | ||
| 女性 | 20(35.1) | 16(34.8) | ||
| BMI(kg/m2,x±s) | 23.0±3.8 | 23.0±3.0 | 0.006 | 0.995 |
| ASA分级 | 2.439 | 0.118 | ||
| < 3 | 51(89.5) | 36(78.3) | ||
| ≥3 | 6(10.5) | 10(21.7) | ||
| 合并症 | ||||
| 糖尿病 | 7(12.3) | 7(15.2) | 0.187 | 0.665 |
| 高血压 | 7(12.3) | 6(13.0) | 0.508 | 0.476 |
| 手术时间 (min,x±s) |
185.4±24.9 | 203.7±53.9 | 2.280 | 0.025 |
| 术中出血量 (mL,x±s) |
141.7±86.7 | 117.4±74.7 | 1.479 | 0.142 |
| 肿瘤直径 (cm,x±s) |
3.8±1.1 | 3.8±1.3 | 0.199 | 0.843 |
| 术后pTNM分期 | 3.745 | 0.154 | ||
| Ⅰ期 | 7(12.3) | 5(10.9) | ||
| Ⅱ期 | 19(33.3) | 8(17.4) | ||
| Ⅲ期 | 31(54.4) | 33(71.7) | ||
| 术后住院时间 (d,x±s) |
8.4±1.9 | 7.7±2.2 | 1.651 | 0.102 |
| 术后并发症 | 0.720 | 0.396 | ||
| 有 | 12(21.1) | 13(28.3) | ||
| 无 | 45(78.9) | 33(71.7) | ||
| 术后C反应蛋白 (mg/dL,x±s) |
7.8±5.7 | 9.7±7.4 | 1.460 | 0.147 |
| 注 BMI:体质量指数(body mass index);ASA:美国麻醉医师协会(American Society of Anesthesiologists) | ||||
荧光腹腔镜组和传统腹腔镜组手术时间分别为(185.4±24.9)min和(203.7±53.9)min,差异具有统计学意义(P=0.025,表 1)。两组术中出血量比较,差异无统计学意义(P=0.142)。荧光腹腔镜组均可见明显荧光染色淋巴结(图 2A~2B)。其中,8例(14.0%)清扫结束后术中荧光仍可见显像淋巴结,遂调整淋巴结清扫范围,直至无淋巴结荧光显像(图 3)。在淋巴结清扫方面,所有患者的平均淋巴结清扫个数为(28.4±4.0)个,达到《腹腔镜结直肠癌根治术操作指南(2018版)》要求的 > 12个的标准[4],其中荧光腹腔镜组总淋巴结清扫个数高于传统腹腔镜组[(29.2±3.9)个 vs(27.4±4.0)个,P=0.020;表 2]。
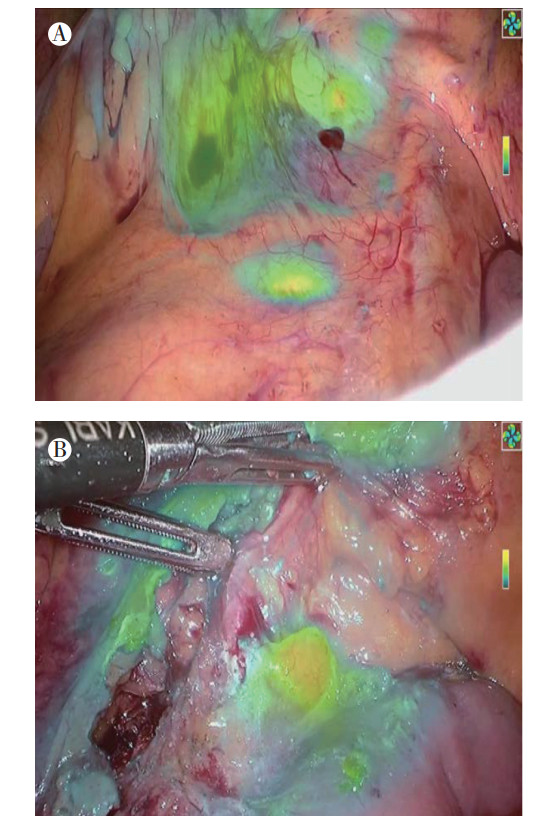
|
| 注 A:腹腔镜右半结肠癌根治术中,可见肠系膜静脉右侧淋巴结荧光现象,其中203组淋巴结显像清楚;B:腹腔镜右半结肠癌清扫术中,可见明显荧光染色的223组淋巴结 图 2 腹腔镜右半结肠癌根治术中肠系膜根部淋巴结荧光显像情况 Fig.2 Fluorescence of mesenteric root lymph nodes during laparoscopic radical resection of right colon cancer |
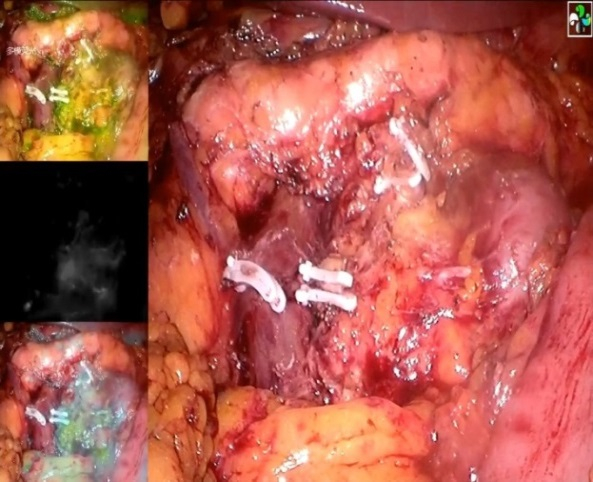
|
| 图 3 腹腔镜右半结肠癌清扫术后荧光显像可见肠系膜上动静脉间荧光染色淋巴结 Fig.3 Fluorescence of lymph nodes between superior mesenteric artery and vein during laparoscopic surgery of right colon cancer |
| 淋巴结清扫情况 | 荧光腹腔镜组 (n=57) |
传统腹腔镜组 (n=46) |
t值 | P值 |
| 淋巴结显像成功(例) | 57 | - | - | - |
| 总淋巴结清扫个数 | 29.2±3.9 | 27.4±4.0 | 2.323 | 0.020 |
| 肠周淋巴结清扫个数 | 16.1±2.1 | 15.6±2.0 | 1.323 | 0.189 |
| 中间淋巴结清扫个数 | 5.3±0.8 | 5.4±1.0 | 0.545 | 0.587 |
| 主淋巴结清扫个数 | 7.9±1.1 | 6.4±1.2 | 6.007 | < 0.01 |
| 转移淋巴结个数 | 2.6±3.5 | 3.0±3.1 | 0.447 | 0.656 |
荧光腹腔镜组所有患者术中吻合口荧光评分均为4~5分,围手术期无患者死亡。传统腹腔镜组1例术后出现吻合口瘘,经持续冲洗后治愈;术后吻合口出血4例,除1例行内镜下钳夹止血外,其余患者均经止血药物及输血等治疗后治愈。两组患者在术后并发症及住院时间方面比较,差异均无统计学意义(均P > 0.05,表 1)。
2.3 淋巴结清扫分析荧光腹腔镜组术中均可见荧光淋巴结示踪。荧光腹腔镜组总淋巴结清扫个数和主淋巴结清扫个数均多于传统腹腔镜组(均P < 0.05,表 2)。两组肠周淋巴结和中间淋巴结清扫个数以及转移淋巴结个数比较,差异均无统计学意义(均P > 0.05)。
3 结论ICG-FI在胃肠外科中广泛应用于肿瘤的定位及术中吻合口血流的判断,对减少术后吻合口瘘的发生具有重要意义。2018年一项包括5个非随机对照研究共1 302例结肠癌手术患者的荟萃研究发现,ICG-FI降低结直肠癌术后吻合口瘘的发生,特别是在结肠癌手术中[6]。直肠癌相关研究中也得出同样的结论[7]。本研究中,两组患者在术后吻合口瘘发生率方面比较,差异无统计学意义(P > 0.05),可能与入组患者样本量较小有关。
目前对于ICG-FI在淋巴结示踪方面的研究相对较少,但彻底规范的淋巴结清扫,对于明确术后淋巴结转移和肿瘤分期以及提高患者预后和降低术后复发率有着重要意义。国际抗癌联盟(Union for International Cancer Control,UICC)和美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)结直肠癌治疗指南均明确指出,结肠癌手术应清扫 > 12个淋巴结才能进行准确的肿瘤术后分期评估[8],如淋巴结未达到上述数目,则可能致肿瘤分期前移,导致部分患者治疗不充分或过度[9]。《中国结直肠癌诊疗规范(2017年版)》中也明确强调,如Ⅱ期结肠癌术后淋巴结清扫个数 < 12个,需追加术后化疗[10]。虽然指南推荐结直肠癌根治术中淋巴结清扫的范围遵循CME或D2/3原则[9-10],但在具体清扫过程中,因淋巴结多与周围血管关系密切,术中清扫范围带有一定主观性,易造成淋巴结清扫范围过大或过小,致使淋巴结清扫不彻底。另外,对于不同部位的淋巴引流途径,既往研究均认为,淋巴引流循邻近动脉走行,但对于其具体引流途径缺乏进一步研究[11]。一项应用ICG对31例脾区结肠癌淋巴回流的研究显示,结肠癌脾区的淋巴回流均不通过左结肠动脉或中结肠动脉左支,其中19例直接回流至肠系膜下动脉周围,这对传统的淋巴回流认识及清扫范围提出新的挑战,同时也提示通过荧光等新技术重新认识结肠癌的淋巴引流途径的重要性[12]。研究发现,ICG-FI可提高结直肠癌中253组淋巴结的清扫个数[13]。本研究中,临床分期Ⅰ~Ⅲ期的右半结肠癌手术中, ICG-FI可提高淋巴结的清扫数目,特别是对于第3站淋巴结的获取,研究结果与Park等[14]相似。
结直肠癌前哨淋巴检测价值仍处于探索中,指南及共识中尚不推荐其作为手术方式及淋巴结清扫范围的决策依据[15-16]。对荧光成像技术在结直肠癌前哨淋巴结获取中的研究发现,无论是体内还是体外应用荧光成像技术并未优于传统染料法,其前哨淋巴结获取的敏感度仍较低[17]。但也有研究发现,ICG-FI与传统染色在转移性淋巴结获取中有相同的检出率(95%),但ICG-FI具有更高的敏感度(57% vs 43%),尤其是在BMI > 25 kg/m2的患者中[18]。
本研究结果显示,荧光腹腔镜组平均手术时间小于传统腹腔镜组。可能原因为:(1)传统腹腔镜组7例术中行肠镜定位,术中肠镜定位大大增加手术时间;(2)因设备原因,荧光腹腔镜组患者入组时间略晚于传统腹腔镜组,而传统腹腔镜组中1/3的手术为团队早期手术,仍处于学习曲线中。对于部分体积较小的肿瘤行ICG瘤周注射,在精准定位的同时,也对瘤周淋巴结有较好的示踪效果。本研究结果显示,荧光腹腔镜组淋巴结清扫个数高于传统腹腔镜组,特别是在第3站淋巴结的清扫方面。ICG因其显影的恒定性,在手术清扫过程中可实时进行淋巴结的显影示踪,也可在淋巴结清扫完成后再次进行术区荧光显像,以观察有无残存淋巴结,便于淋巴结清扫范围的修正, 这可能是荧光腹腔镜组第3站淋巴结个数高于传统腹腔镜组的原因。在实际应用过程中应注意:(1)ICG对注射要求极高,少量ICG外溢即可造成腹腔弥漫性荧光现象,应严格采用“三明治”法;(2)对于部分病理明确的T2~T3肿瘤,为获取淋巴引流示踪而术前再次行肠镜下瘤周黏膜注射ICG,会增加患者不适感及加重经济负担。
ICG作为一种高效和便捷的淋巴结示踪技术,可较好帮助术者确定病灶周围淋巴组织的空间位置,有助于实时修正淋巴结清扫范围,是对CME的良好补充。ICG的推广应用有助于术者对结直肠肿瘤诊断及治疗的把握,可有效协助肿瘤定位、对系膜内淋巴结精准示踪并实时评估吻合口血运,从而改善患者预后,但对于部分T2~T3肿瘤,患者再次行肠镜检查,可能会增加其不适感及经济负担。虽然目前ICG-FI在结直肠癌术中淋巴示踪中应用的安全性及可靠性已得到初步证实,但其评判标准、具体注射流程和注射剂量等仍有待进一步研究,还需更多的前瞻性研究来提供高级别循证医学证据支持。
| [1] |
杨雯雯, 田宏伟, 雷彩宁, 等. 吲哚菁绿荧光导航技术在腹腔镜肝胆胰外科手术中的研究进展[J]. 中国普通外科杂志, 2021, 30(8): 979-986. |
| [2] |
周巧雨, 许佳佳, 刘敏, 等. 吲哚菁绿在生物成像与医学工程中的应用进展[J]. 影像科学与光化学, 2021, 39(4): 487-491. |
| [3] |
Foo CC, Ng KK, Tsang J, et al. Colonic perfusion assessment with indocyanine-green fluorescence imaging in anterior resections: a propensity score-matched analysis[J]. Tech Coloproctol, 2020, 24(9): 935-942. DOI:10.1007/s10151-020-02232-7 |
| [4] |
中华医学会外科学分会腹腔镜与内镜外科学组. 腹腔镜结直肠癌根治术操作指南(2018版)[J]. 中华消化外科杂志, 2018, 9(17): 877-885. |
| [5] |
日本大腸癌研究会. 大腸癌取扱い規約[M]. 9版. 東京: 金原出版株式会社, 2018: 44-46.
|
| [6] |
Blanco-Colino R, Espin-Basany E. Intraoperative use of ICG fluorescence imaging to reduce the risk of anastomotic leakage in colorectal surgery: a systematic review and meta-analysis[J]. Tech Coloproctol, 2018, 22(1): 15-23. DOI:10.1007/s10151-017-1731-8 |
| [7] |
Watanabe J, Ishibe A, Suwa Y, et al. Indocyanine green fluorescence imaging to reduce the risk of anastomotic leakage in laparoscopic low anterior resection for rectal cancer: a propensity score-matched cohort study[J]. Surg Endosc, 2020, 34(1): 202-208. DOI:10.1007/s00464-019-06751-9 |
| [8] |
NCCN. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Colon cancer. Version 1.2022[EB/OL]. (2022-02-25)[2022-05-19]. https://www.nccn.org/
|
| [9] |
王保信, 刘军, 唐雪飞, 等. 手辅助腹腔镜技术与开腹手术治疗直肠癌的疗效对比研究[J]. 实用肿瘤杂志, 2021, 36(2): 114-117. |
| [10] |
国家卫生和计划生育委员会《中国结直肠癌诊疗规范(年版)》专家组. 中国结直肠癌诊疗规范(2017年版)[J]. 中华临床医师杂志: 电子版, 2018, 12(1): 3-23. |
| [11] |
徐楷文, 王培培, 吴斌. 人工智能在结直肠癌诊治中的应用[J]. 实用肿瘤杂志, 2022, 37(1): 29-32. |
| [12] |
Watanabe J, Ota M, Suwa Y, et al. Evaluation of lymph flow patterns in splenic flexural colon cancers using laparoscopic real-time indocyanine green fluorescence imaging[J]. Int J Colorectal Dis, 2017, 32(2): 201-207. |
| [13] |
张建锋, 高相鑫, 武雪亮, 等. 吲哚菁绿荧光导航结直肠癌253组淋巴结清扫的安全性、可行性及临床价值[J]. 实用医学杂志, 2021, 37(12): 1598-1602. |
| [14] |
Park SY, Park JS, Kim HJ, et al. Indocyanine green fluorescence imaging-guided laparoscopic surgery could achieve radical D3 dissection in patients with advanced right-sided colon cancer[J]. Dis Colon Rectum, 2020, 63(4): 441-449. |
| [15] |
中华医学会外科学分会胃肠外科学组. 吲哚菁绿近红外光成像在腹腔镜胃癌根治术中应用中国专家共识(2019版)[J]. 中国实用外科杂志, 2020, 40(2): 139-144. |
| [16] |
中华医学会外科学分会结直肠外科学组. 吲哚菁绿近红外光成像在腹腔镜结直肠癌手术中应用中国专家共识(2021版)[J]. 中国实用外科杂志, 2021, 41(10): 1098-1103, 1110. |
| [17] |
Liberale G, Bohlok A, Bormans A, et al. Indocyanine green fluorescence imaging for sentinel lymph node detection in colorectal cancer: a systematic review[J]. Eur J Surg Oncol, 2018, 44(9): 1301-1306. |
| [18] |
Emile SH, Elfeki H, Shalaby M, et al. Sensitivity and specificity of indocyanine green near-infrared fluorescence imaging in detection of metastatic lymph nodes in colorectal cancer: systematic review and meta-analysis[J]. J Surg Oncol, 2017, 116(6): 730-740. |
 2023, Vol. 38
2023, Vol. 38


