文章信息
- 杨宗明, 朱章航, 徐李莎, 王建炳, 胡烨婷, 陈坤
- Yang Zongming, Zhu Zhanghang, Xu Lisha, Wang Jianbing, Hu Yeting, Chen Kun
- 全球结直肠癌疾病负担与筛查比较
- Comparison of global burden and screening of colorectal cancer
- 实用肿瘤杂志, 2023, 38(3): 211-217
- Journal of Practical Oncology, 2023, 38(3): 211-217
-
通信作者
- 陈坤,E-mail:ck@zju.edu.cn
-
文章历史
- 收稿日期:2023-04-14
2. 浙江大学医学院附属第二医院大肠外科,浙江 杭州 310000;
3. 浙江大学医学院附属儿童医院国家儿童健康与疾病临床医学研究中心,浙江 杭州 310052
2. Department of Colorectal Surgery, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310000, China;
3. National Clinical Research Center for Child Health, Children's Hospital, Zhejiang University School of Medicine, Hangzhou 310052, China
根据国际癌症研究中心(International Agency for Research on Cancer,IARC)GLOBOCAN项目的统计数据,2020年,结直肠癌是全球第三大常见的恶性肿瘤,也是恶性肿瘤相关死亡的第二大原因[1]。结直肠癌的疾病负担存在着显著的地区差异,通常在人类发展指数(Human Development Index,HDI)较高的国家,如欧洲、大洋洲和北美地区,结直肠癌发病率和死亡率最高[2]。近年来,随着社会经济的发展、生活方式和饮食习惯的“西方化”转变,我国的结直肠癌发病率和死亡率显著增加[1, 3]。2020年,我国新发结直肠癌病例约为55万例,死亡病例约为29万例,分别位居我国恶性肿瘤发病和死亡的第2位和第5位[1, 4]。根据全球疾病负担研究(the Global Burden of Disease Study,GBD)2019年的报告,全球一半以上的结直肠癌发病和死亡归因于可改变的危险因素,例如低牛奶饮食(15.6%)、吸烟(13.3%)、低钙饮食(12.9%)和饮酒(9.9%)[5]。此外,定期接受筛查、监测和高质量治疗可以预防绝大部分结直肠癌的发病和死亡[6]。
全面总结、梳理和比较中国与全球其他地区结直肠癌负担分布情况及其变化趋势,对于我国制定短期和长期结直肠癌防控策略具有重要的指导意义。本文系统整理和分析了最新的结直肠癌相关统计数据,对结直肠癌发病、死亡、预后和筛查情况进行解读。通过比较中国与全球的异同,分析中国未来所面临的结直肠癌疾病负担及防治前景。
1 发病2020年全球约有190万结直肠癌新发病例,占所有新发癌症病例的10.7%[7]。结直肠癌的发病率在不同社会经济发展水平的国家之间存在着巨大差异,高HDI的国家/地区(29.4/10万)约是低HDI的国家/地区(7.4/10万)的4倍,高HDI国家和地区的新发病例占全球的90%以上。这种差异可能是由于结直肠癌关键危险因素的流行和分布不同以及不同地区在早期检测和治疗实践中的不同所导致的。虽然中国2020年的结直肠癌年龄标化发病率(23.9/10万)低于同时期的欧洲(30.4/10万)和北美(26.2/10万)[8],但由于我国人口基数庞大,绝对的病例数仍然很多,占全球的四分之一以上。在过去20年,包括中国在内的全球多数国家的结直肠癌发病率呈现上升趋势[5, 9],但一些中欧国家(如奥地利、德国和捷克共和国等)、美国和加拿大等发病率呈现下降趋势(表 1)[10]。
| 国家 | 大洲 | 时期(年) | 发病率年均变化百分比(%,95% CI) | 死亡率年均变化百分比(%,95% CI) | |||
| 男性 | 女性 | 男性 | 女性 | ||||
| 中国 | 亚洲 | 1998~2007 | 1.6(1.3~1.9) | 0.0(-0.7~0.7) | 1.3(0.9~1.7) | 0.6(0.0~1.2) | |
| 奥地利 | 欧洲 | 2000~2016 | -2.5(-2.8~-2.2) | -2.4(-2.7~-2.1) | -3.2(-3.5~-2.9) | -3.5(-3.9~-3.1) | |
| 德国 | 欧洲 | 2000~2016 | -1.8(-2.3~-1.4) | -2.2(-2.6~-1.8) | -2.6(-2.7~-2.4) | -3.1(-3.2~-2.9) | |
| 捷克共和国 | 欧洲 | 2000~2017 | -1.6(-2.0~-1.2) | -1.3(-1.7~-0.9) | -3.8(-4.2~-3.4) | -3.9(-4.3~-3.5) | |
| 爱尔兰 | 欧洲 | 2000~2016 | -0.2(-0.5~0.2) | -0.3(-0.7~0.1) | -1.9(-2.4~-1.3) | -1.7(-2.3~-1.2) | |
| 斯洛文尼亚 | 欧洲 | 2000~2015 | -0.2(-1.4~1.0) | -0.5(-1.7~0.6) | -1.5(-2.2~-0.7) | -1.6(-2.3~-0.9) | |
| 英格兰* | 欧洲 | 2000~2017 | -0.0(-0.4~0.3) | 0.4(0.1~0.7) | -1.8(-2.0~-1.7) | -1.3(-1.5~-1.1) | |
| 比利时 | 欧洲 | 2004~2016 | 0.0(-0.8~0.9) | 0.1(-0.5~0.6) | -2.0(-2.3~-1.7) | -2.1(-2.4~-1.7) | |
| 瑞典 | 欧洲 | 2000~2016 | 0.1(-0.2~0.4) | 0.3(0.0~0.6) | -0.9(-1.2~-0.7) | -0.7(-1.0~-0.3) | |
| 挪威 | 欧洲 | 2000~2017 | 0.3(0.1~0.5) | 0.6(0.4~0.8) | -1.8(-2.1~-1.4) | -1.4(-1.8~-1.1) | |
| 丹麦 | 欧洲 | 2002~2018 | 0.6(-0.2~1.3) | 0.5(-0.3~1.2) | -2.3(-2.7~-1.9) | -2.5(-3.0~-2.0) | |
| 芬兰 | 欧洲 | 2000~2016 | 0.7(0.5~1.0) | 0.6(0.3~1.0) | -0.7(-1.0~-0.4) | -0.7(-1.3~-0.2) | |
| 爱沙尼亚 | 欧洲 | 2000~2016 | 1.1(0.7~1.6) | 1.0(0.5~1.6) | 0.2(-0.4~0.9) | -0.4(-1.2~0.5) | |
| 立陶宛 | 欧洲 | 2000~2012 | 1.2(0.6~1.7) | 0.9(0.2~1.7) | -0.3(-0.8~0.2) | -1.1(-1.6~-0.6) | |
| 乌克兰 | 欧洲 | 2000~2016 | 1.3(1.0~1.6) | 1.1(0.8~1.4) | 0.0(-0.2~0.3) | -0.3(-0.7~0.1) | |
| 荷兰 | 欧洲 | 2000~2016 | 1.5(1.1~1.8) | 1.2(0.8~1.5) | -1.1(-1.4~-0.8) | -1.1(-1.5~-0.7) | |
| 保加利亚 | 欧洲 | 2000~2013 | 1.9(1.2~2.6) | 1.0(0.3~1.7) | 0.0(-0.8~0.8) | -1.7(-2.7~-0.7) | |
| 美国 | 北美洲 | 2006~2015 | -2.5(-) | - | -2.4(-2.7~-2.2) | -2.5(-2.9~-2.0) | |
| 加拿大 | 北美洲 | 2004~2013 | 0.1(-0.9~1.0) | -0.1(-0.7~0.5) | -1.9(-2.3~-1.4) | -1.2(-1.8~-0.6) | |
| 注 年龄标化发病率和死亡率按Segi's世界标准人口结构进行计算;*死亡率分析包含威尔士;-:无数据 | |||||||
结直肠癌的发病率通常随着年龄增长而不断增加,然而绝对发病例数随着年龄增长呈现先上升后下降的趋势[11]。2020年,全球60.4%的新发病例的诊断年龄在50~74岁之间[5, 7]。值得注意的是,全球早发性结直肠癌(发病年龄 < 50岁)的发病率呈现上升趋势[11-13],这一现象在英国尤为显著[2003年至2012年的年均变化百分比(average annual percentage change,AAPC)为3.3%]。在一些 > 50岁人群发病率下降或保持稳定的国家(如美国和加拿大等)早发性结直肠癌的发病率也呈现上升的趋势(美国2007年至2016年AAPC为2.2%;加拿大2003年至2012年AAPC为2.8%)。这种趋势导致这些国家整体结直肠癌发病率下降速度放缓。例如,在美国,结直肠癌的发病率下降速度从21世纪前10年的年均下降3%~4%放缓至2011年至2019年的1%。在中国,早发性结直肠癌的发病率保持稳定,AAPC维持在0.4%左右[10]。
2 死亡2020年全球约有93万例结直肠癌患者死亡,其中约有一半发生在50~74岁的人群[7]。结直肠癌死亡率在不同地区间同样存在着显著差异,高HDI国家和地区的死亡率高于低HDI国家和地区,但死亡率与发病率之比却更低[10]。例如,北欧地区(高HDI)的年龄标化发病率为33.6/10万,年龄标化死亡率为11.4/10万,其死亡发病比为0.34,而西非地区(低HDI)的年龄标化发病率为6.7/10万,年龄标化死亡率为5.1/10万,其死亡发病比达0.76(表 2)[7]。中国的年龄标化发病率为23.9/10万,年龄标化死亡率为12.0/10万,死亡发病比为0.50。发达地区和不发达地区死亡率与发病率之比的差异可能与社会经济发展水平、医疗卫生水平以及卫生资源可及性(即是否提供相应的筛查、规范诊断治疗和生存照护)有关。与发病率比较,全球结直肠癌死亡率的变化趋势并不明显[2]。全球年龄标化死亡率从1990年的14.3(13.5~14.9)/10万下降至2019年的13.7(12.6~14.5)/10万。近几十年来,实施了长期筛查项目的国家,结直肠癌的死亡率不断下降。例如,2006年至2015年美国男性和女性的结直肠癌死亡率AAPC分别为-2.4%(95% CI:-2.7%~-2.2%)和-2.5%(95% CI:-2.9%~-2.0%;表 1)。
| 国家/地区 | 发病 | 死亡 | 死亡发病比 | |||
| 发病数(例) | 年龄标化发病率(/10万) | 死亡数(例) | 年龄标化死亡率(/10万) | |||
| 中国 | 555 477 | 23.9 | 286 162 | 12.0 | 0.50 | |
| 中南亚 | 102 987 | 5.5 | 59 206 | 3.2 | 0.58 | |
| 西亚 | 41 569 | 16.8 | 22 107 | 8.9 | 0.53 | |
| 东南亚 | 106 995 | 14.8 | 57 064 | 7.9 | 0.53 | |
| 东亚 | 757 849 | 25.9 | 368 072 | 11.8 | 0.46 | |
| 中东欧 | 172 950 | 29.3 | 93 384 | 14.5 | 0.49 | |
| 南欧 | 123 588 | 31.9 | 55 406 | 11.5 | 0.36 | |
| 西欧 | 141 644 | 28.7 | 62 266 | 10.2 | 0.36 | |
| 北欧 | 81 638 | 33.6 | 33 768 | 11.4 | 0.34 | |
| 西非 | 13 583 | 6.7 | 9 938 | 5.1 | 0.76 | |
| 中非 | 5 767 | 6.8 | 4 228 | 5.2 | 0.76 | |
| 东非 | 18 306 | 7.9 | 13 236 | 5.9 | 0.75 | |
| 北非 | 20 858 | 9.7 | 11 530 | 5.4 | 0.56 | |
| 南非 | 7 684 | 13.7 | 3 943 | 7.2 | 0.53 | |
| 加勒比海 | 11 454 | 18.1 | 6 983 | 10.4 | 0.57 | |
| 中美洲 | 19 535 | 10.4 | 10 439 | 5.5 | 0.53 | |
| 南美洲 | 103 954 | 18.5 | 52 013 | 8.9 | 0.48 | |
| 北美洲 | 180 575 | 26.2 | 63 987 | 8.2 | 0.31 | |
| 澳大利亚/ 新西兰 | 19 644 | 33.2 | 7 038 | 9.5 | 0.29 | |
| 美拉尼西亚 | 804 | 11.4 | 452 | 6.7 | 0.59 | |
| 密克罗尼西亚/玻利尼西亚 | 206 | 16.0 | 113 | 8.9 | 0.56 | |
| 注 年龄标化发病率和死亡率按Segi's世界标准人口结构进行计算 | ||||||
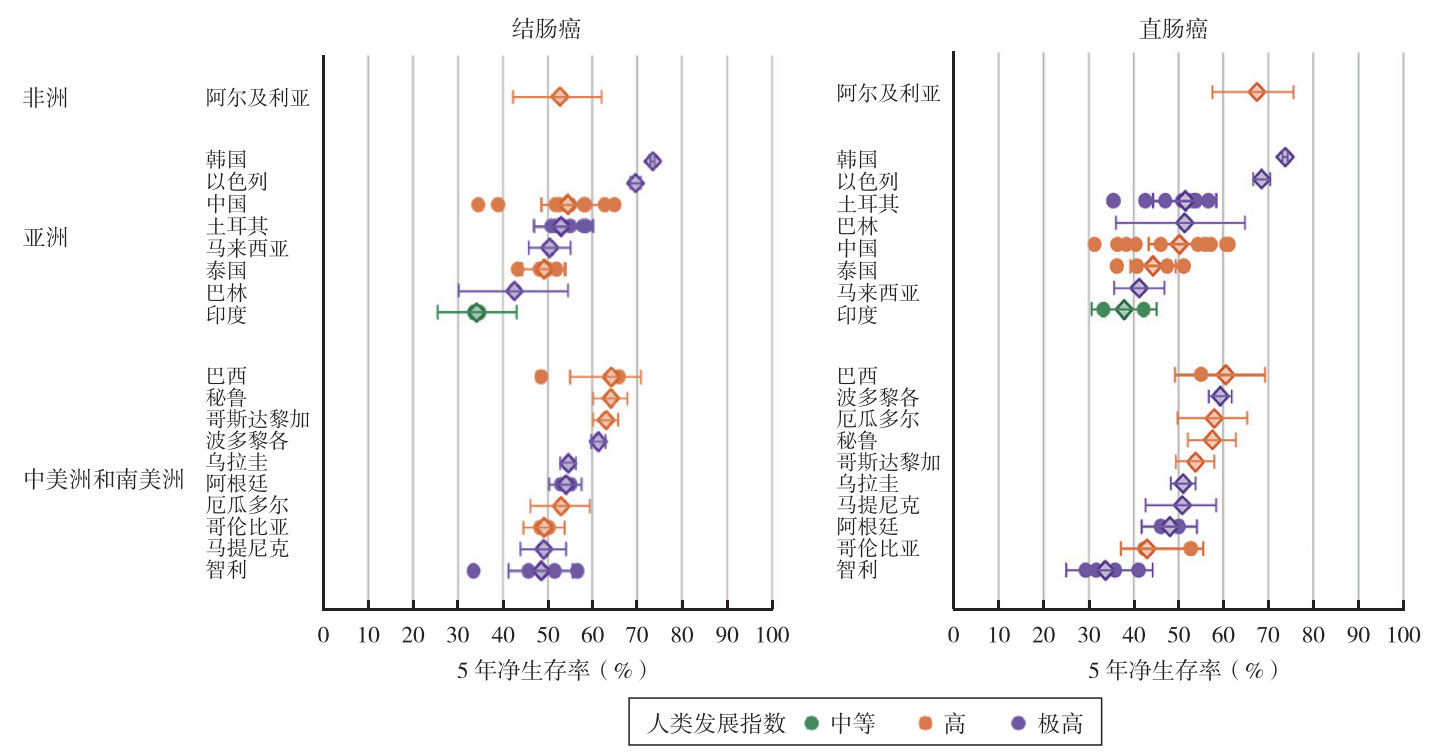
结直肠癌净生存率与HDI密切相关。近期,一项针对7个高收入国家(澳大利亚、加拿大、丹麦、爱尔兰、新西兰、挪威和英国)的研究发现,2010年至2014年诊断的结直肠癌的5年净生存率均 > 60%[14]。国际合作项目SURVCAN-3最近数据显示,在纳入研究的非洲、中南美洲和亚洲的25个国家中,2008年至2012年诊断的结直肠癌5年净生存率范围在30%~75%之间[15]。在中国,结直肠癌5年净生存率中位数分别为50%~55%,处于全球中等水平(图 1)[15]。此外,由于非洲地区中低HDI国家监测数据尚不够完善,缺少结直肠癌5年生存率的相关数据[16]。近20年来,全球结直肠癌患者的生存率保持稳定或呈增加趋势。CONCORD-3研究发现,对于结肠癌,加拿大、日本、澳大利亚和法国等国家的5年生存率提高了5%~10%;中国、以色列、韩国和英国等国家5年生存率均提高 > 10%;对于直肠癌,加拿大、以色列、韩国和挪威等国家5年生存率均提高 > 10%;中国、韩国和斯洛文尼亚等国家5年生存率增幅均 > 20%;同期,美国结直肠癌的5年生存率基本稳定在60%左右,其增幅 < 5%[17]。
目前,全球已有多个国家和地区开展结直肠癌人群筛查。然而,由于各国的国情不同,全球范围内尚没有统一的结直肠癌筛查指南。英国、加拿大和欧盟等国家和地区推荐在50岁开始进行2年1次的粪便免疫化学检查(fecal immunochemical testing,FIT),而美国则建议在45岁开始进行结直肠癌筛查[18]。中国的结直肠癌筛查起源于20世纪80年代的浙江省海宁县。随后,浙江省嘉善县首次实施“两阶段”结直肠癌筛查,即先使用数量化风险评估问卷[19]和粪便隐血试验来识别潜在的高危人群,然后对高危人群进行结肠镜检查。由于我国人群众多,卫生资源有限且不平衡,两步筛查策略被广泛应用于后续的结直肠癌筛查项目。目前,国家癌症中心的指南建议对≥40岁人群进行结直肠癌风险评估,高风险人群40岁开始进行筛查,低风险人群50岁开始进行筛查(表 3)[10, 20-21]。
| 国家/地区 | 开始年龄(岁) | 结束年龄(岁) | 筛查工具及周期 |
| 中国 | 40岁进行风险评估:高风险者40岁,中低风险者50岁。≥1个一级亲属患CRC:40岁或比一级亲属中最年轻的患者提前10岁 | 75 | FIT/年结直肠镜/5~10年FIT-DNA或FS/3年 |
| 欧盟 | 50 | 74 | gFOBT或FIT/2年结直肠镜或FS/10年 |
| 美国 | 45 | 85 | FIT/年高敏gFOBT/3年结肠镜/10年CT结肠成像或FS/5年 |
| 加拿大 | 50 | 74 | gFOBT或FIT/2年FS/10年 |
| 英国 | 50 | 74 | FIT/2年 |
| 澳大利亚 | 55 | 75 | FIT/2年 |
| 韩国 | 50 | 无 | FIT/年 |
| 日本 | 40 | 无 | FIT/年 |
| 注 CRC:结直肠癌(colorectal cancer);FIT:粪便免疫化学检测(fecal immunochemical testing);FS:软式乙状结肠镜(flexible sigmoidoscopy);gFOBT:愈创木脂粪便隐血试验(guaiacol fecal occult blood test) | |||
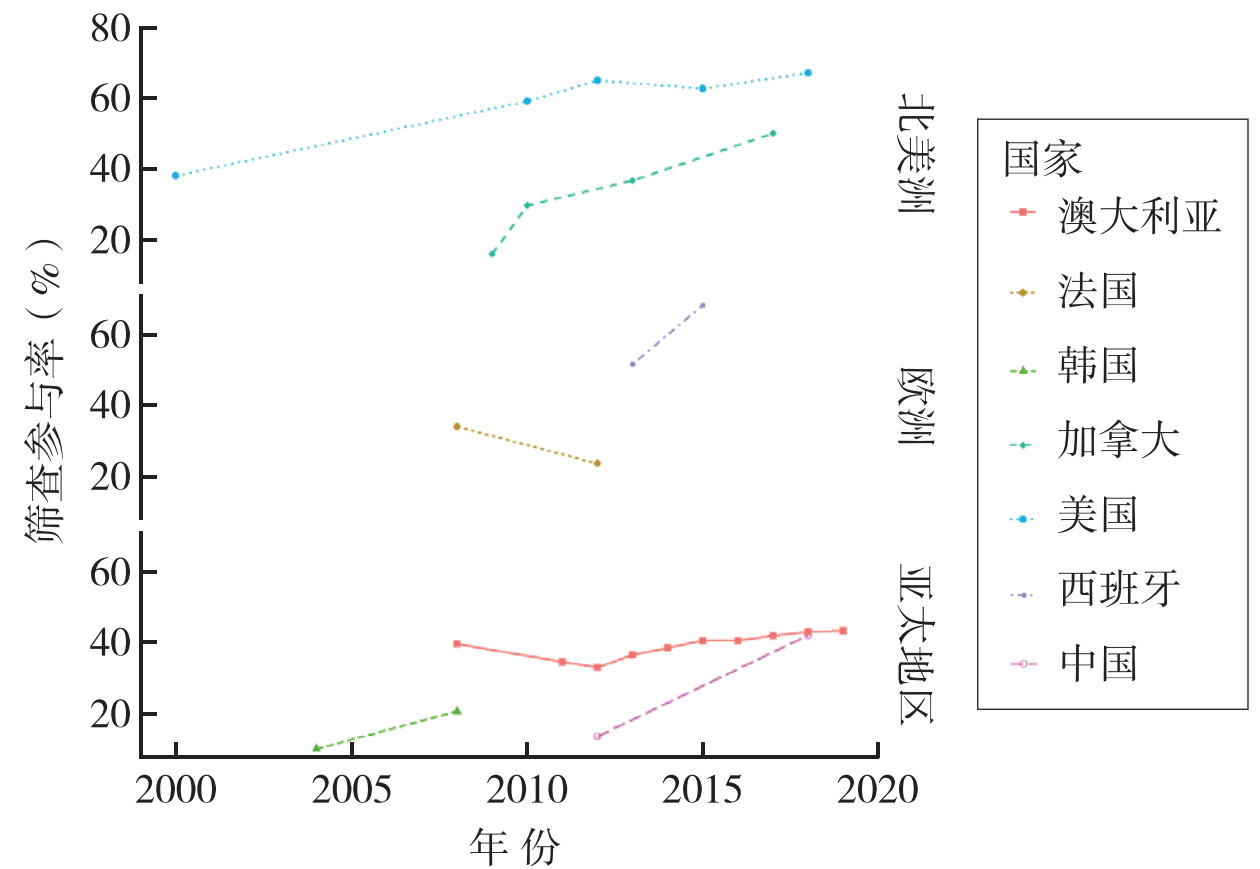
筛查可通过发现并切除癌前病变降低人群结直肠癌的发病率。同时,筛查可以促进结直肠癌的早期诊断和及时治疗,从而降低死亡率,提高生存率。美国基于人群筛查的证据表明,在50~64岁人群中,随着结肠镜筛查率从2000年的20%增加到2018年的61%,结直肠癌的总发病率下降了近40%[22]。此外,2004年至2009年在中国台湾地区开展的大型队列研究发现,FIT筛查可使人群结直肠癌死亡率降低10%[23]。筛查参与率(实际参与筛查的人占被邀请接受筛查的人的百分比)是影响筛查效果的重要指标之一。一项系统综述汇总了截止到2020年9月发表的69篇结直肠癌筛查相关研究发现,全球结直肠癌筛查参与率约为54%;其中,南美洲最高(90.19%),北美洲最低(45.57%)[24]。2018年,我国的结直肠癌筛查参与率为42.5%,低于美国(67%)和澳大利亚(43.5%),但高于古巴(24%)[10, 24-26]。上世纪90年代以来,各国的结直肠癌筛查参与率基本上呈现上升趋势(图 2)[10, 25-28]。我国现行筛查项目的总体参与率较低。在中国16个省份参加结直肠癌筛查的1 381 561人的横断面研究中,2012年至2015年,高危人群的总体结肠镜参与率仅为14%[29]。
本文总结了全球结直肠癌疾病负担现状和时间趋势。包括中国在内的全球多数中等HDI和低HDI国家结直肠癌疾病负担日趋严重。比较之下,在实施了长期筛查项目的美国、加拿大和一些欧洲国家中,结直肠癌的发病率和死亡率持续下降。由于结直肠癌诊断治疗技术不断发展,全球结直肠癌患者的生存率也呈上升趋势。
近年来,全球早发性结直肠癌发病率不断上升。50岁以下人群结直肠癌发病率增加的确切原因尚不清楚,但可能与出生队列效应有关。20世纪下半叶出生的人越来越多地暴露于潜在的结直肠癌危险因素,如不健康饮食、肥胖、久坐、体力活动不足以及成年早期吸烟率增加等[2]。另一个原因可能是多数国家指南建议从50岁开始进行结直肠癌筛查,因此较年轻的人接受筛查的可能性较小。为遏制早发性结直肠癌发病率的上升趋势,美国癌症协会在2019年建议从45岁开始进行结直肠癌筛查,尤其是对于结直肠癌高危人群(如息肉或腺瘤个人史、结直肠癌家族史或遗传风险、男性、吸烟者和超重/肥胖者)[18]。值得注意的是,早发性结直肠癌似乎比晚发性结直肠癌具有更强的侵袭性表型。例如,在组织学上多为低分化型,更常见的是有黏液和印戒特征,这些特征也使得这类结直肠癌更难被“筛”查出来[30]。考虑到年轻人结直肠癌绝对发病率仍然相对较低(只有≥50岁人群的1/10),将大规模筛查扩展到年轻人群仍需要进一步的现实世界证据支持。
过去的研究已经证明了可改变的危险因素[如肥胖、低体力活动以及不良饮食习惯(如红肉、加工肉和乙醇摄入以及低纤维、低谷物和低钙饮食)]与结直肠癌发生之间的因果关系[5]。据估计,美国 > 50%的结直肠癌病例[31]和英国45%的结直肠癌病例[10]可归因于上述可改变的危险因素。这些国家具有完善的结直肠癌危险因素监测项目,为相关研究提供了基本数据,也为结直肠癌的防控奠定了科学基础。然而,我国尚缺乏已知的结直肠癌危险因素的分布和变化趋势监测资料,这给探索结直肠癌流行变化的原因和防控措施的效果带来了困难。此外,当前结直肠癌的危险因素研究大多来自高HDI国家,虽然这些研究可以为我国的结直肠癌防控提供参考,但不能简单地套用。未来,应结合我国人群的遗传学背景和饮食生活习惯等,加强结直肠癌相关危险因素的研究和监测。除了基于传统危险因素的干预,化学预防策略具有进一步降低结直肠癌的发病率和死亡率的潜力。目前,阿司匹林、非阿司匹林非甾体抗炎药、他汀类药物和靶向代谢通路的药物以及维生素和矿物质等可用于结直肠癌化学预防[32]。然而,鉴于一般人群的结直肠癌风险较低,确定常见的中间终点(如腺瘤)以及最有可能从化学预防中获益且风险水平最低的亚组是很重要的。
目前,以人群筛查为基础的“二级预防”仍是结直肠癌的主要预防措施,也是减少结直肠癌发病和死亡最有力的措施。在长期实施结直肠癌筛查的国家和地区(如美国、法国和日本等)已经实现了结直肠癌发病率与死亡率的“双下降”[11]。在我国最早开展筛查项目的海宁市,男女性标化直肠癌死亡率也呈下降趋势[33]。目前,我国结直肠癌筛查的参与率并不理想,这可能与居民对筛查的重要性缺乏认识有关;也可能是因为现行的筛查手段,特别是具有侵入性的肠镜筛查很难被接受,尤其对于无症状的人群[34]。与内镜检查比较,FIT这种非侵入性技术具有更好的人群依从性,然而,其检出癌前病变的敏感度相对较低。在中国这样人口众多且卫生资源有限的国家,采用风险分层的筛查策略是符合国情的[10]。未来,需要加强健康宣教,提高居民对结直肠癌筛查的认识。同时,需要进一步完善包含遗传变异和环境危险因素的风险预测模型,这将可能有助于精确识别高危人群并采用适宜的筛查策略,从而提高民众对筛查的接受程度和参与率。此外,实践中必须解决筛查的成本效益、医疗资源分配和卫生服务的公平性等关键问题。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2021, 71(3): 209-249. |
| [2] |
Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017, 66(4): 683-691. DOI:10.1136/gutjnl-2015-310912 |
| [3] |
Shao BL, Zhu MJ, Shen K, et al. Disease burden of total and early-onset colorectal cancer in China from 1990 to 2019 and predictions of cancer incidence and mortality[J]. Clin Epidemiol, 2023, 15: 151-163. DOI:10.2147/CLEP.S391058 |
| [4] |
Wang W, Yin P, Liu YN, et al. Mortality and years of life lost of colorectal cancer in China, 2005-2020: findings from the national mortality surveillance system[J]. Chin Med J (Engl), 2021, 134(16): 1933-1940. DOI:10.1097/CM9.0000000000001625 |
| [5] |
GBD Colorectal Cancer Collaborators. Global, regional, and national burden of colorectal cancer and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Gastroenterol Hepatol, 2022, 7(7): 627-647. DOI:10.1016/S2468-1253(22)00044-9 |
| [6] |
Kanth P, Inadomi JM. Screening and prevention of colorectal cancer[J]. BMJ, 2021, 374: n1855. |
| [7] |
Morgan E, Arnold M, Gini A, et al. Global burden of colorectal cancer in 2020 and 2040: incidence and mortality estimates from GLOBOCAN[J]. Gut, 2023, 72(2): 338-344. DOI:10.1136/gutjnl-2022-327736 |
| [8] |
International Agency for Research on Cancer. Cancer today[EB/OL]. [2023-04-10]. https://gco.iarc.fr/today/home.
|
| [9] |
Zhou JC, Zheng RS, Zhang SW, et al. Colorectal cancer burden and trends: comparison between China and major burden countries in the world[J]. Chin J Cancer Res, 2021, 33(1): 1-10. DOI:10.21147/j.issn.1000-9604.2021.01.01 |
| [10] |
Li N, Lu B, Luo CY, et al. Incidence, mortality, survival, risk factor and screening of colorectal cancer: a comparison among China, Europe, and northern America[J]. Cancer Lett, 2021, 522: 255-268. DOI:10.1016/j.canlet.2021.09.034 |
| [11] |
郑莹, 王泽洲. 全球结直肠癌流行数据解读[J]. 中华流行病学杂志, 2021, 42(1): 149-152. DOI:10.3760/cma.j.cn112338-20200401-00495 |
| [12] |
Siegel RL, Torre LA, Soerjomataram I, et al. Global patterns and trends in colorectal cancer incidence in young adults[J]. Gut, 2019, 68(12): 2179-2185. DOI:10.1136/gutjnl-2019-319511 |
| [13] |
Burnett-Hartman AN, Lee JK, Demb J, et al. An update on the epidemiology, molecular characterization, diagnosis, and screening strategies for early-onset colorectal cancer[J]. Gastroenterology, 2021, 160(4): 1041-1049. DOI:10.1053/j.gastro.2020.12.068 |
| [14] |
Araghi M, Arnold M, Rutherford MJ, et al. Colon and rectal cancer survival in seven high-income countries 2010-2014: variation by age and stage at diagnosis (the ICBP SURVMARK-2 project)[J]. Gut, 2021, 70(1): 114-126. DOI:10.1136/gutjnl-2020-320625 |
| [15] |
Soerjomataram I, Cabasag C, Bardot A, et al. Cancer survival in Africa, central and south America, and Asia (SURVCAN-3): a population-based benchmarking study in 32 countries[J]. Lancet Oncol, 2023, 24(1): 22-32. DOI:10.1016/S1470-2045(22)00704-5 |
| [16] |
Bray F, Parkin DM, African Cancer Registry Network. Cancer in sub-Saharan Africa in 2020: a review of current estimates of the national burden, data gaps, and future needs[J]. Lancet Oncol, 2022, 23(6): 719-728. DOI:10.1016/S1470-2045(22)00270-4 |
| [17] |
Allemani C, Matsuda T, Di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [18] |
Wolf AMD, Fontham ETH, Church TR, et al. Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society[J]. CA Cancer J Clin, 2018, 68(4): 250-281. DOI:10.3322/caac.21457 |
| [19] |
陈坤. 人群大肠癌筛检的一个数量化方法[J]. 浙江医科大学学报, 1988, 17(2): 49-52. |
| [20] |
Shaukat A, Levin TR. Current and future colorectal cancer screening strategies[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(8): 521-531. DOI:10.1038/s41575-022-00612-y |
| [21] |
国家癌症中心中国结直肠癌筛查与早诊早治指南制定专家组. 中国结直肠癌筛查与早诊早治指南(2020, 北京)[J]. 中国肿瘤, 2021, 30(1): 1-28. |
| [22] |
Siegel R, DeSantis C, Jemal A. Colorectal cancer statistics, 2014[J]. CA A Cancer J Clin, 2014, 64(2): 104-117. DOI:10.3322/caac.21220 |
| [23] |
Chiu HM, Chen SLS, Yen AMF, et al. Effectiveness of fecal immunochemical testing in reducing colorectal cancer mortality from the One Million Taiwanese Screening Program[J]. Cancer, 2015, 121(18): 3221-3229. DOI:10.1002/cncr.29462 |
| [24] |
Ding HY, Lin JY, Xu ZJ, et al. A global evaluation of the performance indicators of colorectal cancer screening with fecal immunochemical tests and colonoscopy: a systematic review and meta-analysis[J]. Cancers, 2022, 14(4): 1073. DOI:10.3390/cancers14041073 |
| [25] |
Chen HD, Lu M, Liu CC, et al. Comparative evaluation of participation and diagnostic yield of colonoscopy vs fecal immunochemical test vs risk-adapted screening in colorectal cancer screening: interim analysis of a multicenter randomized controlled trial (TARGET-C)[J]. Am J Gastroenterol, 2020, 115(8): 1264-1274. DOI:10.14309/ajg.0000000000000624 |
| [26] |
International Agency for Research on Cancer. CanScreen5[EB/OL]. [2023-04-10]. https://canscreen5.iarc.fr.
|
| [27] |
Canadian Partnership Against Cancer. Topics: colorectal[EB/OL]. [2023-04-10]. https://www.partnershipagainstcancer.ca/?s=&post_type=topics&taxonomy=dbt-cancer-site&term=dbv-colorectal
|
| [28] |
Australian Institute of Health and Welfare. Cancer screening[EB/OL]. [2023-04-10]. https://www.aihw.gov.au/reports-data/health-welfare-services/cancer-screening/overview
|
| [29] |
Chen HD, Li N, Ren JS, et al. Participation and yield of a population-based colorectal cancer screening programme in China[J]. Gut, 2019, 68(8): 1450-1457. DOI:10.1136/gutjnl-2018-317124 |
| [30] |
Hepatology TLG. Colorectal cancer screening: is earlier better?[J]. Lancet Gastroenterol Hepatol, 2018, 3(8): 519. DOI:10.1016/S2468-1253(18)30205-X |
| [31] |
Islami F, Goding Sauer A, Miller KD, et al. Proportion and number of cancer cases and deaths attributable to potentially modifiable risk factors in the United States[J]. CA Cancer J Clin, 2018, 68(1): 31-54. |
| [32] |
Katona BW, Weiss JM. Chemoprevention of colorectal cancer[J]. Gastroenterology, 2020, 158(2): 368-388. |
| [33] |
朱云峰, 王乐, 沈永洲, 等. 1977-2018年浙江省海宁市结直肠癌流行趋势分析[J]. 中国肿瘤, 2020, 29(11): 833-837. |
| [34] |
Cao M, Li H, Sun D, et al. Cancer screening in China: the current status, challenges, and suggestions[J]. Cancer Lett, 2021, 506: 120-127. |
 2023, Vol. 38
2023, Vol. 38