文章信息
- 钟淙, 石琴, 章超
- Zhong Cong, Shi Qin, Zhang Chao
- lncRNA MALAT1调控miR-144-3p/ZEB1对肺癌放射敏感性的影响
- Effect of lncRNA MALAT1 regulating miR-144-3p/ZEB1 on radiosensitivity of lung cancer
- 实用肿瘤杂志, 2022, 37(4): 307-314
- Journal of Practical Oncology, 2022, 37(4): 307-314
-
通信作者
- 钟淙,E-mail:zchong833@163.com
-
文章历史
- 收稿日期:2021-04-07
肺癌是世界上与癌症相关死亡的第二大原因,生存率低。放疗是肺癌的有效治疗方法,但是其存在癌细胞的抗辐射性以及无差别攻击周围正常细胞的缺陷,因此加强癌细胞的放射敏感性势在必行[1-2]。非编码RNA(non-coding RNA,ncRNA)不仅能够通过调节基因表达来参与癌症的发生和侵袭,还在癌细胞的放射敏感性方面及保护正常细胞免受辐射不良反应中起重要作用[3-4]。长链非编码RNA(long non-coding RNA,lncRNA)肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)等多种lncRNA涉及对放疗的反应[2]。除此之外,包括miR-144-3p在内的多种miRNA能够赋予癌细胞放射增敏作用。miR-144-3p通过抑制E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)表达提高胃癌细胞放射敏感性[5-6]。MALAT1在癌细胞放射敏感性中的作用是否与miR-144-3p/ZEB1相关还未可知,因此本研究对其是否可通过调控miR-144-3p/ZEB1影响肺癌细胞放射敏感性进行探究,以期为肺癌放疗应用提供理论依据,为加强肺癌细胞放射敏感性的研究提供参考。
1 材料与方法 1.1 试剂和仪器肺癌A549细胞和pmirGLO质粒购自武汉益普生物科技有限公司。人正常肺HBE细胞购自武汉普诺赛生命科技有限公司。Lipofectamine™ 2000 Transfection Reagent购自美国赛默飞世尔科技。即用型荧光定量PCR试剂盒购自上海烜雅生物科技有限公司。总RNA提取试剂盒购自上海吉至生化科技有限公司。QIAGEN反转录试剂盒购自上海科敏生物科技有限公司。青霉素-链霉素购自上海联迈生物工程有限公司。胰酶溶液购自武汉博士德生物工程有限公司。胎牛血清和DMEM培养液购自武汉益普生物科技有限公司。Annexin V-FITC/PI Apoptosis Detection试剂盒购自南京诺唯赞生物科技股份有限公司。阴性对照慢病毒、sh-MALAT1慢病毒、过表达对照慢病毒、miR-144-3p模拟物、沉默对照慢病毒、miR-144-3p抑制剂由广州基迪奥生物公司合成;兔抗人ZEB1、caspase-3和Bax抗体购自美国Cell Signaling Technology。兔抗人c-Myc和β-actin抗体购自上海Abcam;MTT检测试剂盒、BCA蛋白检测试剂盒和HRP标记的山羊抗兔IgG二抗抗体购自北京百奥莱博科技有限公司。蛋白提取试剂盒购自武汉纯度生物科技有限公司。双荧光素酶报告基因检测试剂盒购自上海翊圣生物科技有限公司。
Bio-Rad伯乐荧光定量PCR仪CFX Connect购自南京贝登医疗股份有限公司。蛋白凝胶成像仪购自美国Bio-Rad公司。CytoFLEX流式细胞仪购自美国贝克曼库尔特有限公司。
1.2 实验方法 1.2.1 细胞与培养A549及HBE细胞接种到DMEM培养液中后均置于37℃ 5%CO2恒温培养箱中培养。培养液2 d更换1次,细胞融合至80%左右时用胰酶消化进行传代培养。
1.2.2 A549细胞瞬时转染将A549细胞分为A549组(不进行处理)、放射组(6 MV X线垂直照射)、MALAT1沉默对照组(转染阴性对照慢病毒)、MALAT1沉默组(转染sh-MALAT1慢病毒)、过表达对照组(转染过表达对照慢病毒)、miR-144-3p过表达组(转染miR-144-3p模拟物)、MALAT1沉默+沉默对照组(sh-MALAT1慢病毒与沉默对照慢病毒共转染)和MALAT1沉默+miR-144-3p沉默组(sh-MALAT1慢病毒与miR-144-3p抑制剂共转染),取1 mL对数生长期A549细胞以2×105个/mL接种于6孔板中,每组设置6个复孔,细胞贴壁后,按Lipofectamine™ 2000说明书分别进行相应转染,培养48 h后进行后续实验。
1.2.3 实时荧光定量PCR检测MALAT1及miR-144-3p的表达miR-144-3p及MALAT1通过RNA提取试剂盒提取其在细胞内的总RNA并反转录为cDNA后进行RT-qPCR检测二者表达水平(n=5)。分别用U6和GAPDH为内参对miR-144-3p及MALAT1进行标准化,2-∆∆Ct分析其表达水平。使用Oligo 7和Primer 3.0软件设计两者引物并送生工生物工程(上海)股份有限公司合成。miR-144-3p上游引物为5'-AGAATCGCTTGAAC CCAGGA-3',下游引物为5'-AACAGGGAGAAGTGAGAGGC-3'。MALAT1上游引物为5'-AAAGCAAGGTCTCCCCACAAG-3',下游引物为5'-GGTCTGTGCTAGATCAAAAGGCA-3'。U6上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-AACGCTTCACGAATTTGCGT-3'。GAPDH上游引物为5'-AGCCACATCGCTCAGACA-3',下游引物为5'-TGGACTCCACGACGTACT-3'。
1.2.4 集落形成实验测定细胞放射敏感性取1.2.2中各组细胞,进行6 MV X线垂直照射(剂量率为3 Gy/min,剂量为0、2、4、6和8 Gy),培养48 h,A549细胞经15 min甲醇固定,吉姆萨染色30 min后计数细胞集落数(n=3);集落形成率(plating efficiency,PE;%)=集落数/接种数×100%;存活分数(survival fraction,SF)=(PE处理组/PE对照组)×100%;单击多靶模型对A549细胞存活曲线拟合,计数放射生物学参数以及放射增敏比(sensitizer enhancement ratio,SER)=对照组D0值/处理组D0值;SF=1-(1-e-D/D0)×N,Dq=D0×InN,(D:辐射剂量;D0:平均致死剂量,用于反映细胞对射线的敏感性;Dq:准域剂量,用于表示细胞亚致死性损伤修复能力;N:外推数,用于反映细胞内含有的放射敏感区域数或靶数)[7]。
1.2.5 MTT法检测细胞活力选取4 Gy为最佳照射剂量分别处理1.2.2中各组细胞(A549组细胞不接受放射线照射)后,1×105个/孔,重复5孔,每孔100 μL,在96孔板中培养至对数生长期(分别处理后培养24 h)。添加MTT 10 μL/孔(5 g/L),4 h后弃上清培养液加入DMSO 100 μL,震荡至MTT反应结晶充分溶解后,在570 nm处测定吸光度(absorbance,A)值,计算A549细胞存活率:(A处理组/A对照组)×100%。
1.2.6 流式细胞仪检测A549细胞凋亡情况将4 Gy照射剂量处理后的1.2.2中各组细胞(A549组细胞不接受放射线照射)进行PBS洗涤,胰酶消化后,调整细胞浓度为1×106个/孔加入Annexin V-FITC避光孵育15 min后,流式仪观察A549细胞凋亡率(n=5)。
1.2.7 双荧光素酶报告基因检测MALAT1、miR-144-3p和ZEB1的靶向关系通过TargetScan(http://www.Targetscan.org/)确定miR-144-3p和MALAT1以及miR-144-3p和ZEB1结合位点,分别验证二者的靶向关系。首先将与miR-144-3p靶向序列相结合的MALAT1和ZEB1的3'-UTR片段经扩增、酶切和连接后构建野生型和突变型MALAT1和ZEB1载体:pmirGLO-MALAT1-wt、pmirGLO-MALAT1-mut、pmirGLO-ZEB1-wt和pmirGLO-ZEB1-mut。将接种于96孔板的对数生长期A549细胞分为pmirGLO-MALAT1-wt+miR-144-3p过表达组、pmirGLO-MALAT1-wt+过表达对照组、pmirGLO-MALAT1-mut+miR-144-3p过表达组、pmirGLO-MALAT1-mut+过表达对照组、pmirGLO-ZEB1-wt+miR-144-3p过表达组、pmirGLO-ZEB1-wt+过表达对照组、pmirGLO-ZEB1-mut+miR-144-3p过表达组和pmirGLO-ZEB1-mut+过表达对照组。根据Lipofectamine™ 2000说明书分别进行相应转染48 h后检测荧光素酶活性:加入200 μL报告基因细胞裂解液及50 μL荧光素酶反应液检测荧光强度A后再加入反应终止液检测荧光强度B,荧光素酶相对活性则为A/B。
1.2.8 Western blot检测ZEB1蛋白以及增殖和凋亡相关蛋白表达情况使用RIPA裂解液对A549细胞进行裂解后,用BCA蛋白试剂盒测定各组细胞总蛋白含量;SDS-PAGE电泳分离蛋白,低温转至PVDF膜上,脱脂奶粉进行为时1 h的封闭,加入兔抗ZEB1、caspase-3、Bax、c-Myc和β-actin一抗孵育(4℃)过夜后再用二抗孵育2 h,蛋白凝胶成像仪定量分析各蛋白含量(n=5)。
1.3 统计学分析采用SPSS 23.0统计学软件进行数据分析。计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,多组间采用单因素方差分析。以P < 0.05为差异具有统计学意义。图形采用Origin软件进行制作。
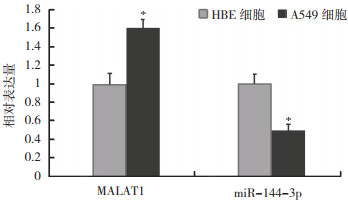
2 结果 2.1 MALAT1和miR-144-3p在A549及HBE细胞中的表达情况与HBE细胞比较,A549细胞中MALAT1表达水平增加,而miR-144-3p表达水平降低(P < 0.05,图 1)。
|
| 注 *与HBE细胞比较,P < 0.05 图 1 MALAT1和miR-144-3p在A549及HBE细胞中的表达情况 Fig.1 Expression of MALAT1 and miR-144-3p in A549 and HBE cells |
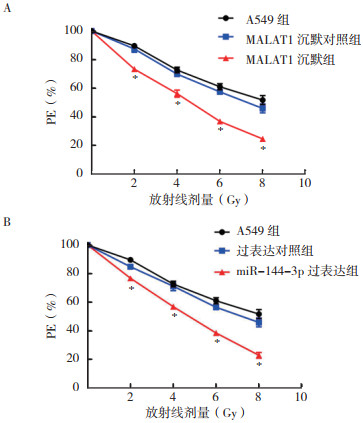
随着放射剂量的增加,各组细胞PE均逐渐降低。与A549组比较,MALAT1沉默组以及miR-144-3p过表达组细胞在2、4、6和8 Gy放射剂量时PE均降低(均P < 0.05)。单击多靶模型显示,MALAT1沉默组与miR-144-3p过表达组SER分别为1.762和1.992,提示MALAT1沉默表达以及miR-144-3p过表达均对A549细胞具有放射增敏作用(表 1,图 2)。
| 组别 | D0(Gy) | Dq(Gy) | N | SER |
| A549组 | 9.233 | 2.401 | 1.297 | - |
| MALAT1沉默对照组 | 7.981 | 2.288 | 1.332 | 1.157 |
| MALAT1沉默组 | 5.241 | 1.006 | 1.212 | 1.762 |
| 过表达对照组 | 8.598 | 1.745 | 1.225 | 1.074 |
| miR-144-3p过表达组 | 4.636 | 1.758 | 1.461 | 1.992 |
| 注 D0:平均致死剂量;Dq:准域剂量;N:外推数;SER:放射增敏比(sensitizer enhancement ratio) | ||||
|
| 注 A:MALAT1沉默对A549细胞放射敏感性的影响;B:miR-144-3p过表达对A549细胞放射敏感性的影响;*与A549组比较,P < 0.05;PE:集落形成率(plating efficiency) 图 2 沉默MALAT1和过表达miR-144-3p对A549细胞放射敏感性的影响 Fig.2 Effect of silencing MALAT1 and overexpressing miR-144-3p on the radiosensitivity of A549 cells |
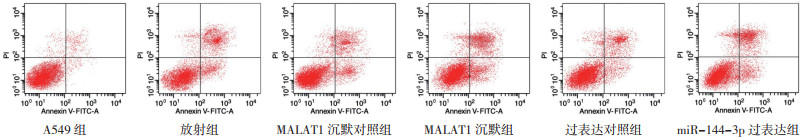
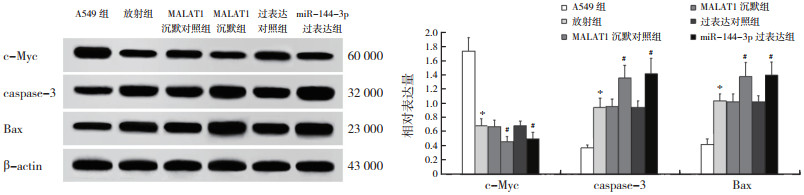
与A549组比较,放射组A549细胞存活率和c-Myc表达均降低,而凋亡率、caspase-3和Bax表达均增加(均P < 0.05)。与放射组比较,MALAT1沉默组和miR-144-3p过表达组细胞存活率和c-Myc表达均降低,凋亡率、caspase-3和Bax表达均增加(均P < 0.05,表 2,图 3~4)。
| 组别 | 细胞存活率 | 细胞凋亡率 |
| A549组 | 100 | 2.37±0.51 |
| 放射组 | 58.74±4.30* | 27.55±2.15* |
| MALAT1沉默对照组 | 58.30±4.12 | 27.13±3.24 |
| MALAT1沉默组 | 41.15±3.15# | 38.17±3.45# |
| 过表达对照组 | 59.03±5.11 | 26.97±2.22 |
| miR-144-3p过表达组 | 45.46±4.52# | 39.75±3.40# |
| 注 *与A549组比较,P < 0.05;#与放射组比较,P < 0.05 | ||
|
| 图 3 沉默MALAT1、过表达miR-144-3p与放射对A549细胞凋亡的影响 Fig.3 Effects of silencing MALAT1, overexpressing miR-144-3p and radiation on A549 cell apoptosis |
|
| 注 *与A549组比较,P < 0.05;#与放射组比较,P < 0.05 图 4 沉默MALAT1、过表达miR-144-3p与放射对A549细胞增殖和凋亡相关蛋白表达的影响 Fig.4 Effects of silencing MALAT1, overexpressing miR-144-3p and radiation on the expression of A549 cell proliferation- and apoptosis-related proteins |
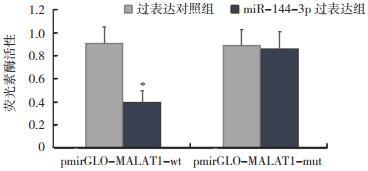
TargetScan(http://www.Targetscan.org/)预测显示,MALAT1和miR-144-3p间具有结合位点,miR-144-3p是MALAT1的潜在靶基因(图 5)。荧光素酶报告基因结果显示,与pmirGLO-MALAT1-wt+过表达对照组比较,pmirGLO-MALAT1-wt+miR-144-3p过表达组荧光素酶活性降低,其余荧光素酶活性无明显变化(图 6)。与A549组(1.00±0.11)比较,MALAT1沉默对照组(1.01±0.12)miR-144-3p表达水平无变化(P > 0.05),MALAT1沉默组(1.40±0.19)miR-144-3p表达水平增加(P < 0.05)。
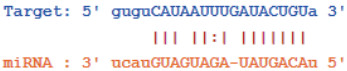
|
| 图 5 MALAT1和miR-144-3p结合位点 Fig.5 MALAT1 and miR-144-3p binding sites |
|
| 注 *与过表达对照组比较,P < 0.05 图 6 MALAT1和miR-144-3p靶向关系验证 Fig.6 Validation of the targeting relationship between MALAT1 and miR-144-3p |
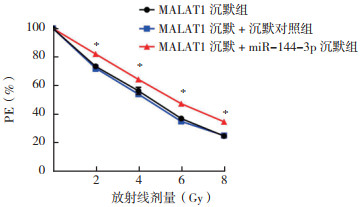
根据单击多靶模型,MALAT1沉默+miR-144-3p沉默组SER为0.867,表明miR-144-3p沉默可逆转MALAT1沉默对A549细胞的放射敏感性(表 3,图 7)。
| 组别 | D0(Gy) | Dq(Gy) | N | SER |
| MALAT1沉默组 | 5.241 | 1.006 | 1.212 | - |
| MALAT1沉默+沉默对照组 | 5.362 | 0.655 | 1.130 | 0.977 |
| MALAT1沉默+miR-144-3p沉默组 | 6.042 | 1.968 | 1.385 | 0.867 |
| 注 D0:平均致死剂量;Dq:准域剂量;N:外推数;SER:放射增敏比(sensitizer enhancement ratio) | ||||
|
| 注 *与MALAT1沉默组比较,P < 0.05;PE:集落形成率(plating efficiency) 图 7 sh-MALAT1与miR-144-3p抑制剂共转染对A549细胞放射敏感性的影响 Fig.7 Effects of sh-MALAT1 co-transfection with miR-144-3p inhibitor on the radiosensitivity of A549 cells |
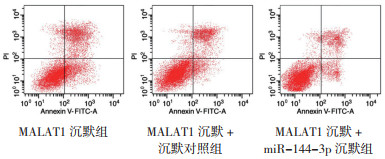
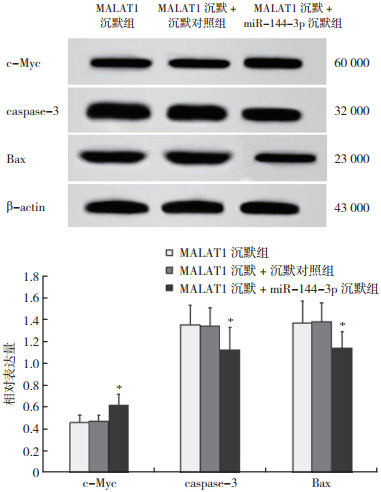
与MALAT1沉默组比较,MALAT1沉默+miR-144-3p沉默组细胞存活率和c-Myc表达均增加,凋亡率、caspase-3表达和Bax表达均降低(均P < 0.05,表 4,图 8~9)。
| 组别 | 细胞存活率 | 细胞凋亡率 |
| MALAT1沉默组 | 41.15±3.15 | 38.17±3.45 |
| MALAT1沉默+沉默对照组 | 40.91±3.84 | 37.93±4.01 |
| MALAT1沉默+miR-144-3p沉默组 | 52.10±4.05* | 28.25±2.57* |
| 注 *与MALAT1沉默组比较,P < 0.05 | ||
|
| 图 8 sh-MALAT1与miR-144-3p抑制剂共转染对A549细胞凋亡的影响 Fig.8 Effect of co-transfection of sh-MALAT1 and miR-144-3p inhibitor on A549 cell apoptosis |
|
| 注 *与MALAT1沉默组比较,P < 0.05 图 9 sh-MALAT1与miR-144-3p抑制剂共转染对A549细胞增殖和凋亡相关蛋白表达的影响 Fig.9 Effects of sh-MALAT1 co-transfected with miR-144-3p inhibitor on the proliferation- and apoptosis-related protein expressions in A549 cells |
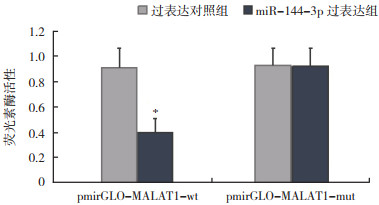
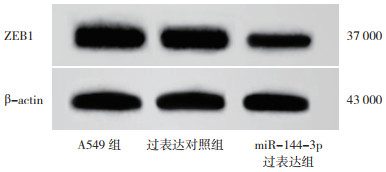
TargetScan(http://www.Targetscan.org/)预测显示,miR-144-3p和ZEB1间具有结合位点,ZEB1是miR-144-3p的潜在靶基因(图 10)。荧光素酶报告基因结果显示,与pmirGLO-ZEB1-wt+过表达对照组比较,pmirGLO-ZEB1-wt+miR-144-3p过表达组荧光素酶活性降低(P < 0.05);其余组荧光素酶活性无变化(P > 0.05,图 11)。与A549组(1.26±0.21)比较,过表达对照组(1.25±0.12)ZEB1表达水平无变化(P > 0.05,图 12),miR-144-3p过表达组(0.50±0.07)ZEB1表达水平降低(P < 0.05)。
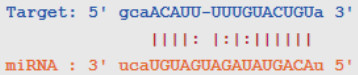
|
| 图 10 miR-144-3p和ZEB1结合位点 Fig.10 miR-144-3p and ZEB1 binding sites |
|
| 注 *与过表达对照组比较,P < 0.05 图 11 miR-144-3p和ZEB1靶向关系验证 Fig.11 Validation of targeting relationship between miR-144-3p and ZEB1 |
|
| 图 12 miR-144-3p过表达对ZEB1蛋白表达的影响 Fig.12 Effect of miR-144-3p overexpression on ZEB1 protein expression |
肺癌是世界上癌症相关死亡的主要原因之一,其中主要以非小细胞肺癌为主,预后生存率 < 15%,并且其发生率和死亡率还在逐年上升,放疗是除外科手术外的第二大有效治疗方法,但癌细胞的抗辐射性是导致癌症复发和不良预后的一大主要原因,因此有必要研究提高癌细胞放射敏感性的方法,以提高患者生存率[8-11]。
已发现lncRNA通过调节细胞周期停滞、凋亡、癌症干细胞调节、上皮-间质转化和自噬等各种机制来影响癌细胞的放射敏感性,有望成为放疗潜在治疗靶标[12-13]。MALAT1是癌症中被广泛研究的lncRNA,其对于癌症相关途径的调节十分重要[14]。先前已有研究发现,lncRNA MALAT1在子宫颈癌和肺癌等不同癌症中通过增强上皮-间质转化和血管生成促进癌症进展,而近些年MALAT1对癌细胞放射敏感性的影响作用被报道出来,抑制其表达可增强食管鳞状细胞癌的放射敏感性和化学敏感性[15]。MALAT1通过与miR-143相互作用来调节子宫颈癌细胞的存活和凋亡,从而影响放疗效果[16]。miRNA通过靶向降解或抑制mRNA表达发挥癌基因或抑癌基因。最近有研究表明,一些miRNA表达与放疗之间的联系,特别是在肺癌中[8]。lncRNA可以起miRNA海绵的作用,以调节癌细胞的放射敏感性[13]。lncRNA母系印记基因3(maternally imprinted genes 3,MEG3)可通过下调miR-7-5p表达来促进鼻咽癌细胞的放射敏感性[17]。miR-144-3p具有抑癌作用,在包括肺癌在内的多种肿瘤中被下调。miR-144-5p能够通过靶向活化转录因子2(activating transcription factor-2,ATF2)增强非小细胞肺癌细胞的放射敏感性,而miR-144-3p可通过抑制ZEB1表达提高胃癌细胞放射敏感性[5, 18]。MALAT1在骨肉瘤细胞中通过充当miR-144-3p的竞争性内源RNA(competing endogenous RNA,ceRNA)来促进肿瘤细胞的转移和增殖[19]。本研究发现,在A549细胞中MALAT1表达水平增加,而miR-144-3p表达水平降低,抑制MALAT1表达或miR-144-3p过表达均能抑制细胞增殖,促进细胞凋亡,增加细胞放射敏感性。在肺癌中,MALAT1和miR-144-3p与癌细胞的增殖、凋亡和放射敏感性有关。双荧光素酶报告基因结果显示,MALAT1靶向下调miR-144-3p表达水平,其沉默促进miR-144-3p的表达,与已报道的研究结果一致[20-21];而且,miR-144-3p沉默可逆转MALAT1沉默对细胞增殖、凋亡和放射敏感性的影响; 表明MALAT1通过靶向抑制miR-144-3p表达来抑制肺癌细胞的放射敏感性。
ZEB1在肿瘤内皮间质转化及癌症发展中具有重要作用,在肺癌中ZEB1高表达的肺腺癌患者转移率增加,总生存率降低。研究发现,抑制睾丸孤核受体4(testicular orphan nuclear receptor 4,TR4)可通过调节蛋白振动(quaking,QKI)/ circZEB1/miR-141-3p/ZEB1信号通路来促进细胞放射敏感性并更好地抑制前列腺癌的发生,ZEB1已被作为放射敏感性调节剂[22-23]。在胃癌中,ZEB1是miR-144-3p的潜在靶基因,miR-144-3p通过抑制ZEB1表达提高癌细胞的放射敏感性[5]。有研究发现,MALAT1可通过miR-143-3p调节ZEB1的表达,促进肝细胞癌的发展[24]。本研究发现,miR-144-3p靶向下调ZEB1表达水平,其过表达可降低ZEB1表达水平,提示MALAT1对肺癌细胞放射敏感性的影响可能与miR-144-3p/ZEB1有关。
综上所述,lncRNA MALAT1沉默通过促进miR-144-3p/ZEB1轴增强肺癌细胞的放射敏感性。本研究为MALAT1在肺癌细胞放射敏感性中的主要机制研究提供了一定参考,在未来的研究中还需要在不同的细胞株中验证其可靠性。
| [1] |
Sui X, Geng JH, Yu HM, et al. Radiosensitivity of cancer stem cells in lung cancer cell lines[J]. J Vis Exp, 2019, 150: e60046. |
| [2] |
Ebahimzadeh K, Shoorei H, Mousavinejad SA, et al. Emerging role of non-coding RNAs in response of cancer cells to radiotherapy[J]. Pathol Res Pract, 2021, 218: 153327. DOI:10.1016/j.prp.2020.153327 |
| [3] |
Beermann J, Piccoli MT, Viereck J, et al. Non-coding RNAs in development and disease: background, mechanisms, and therapeutic approaches[J]. Physiol Rev, 2016, 96(4): 1297-1325. DOI:10.1152/physrev.00041.2015 |
| [4] |
Chen L, Ren P, Zhang YD, et al. Long non-coding RNA GAS5 increases the radiosensitivity of A549 cells through interaction with the miR-21/PTEN/Akt axis[J]. Oncol Rep, 2020, 43(3): 897-907. |
| [5] |
Gao ZY, Liu H, Zhang Z. miR-144-3p increases radiosensibility of gastric cancer cells by targeting inhibition of ZEB1[J]. Clin Transl Oncol, 2021, 23(3): 491-500. DOI:10.1007/s12094-020-02436-1 |
| [6] |
孙献涛, 练延帮, 白杨, 等. LncRNA CRNDE靶向miR-384影响结直肠癌细胞放射敏感性的研究[J]. 中华放射医学与防护杂志, 2019, 39(12): 893-898. DOI:10.3760/cma.j.issn.0254-5098.2019.12.003 |
| [7] |
孙克康, 吴晓阳, 陈文, 等. ErbB2转录因子1增加肺癌A549细胞的放射敏感性的实验研究[J]. 中华实验外科杂志, 2014, 31(3): 584-586. DOI:10.3760/cma.j.issn.1001-9030.2014.03.045 |
| [8] |
Wang J, Jiang MW, Xia SA. miR-339-5p increases radiosensitivity of lung cancer cells by targeting phosphatases of regenerating liver-1 (PRL-1)[J]. Med Sci Monit, 2018, 24: 8408-8416. DOI:10.12659/MSM.910808 |
| [9] |
Sheng JX, Zhao QZ, Zhao JY, et al. SRSF1 modulates PTPMT1 alternative splicing to regulate lung cancer cell radioresistance[J]. EBioMedicine, 2018, 38: 113-126. DOI:10.1016/j.ebiom.2018.11.007 |
| [10] |
Ding XF, Cheng JJ, Pang QS, et al. BIBR1532, a selective telomerase inhibitor, enhances radiosensitivity of non-small cell lung cancer through increasing telomere dysfunction and ATM/CHK1 inhibition[J]. Int J Radiat Oncol Biol Phys, 2019, 105(4): 861-874. DOI:10.1016/j.ijrobp.2019.08.009 |
| [11] |
黄旻然, 金娇悦, 吴映雪, 等. 吉非替尼耐药的低分化肺癌细胞系的建立及其生物学特征分析[J]. 实用肿瘤杂志, 2020, 35(2): 127-133. |
| [12] |
谭化姣, 廖琼. 自噬与非小细胞肺癌治疗研究进展[J]. 实用肿瘤杂志, 2021, 36(3): 209-214. |
| [13] |
Zhu JM, Chen SS, Yang BX, et al. Molecular mechanisms of lncRNAs in regulating cancer cell radiosensitivity[J]. Biosci Rep, 2019, 39(8): BSR20190590. DOI:10.1042/BSR20190590 |
| [14] |
Goyal B, Yadav SRM, Awasthee N, et al. Diagnostic, prognostic, and therapeutic significance of long non-coding RNA MALAT1 in cancer[J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(2): 188502. DOI:10.1016/j.bbcan.2021.188502 |
| [15] |
Yao Q, Yang J, Liu T, et al. Long noncoding RNA MALAT1 promotes the stemness of esophageal squamous cell carcinoma by enhancing YAP transcriptional activity[J]. FEBS Open Bio, 2019, 9(8): 1392-1402. DOI:10.1002/2211-5463.12676 |
| [16] |
Zhu P, Wang FQ, Li QR. Correlation study between long non-coding RNA MALAT1 and radiotherapy efficiency on cervical carcinoma and generation of radiotherapy resistant model of cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22(16): 5140-5148. |
| [17] |
孙旭, 孙丽芳, 于敏, 等. lncRNA MEG3通过下调miR-7-5p表达对鼻咽癌细胞放射敏感性的影响[J]. 中华放射肿瘤学杂志, 2020, 29(3): 207-210. DOI:10.3760/cma.j.issn.1004-4221.2020.03.011 |
| [18] |
Song L, Peng LP, Hua SC, et al. miR-144-5p enhances the radiosensitivity of non-small-cell lung cancer cells via targeting ATF2[J]. Biomed Res Int, 2018, 2018: 5109497. |
| [19] |
Wang Y, Zhang YY, Yang T, et al. Long non-coding RNA MALAT1 for promoting metastasis and proliferation by acting as a CeRNA of miR-144-3p in osteosarcoma cells[J]. Oncotarget, 2017, 8(35): 59417-59434. DOI:10.18632/oncotarget.19727 |
| [20] |
Ye W, Ma JY, Wang F, et al. LncRNA MALAT 1 regulates miR-144-3p to facilitate epithelial-mesenchymal transition of lens epithelial cells via the ROS/NRF2/Notch1/snail pathway[J]. Oxid Med Cell Longev, 2020, 2020: 8184314. |
| [21] |
Gong XH, Zhu Y, Chang HX, et al. Long noncoding RNA MALAT1 promotes cardiomyocyte apoptosis after myocardial infarction via targeting miR-144-3p[J]. Biosci Rep, 2019, 39(8): BSR20191103. DOI:10.1042/BSR20191103 |
| [22] |
Chen D, Chou FJ, Chen Y, et al. Targeting the radiation-induced TR4 nuclear receptor-mediated QKI/circZEB1/miR-141-3p/ZEB1 signaling increases prostate cancer radiosensitivity[J]. Cancer Lett, 2020, 495: 100-111. DOI:10.1016/j.canlet.2020.07.040 |
| [23] |
Zhang PJ, Wei YK, Wang L, et al. ATM-mediated stabilization of ZEB1 promotes DNA damage response and radioresistance through CHK1[J]. Nat Cell Biol, 2014, 16(9): 864-875. DOI:10.1038/ncb3013 |
| [24] |
Chen LS, Yao HB, Wang K, et al. Long non-coding RNA MALAT1 regulates ZEB1 expression by sponging miR-143-3p and promotes hepatocellular carcinoma progression[J]. J Cell Biochem, 2017, 118(12): 4836-4843. DOI:10.1002/jcb.26158 |
 2022, Vol. 37
2022, Vol. 37


