文章信息
- 林敏, 侯刚, 宋璐, 李道胜
- 乳腺浸润性乳头状癌的临床病理学特征分析
- 实用肿瘤杂志, 2021, 36(2): 163-166
-
作者简介
- 李道胜, E-mail: 13375388374@163.com.
-
文章历史
- 收稿日期:2020-02-20
2. 泰安市中心医院乳腺外科, 山东 泰安 271000
浸润性乳头状癌(invasive papillary carcinoma,IPC)是一种罕见的特殊类型乳腺癌,占所有浸润性乳腺癌的1%~2%[1],多数见于绝经后女性,并且预后良好[2]。之前浸润性乳头状癌主要指导管内乳头状癌伴浸润或微浸润,而浸润癌成分是浸润性导管癌等类型的癌,一般不具有乳头状形态。直至2012年第4版乳腺肿瘤WHO分类中将其定义为“浸润性成分中乳头状结构大于90%的浸润性腺癌”,对这种疾病的认识才逐渐统一[3]。而浸润性乳头状癌经常与其他类型乳腺癌同时存在,单纯的浸润性乳头状癌更为罕见。本文对本院2017年2月至2019年7月经病理证实的6例浸润性乳头状癌的临床和病理资料进行回顾性分析,探讨其临床病理学特征及鉴别诊断,并复习相关文献,以期对这种罕见肿瘤进行更深入研究。
1 资料与方法 1.1 一般资料收集本院2017年2月至2019年7月6例经病理证实的IPC病例。患者均为女性,发病年龄44~78岁,平均年龄60岁。右乳5例,左乳1例,4例位于乳晕旁,2例位于乳腺外周。患者均因发现乳腺无痛性肿物就诊,其中2例伴血性乳头溢液。彩超示乳晕旁或周围乳腺组织内实性低回声结节,肿瘤最大径为2~6.5 cm。5例行单纯乳腺切除术,1例行保乳手术。前哨淋巴结活检均为阴性。电话回访到6例患者,随访时间7~36个月,患者均未见复发及转移。
1.2 方法 1.2.1 HE切片及免疫组织化学标本用4%甲醛固定,石蜡包埋,4 μm切片,苏木精-伊红染色,光学显微镜下观察。6例均行免疫组织化学检查,采用SP法。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、CK5/6、p63、Calponin、p53和Ki-67抗体均购自福建迈新生物有限公司。用福建迈新生物有限公司购买的阳性片作为阳性对照,以封闭血清代替一抗作为阴性对照,所有操作按其说明书进行。免疫组织化学反应产物主要定位于细胞质(CK5/6和Calponin)、细胞膜(HER2)或细胞核(ER、PR、p63、p53和Ki-67),阳性物质呈黄色颗粒状,染色强时可呈棕褐色。
1.2.2 荧光原位杂交(fluorescece in situ hybridization,FISH)法HER2探针购自上海鼎晶生物医药科技股份有限公司,所有操作按其说明书进行。判断标准依据乳腺癌HER2检测指南(2019版)[4]。
2 结果 2.1 光学显微镜下特征5例肿物呈实性,1例略呈囊实性,境界较清楚,镜下无包膜。癌组织主要形成纤细的乳头状结构,乳头相互融合呈较大的复杂乳头及网状乳头状结构(图 1A),局灶区域细胞增生显著呈实性片状,融合的乳头周围无肌上皮细胞,呈膨胀性向间质浸润生长,间质纤维组织增生(图 1B),部分区域乳头融合不明显,呈单个散在分布于纤维性间质中。乳头表面被覆单层-多层立方-低柱状上皮,细胞较拥挤,胞质淡染,嗜酸性,部分细胞具有顶浆分泌胞突, 多数病例为低级别核,个别病例为低-中级别核,可见少量核分裂象,上皮与纤维血管轴心之间缺乏显著的肌上皮细胞(图 1C)。2例为单纯的浸润性乳头状癌,2例伴非特殊型浸润性癌(WHOⅠ级),1例伴筛状癌,1例伴包裹性乳头状癌。
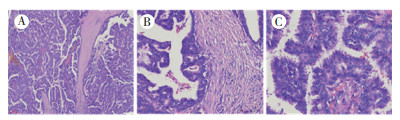
|
| 注 A:癌组织主要形成纤细的乳头状结构,乳头融合形成复杂乳头及网状乳头状结构(HE×100);B:融合的乳头边界清楚,呈膨胀性向间质浸润生长,间质纤维组织增生(HE×200);C:乳头表面被覆单层-多层上皮,细胞较拥挤,胞质淡染,嗜酸性,可见顶浆分泌胞突,胞核中度异型,上皮与纤维血管轴心之间缺乏显著的肌上皮细胞(HE×400) 图 1 浸润性乳头状癌形态特征 |
6例乳头被覆肿瘤细胞ER和PR均弥漫强阳性(> 80%,图 2A~2B),5例HER2染色评分0或1+,1例HER2评分2+。而6例CK5/6、p63和Calponin染色均阴性,提示乳头内及融合的癌巢周围缺乏肌上皮细胞(图 2C)。
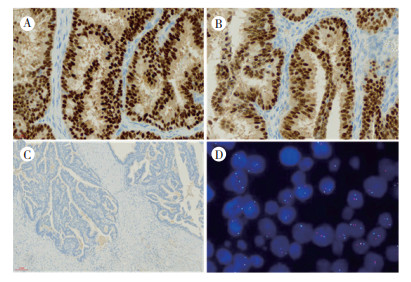
|
| 注 A:肿瘤细胞ER弥漫强+(SP×400);B:肿瘤细胞PR弥漫强+(SP×400);C:p63染色示乳头内和融合乳头周围未见肌上皮(SP×100);D:FISH结果示HER2基因无扩增(×1 000) 图 2 浸润性乳头状癌免疫组织化学及FISH(HER2)检测结果 |
HER2(2+)的病例行FISH检测,显示HER2基因无扩增(图 2D)。
3 讨论乳腺的恶性乳头状病变包含一组形态异质性的肿瘤,包括起源于导管内乳头状瘤的导管原位癌(ductal carcinoma in situ, DCIS)、乳头状DCIS、包裹性乳头状癌(encapsulated papillary carcinoma, EPC)、实性乳头状癌(solid papillary carcinoma, SPC)和浸润性乳头状癌,这些病变在组织结构和免疫组织化学方面有重叠之处,是病理诊断中的一个难点,特别是在区分原位病变和浸润性病变方面具有一定困难。目前较多的研究针对EPC和SPC[5],而浸润性乳头状癌的研究较为少见[6],且其概念有一个变迁的过程,一直以来浸润性乳头状癌指导管内乳头状癌伴浸润或微浸润,而浸润癌成分是浸润性导管癌等类型的癌,一般不具有乳头状结构,2012年第4版乳腺肿瘤WHO分类中将浸润性乳头状癌定义为“浸润性成分中乳头状结构大于90%的浸润性腺癌”,强调具有乳头状结构[3],这一改变促使重新认识这类罕见的肿瘤。
IPC一般发生于绝经后的老年女性,患者平均年龄59~68岁[7-8]。本研究中,患者平均年龄60岁。约50%的IPC病例肿物位于乳头乳晕下方[7],但也可以发生在其他部位,患者常因无意中发现乳腺无痛性肿物就诊,部分患者伴有乳头溢液。本研究中6例患者有4例位于乳晕周围,2例伴有血性乳头溢液。肿瘤一般为囊实性或实性[9],与EPC比较,实性结节更多见。本研究中5例为实性肿物,最大径2~6.5 cm,1例合并存在EPC,略呈囊实性,最大径为5 cm,而浸润灶最大径为1 cm,应以浸润灶的大小评估肿瘤的预后,特别是在伴有囊性结构时,肿瘤往往体积较大,容易过判断。
肿瘤境界清楚,癌组织主要形成纤细的乳头状结构,乳头表面被覆单层-多层立方-低柱状上皮,细胞较拥挤,胞质淡染,嗜酸性,多数病例为低-中级别核,可见少量核分裂象,类似于乳头状导管原位癌或EPC的细胞形态,乳头可相互融合呈较大的复杂乳头状结构,局灶区域可形成腺样、筛状及实性结构,乳头内及癌巢周围均缺乏肌上皮。对于浸润的判断是诊断上的难点,有研究报道25例乳腺表现为扩张性侵袭的乳头状癌,提出尽管乳头状癌形态多变,但出现体积巨大的融合性病变、腺体异常拥挤或形成非常复杂的结构时,应当考虑是否可能存在扩张性侵袭[10]。出现地图状不规则边缘,间质出现促纤维反应也提示浸润。之前国内报道的多例浸润性乳头状癌均呈膨胀性及扩张性的生长方式,损毁性浸润少见[8-9]。这种生长方式需要与乳头型导管原位癌、EPC及SPC相鉴别。乳头型导管原位癌显示光滑和清晰的导管轮廓,周围是完整的肌上皮层。而浸润性乳头状癌缺乏周围的肌上皮层,并且表现为更复杂的乳头融合和更大范围的膨胀性生长。EPC也称囊内乳头状癌,表现为单个或几个膨胀的结节,结节周围为厚的纤维性囊壁,内见乳头状结构,细胞学形态类似于乳头状导管原位癌,虽然这些囊壁周围缺乏肌上皮细胞,但被认为是原位癌的一种类型[11],也有报道认为EPC实际上是具有扩张生长模式的浸润性癌[12]。但在伴有浸润性癌的EPC中,侵袭性成分罕见乳头状结构,而以非特殊型浸润性癌为主,与浸润性乳头状癌并不是一类肿瘤[13]。SPC形成多结节状结构,细胞排列呈实性,呈梭形或流水状,可见核分裂像,常伴黏液分泌及神经内分泌分化,乳头状结构并不明显[14]。虽然这种实性的生长模式可以在其他乳头状肿瘤中看到,但其是SPC的主要生长模式,癌巢的周围也缺乏肌上皮细胞,与EPC一样,SPC也被认为是原位癌的一种类型,具有相似的生物学行为。SPC结节边缘光滑,但出现不规则轮廓、具有不规则的边缘和复杂的拼图状生长模式则被认为是浸润性病变,与原位SPC相关的浸润性成分常为黏液癌[15]。单纯的浸润性乳头状癌非常罕见,常与其他类型乳腺肿瘤相伴存在。本研究中,1例合并EPC,2例合并非特殊型浸润性癌,但均属于WHOⅠ级,1例合并浸润性筛状癌,均为低级别的癌,患者预后良好。
多数IPC表现为ER和PR的高表达,且无HER2基因的扩增,Ki-67增生指数较低[5],属于Luminal A型,这型肿瘤预后较好,出现局部复发及远处转移的风险低[16]。研究发现,包裹性乳头状癌、实性乳头状癌和浸润性乳头状癌的基因表达模式高度相似,认为乳头状癌可能是ER阳性乳腺癌谱系的一部分,而不是一个独特的实体,并且提出淋巴结转移率低、p53低表达、基因拷贝数畸变少和PIK3CA突变率高是浸润性乳头状癌良好预后的根源[17]。乳头状癌中与细胞黏附、迁移和运动相关的基因水平低,是一种低侵袭性肿瘤[18]。在个别报道中,浸润性乳头状癌可出现高级别核、活跃的核分裂像及大片坏死,且不表达ER和PR,提示为一种高级别的肿瘤[19]。大宗病例研究认为,浸润性乳头状癌这种特异性组织学类型并不是一个独立的预后因素,治疗决策不应仅基于这个罕见的组织学类型,对于存在高度侵袭性临床病理特征的IPC患者,应积极治疗[7]。只有不断提高对IPC的临床和生物学特征的认识才能为患者量身定制治疗方案。
浸润性乳头状癌的治疗方案还没有统一的标准,患者一般均应行手术治疗,并根据情况选择不同的手术方式。IPC独特的病理特征及良好的预后提示更有可能接受保乳手术或乳腺单纯切除手术[7]。对ER和PR阳性表达的患者进行内分泌治疗,对有腋窝淋巴结转移,年龄 < 65岁的患者应根据具体情况进行辅助化疗及放疗[20]。本研究中5例行单纯乳腺切除术,1例行保乳术,术中前哨淋巴结活检均无转移,术后均接受内分泌治疗,2例还接受TC(环磷酰胺+多西他赛)化疗各4个周期,患者预后良好,均无复发及转移,但还需更长时间的随访。
| [1] |
Pal SK, Lau SK, Kruper L, et al. Papillary carcinoma of the breast: an overview[J]. Breast Cancer Res Treat, 2010, 122(3): 637-645. DOI:10.1007/s10549-010-0961-5 |
| [2] |
Suh YJ, Shin H, Kwon TJ. Natural history of invasive papillary breast carcinoma followed for 10 years: A case report and literature review[J]. Case Rep Med, 2017, 2017: 3725391. |
| [3] |
Lakhani SR, Ellis IO, Schnitt SJ, et al. World Health Organization classification of tumors of the breast[M]. Lyon: LARC Press, 2012: 64.
|
| [4] |
《乳腺癌HER2检测指南(2019版)》编写组. 乳腺癌HER2检测指南(2019版)[J]. 中华病理学杂志, 2019, 48(3): 169-175. |
| [5] |
卢燕. 乳腺实性乳头状癌二例[J]. 实用肿瘤杂志, 2020, 35(4): 366-368. |
| [6] |
肖璇, 张智弘, 宋国新, 等. 乳腺浸润性乳头状癌六例临床病理观察[J]. 中华病理学杂志, 2017, 46(12): 853-854. DOI:10.3760/cma.j.issn.0529-5807.2017.12.008 |
| [7] |
Zheng YZ, Hu X, Shao ZM. Clinicopathological characteristics and survival outcomes in invasive papillary carcinoma of the breast: A SEER population-based study[J]. Sci Rep, 2016, 6: 24037. DOI:10.1038/srep24037 |
| [8] |
任家材, 袁修学, 高利昆, 等. 乳腺浸润性乳头状癌4例临床病理观察及文献复习[J]. 中国组织化学与细胞化学组织, 2017, 26(3): 272-276. |
| [9] |
吴芳, 田陈, 李秋阳. 乳腺浸润性乳头状癌3例临床病理分析及其鉴别诊断[J]. 实用医药杂志, 2019, 36(2): 65-67. |
| [10] |
杨光之, 李静, 金华, 等. 乳腺表现为扩张性侵袭的乳头状癌的病理形态学观察[J]. 中华病理学杂志, 2013, 42(2): 81-85. DOI:10.3760/cma.j.issn.0529-5807.2013.02.003 |
| [11] |
甘咏莉, 葛荣, 丁锦华, 等. 乳腺包被性乳头状癌临床病理观察[J]. 实用肿瘤杂志, 2013, 28(5): 506-508. |
| [12] |
Hill CB, Yeh IT. Myoepithelial cell staining patterns ofpapillary breast lesions[J]. Am J Clin Pathol, 2005, 123(1): 36-44. DOI:10.1309/XG7TPQ16DMJAV8P1 |
| [13] |
Calderaro J, Espie M, Duclos J, et al. Breast intracystic papillary carcinoma: an update[J]. Breast J, 2009, 15(6): 639-644. DOI:10.1111/j.1524-4741.2009.00823.x |
| [14] |
Guo S, Wang Y, Rohr J, et al. Solid papillary carcinoma of the breast: A special entity needs to be distinguished from conventional invasive carcinoma avoiding over-treatment[J]. Breast, 2016, 26: 67-72. DOI:10.1016/j.breast.2015.12.015 |
| [15] |
熊丹婷, 孙利兵, 张莎莎, 等. 乳腺实性乳头状癌的临床病理观察[J]. 中国医药导报, 2019, 16(17): 101-104. |
| [16] |
Lim GH, Chinthala JP, Gudi MA. Invasive papillary breast cancer with Paget's disease: first reported association and literature review[J]. BMJ Case Rep, 2018, 2018: bcr2017222817. |
| [17] |
Duprez R, Wilkerson PM, Lacroix-Triki M, et al. Immunophenotypic and genomic characterization of papillary carcinomas of the breast[J]. J Pathol, 2012, 226(3): 427-441. DOI:10.1002/path.3032 |
| [18] |
Piscuoglio S, Ng CK, Martelotto LG, et al. Integrative genomic and transcriptomic characterization of papillary carcinomas of the breast[J]. Mol Oncol, 2014, 8(8): 1588-1602. DOI:10.1016/j.molonc.2014.06.011 |
| [19] |
Terzi A, Uner AH. An unusual case of invasive papillary carcinoma of the breast[J]. Indian J Pathol Microbiol, 2012, 55(4): 543-545. DOI:10.4103/0377-4929.107809 |
| [20] |
耿姗姗, 许旭, 顾林, 等. 72例乳腺浸润性乳头状癌的临床分析[J]. 中国肿瘤临床, 2011, 38(6): 349-352. |
 2021, Vol. 36
2021, Vol. 36

