文章信息
- 项凯丽, 赵春雷, 张佩佩, 方圣伟, 韩苏阳, 沈小东, 耿雅文
- Xiang Kaili, Zhao Chunlei, Zhang Peipei, Fang Shengwei, Han Suyang, Shen Xiaodong, Geng Yawen
- 18F-FDG PET/CT显像对非小细胞肺癌免疫治疗疗效预测的价值
- Prognostic predictive value of 18F-FDG PET/CT imaging for immunotherapy of non-small-cell lung cancer
- 实用肿瘤杂志, 2021, 36(2): 135-140
- Journal of Practical Oncology, 2021, 36(2): 135-140
基金项目
- 浙江省公益技术研究计划/社会发展项目(LGF20H180010);杭州市医药卫生科技计划项目重大项目(2018ZD02)
-
通信作者
- 赵春雷, E-mail: clzhaocl@hotmail.com
-
文章历史
- 收稿日期:2021-01-30
2. 浙江大学医学院附属杭州市肿瘤医院核医学科, 浙江 杭州 310002
2. Department of Nuclear Medicine, Affiliated Hangzhou Cancer Hospital, Zhejiang University School of Medicine, Hangzhou 310002, China
肺癌是严重威胁人类健康和制约全球发展的疾病。2019年美国癌症协会显示,肺癌的发病率在所有肿瘤中排在第2位,而死亡率更是位于十大恶性肿瘤类型之首[1]。其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占肺癌的80%~85%。肺癌的传统治疗手段主要包括外科手术切除、放化疗和分子靶向治疗等,但这些传统的治疗手段所能获得的疗效已进入一个难以突破的瓶颈期。免疫治疗是通过对免疫系统的再激活,增强肿瘤微环境中免疫细胞识别和杀伤肿瘤细胞的能力,达到治疗肿瘤的目的,为传统治疗方式无效的患者提供新选择[2]。18F-脱氧葡萄糖(fluorodeoxyglucose,FDG)PET/CT作为一种安全无创的影像学检查手段,可以通过葡萄糖代谢水平来全面反映全身肿瘤病灶的部位和活跃程度。PET/CT显像中最常用的评价肿瘤代谢活性的参数主要有最大标准摄取值(maximum standardized uptake value,SUVmax)、平均标准摄取值(mean standardized uptake value,SUVmean)、肿瘤代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion glycolysis, TLG)。其中SUV在临床中应用最为广泛。MTV是一项以SUVmax为基础计算出的病灶代谢容积参数,通过设定阈值对高FDG摄取的病灶进行容积分割而获得。TLG为MTV与SUVmean的乘积,能够综合反映肿瘤代谢活性和代谢体积。目前18F-FDG PET/CT在NSCLC的诊断、分期、疗效判断及预后中的价值已得到临床认可[3-5]。但在接受免疫治疗的NSCLC患者中,18F-FDG PET/CT显像与疗效之间的关联尚少见报道。本文旨在探讨18F-FDG PET/CT显像在预测NSCLC免疫治疗预后中的价值,寻找具有预测预后价值的评价指标。
1 资料与方法 1.1 一般资料本研究为回顾性研究,符合《赫尔辛基宣言》的原则。收集2016年12月至2020年10月间于浙江大学医学院附属杭州市肿瘤医院免疫治疗前行18F-FDG PET/CT显像的NSCLC患者。患者纳入标准:(1)经病理证实为NSCLC;(2)18F-FDG PET/CT检查与开始免疫治疗间隔时间 < 60 d;(3)接受≥2个周期的免疫治疗;(4)18F-FDG PET/CT检查至实行免疫治疗期间未行放化疗和分子靶向药物等其他全身性抗肿瘤治疗。排除标准:(1)已知合并有其他恶性肿瘤;(2)患有自身免疫性疾病;(3)临床资料不完整。
1.2 18F-FDG PET/CT显像图像采集使用美国GE公司的Discovery PET/CT 710显像仪。显像剂采用上海原子科兴药业有限公司生产的18F-FDG注射液,放射化学纯度 > 95%。患者检查当日禁食 > 6 h,检查前测量身高、体质量及血糖,如果为糖尿病患者,空腹血糖≤11.1 mmol/L。患者静脉注射18F-FDG 3.7~4.4 MBq/kg后,安静休息40~60 min,避免肢体运动及声光刺激。PET/CT检查前嘱患者排尽尿液后仰卧于检查床上,双臂上举,扫描范围为头顶至双侧股骨上段。首先行全身CT扫描,扫描参数为电压120 kV,电流160~220 mA,层厚5 mm,然后行PET扫描,视患者身长采集5~8个床位,每个床位采集约2 min。PET数据经CT衰减校正后通过迭代重建法进行图像重建,最终获得横断位、冠状位及矢状位的PET断层图像以及PET/CT融合图像。
1.3 图像分析及PET代谢参数提取由2位经验丰富的核医学医师在图像处理分析工作站对PET/CT图像进行视觉评价和半定量分析,通过视觉评价判定异常浓聚病灶后,记录病灶总数与远处转移灶数目,测量各个病灶的SUVmax,以各个病灶SUVmax的40%为阈值,由计算机软件自动勾画该病灶感兴趣区(region of interest,ROI),获得对应的代谢参数:SUVmean、MTV和TLG。记录肺内原发病灶(primary lesion, P)SUVmax、MTV、TLG(SUVmax-P、MTV-P和TLG-P)、全身最高浓聚转移灶处病灶(highest lesion,H)SUVmax(SUVmax-H)。之后,计算全部病灶汇总后的全身(whole body lesions,wb)MTV(MTV-wb)、全身TLG(TLG-wb)、肺癌区域淋巴结转移(lymph node metastasis,LN)的总MTV(MTV-LN)及总TLG(TLG-LN)、远处转移灶(metastatic tumor,mt)的总MTV(MTV-mt)及总TLG(TLG-mt)。为比较不同患者病灶的糖代谢水平,在测量各个患者纵隔大血管区域(mediestinum,M)SUVmean(SUVmean-M)作为本底代谢水平之后,计算并比较SUVmax-P/SUVmean-M和SUVmax-H/SUVmean-M。参照国际肺癌研究协会第8版肺癌TNM分期标准[6],对患者进行精准TNM分期。
1.4 免疫治疗疗效评估免疫治疗方案由有经验的临床医师根据患者肿瘤组织学类型、程序性细胞死亡因子-1配体(programmed cell death ligand-1,PD-L1)表达情况和患者的综合情况制定。患者在接受免疫治疗6个月后,根据实体肿瘤的疗效评价标准1.1(Response Evaluation Criteria in Solid Tumors RECIST Version 1.1,RECIST1.1)对疗效进行评价[7]。判断标准如下:(1)完全缓解(complete response,CR),所有靶病灶消失;(2)部分缓解(partial response,PR),靶病灶直径之和比基线水平减少≥30%;(3)疾病进展(progressive disease,PD),以整个研究过程中所有测量的靶病灶直径之和的最小值为参照,直径之和增加≥20%或出现≥1个新病灶;(4)疾病稳定(stable disease,SD),靶病灶减小/增加的程度没有达到PR或PD,介于两者之间。当影像学评估不能判断疾病快速进展或患者临床情况出现恶化时,则仅通过临床和实验室指标来评估疗效。根据判断结果将患者分成临床获益(clinical benefit,CB)组和PD组。CB组由疗效判断结果为CR、PR及SD的患者组成。
1.5 随访随访时间为2.2~21.7个月,中位随访时间为7.7个月,通过查阅患者住院及门诊电子病历和电话方式进行随访,记录患者生存情况。失访0例。
1.6 统计学分析应用SPSS 25.0软件对数据进行统计学分析。符合正态分布的计量资料以均值±标准差(x±s)表示,不符合正态分布的计量数据以中位数及四分位数[M(Q1~Q3)]表示,组间比较采用t检验。计数资料以频数(百分比)表示,组间比较采用进行χ2检验。观察并记录患者的无进展生存时间(progression-free survival,PFS),即患者接受免疫治疗开始到疾病出现进展或复发的时间。在单因素分析中差异具有统计学意义的参数以其中位数作为分组依据,采用Kaplan-Meier法绘制PFS曲线,log-rank法比较各组生存情况。以P < 0.05为差异具有统计学意义。
2 结果 2.1 患者临床资料分析本研究共纳入24例患者,其中男性21例,女性3例;年龄34~78岁(60.9±8.6岁);有吸烟史者16例(66.7%);病理类型为鳞癌15例(62.5%),腺癌9例(37.5%)。接受抗PD-1抗体治疗者21例,接受抗PD-L1抗体治疗者3例,其中有4例在免疫治疗前已切除原发灶。PET/CT检查至开始免疫治疗的中位间隔时间为10.5 d(7~20 d)。免疫治疗后6个月行疗效评价显示,CB组17例,PD组7例。CB组与PD组在患者年龄、性别、病理类型、吸烟史及TNM分期方面比较,差异均无统计学意义(均P > 0.05,表 1)。
| 组别 | 例数 | 年龄(岁,x±s) | 性别(例) | 吸烟史(例) | 病理类型(例) | TNM分期(例) | |||||||
| 女性 | 男性 | 不吸烟 | 吸烟 | 鳞癌 | 腺癌 | Ⅲ期 | Ⅳ期 | ||||||
| PD组 | 7 | 58.00±10.89 | 2 | 5 | 2 | 5 | 5 | 2 | 3 | 4 | |||
| CB组 | 17 | 62.12±7.50 | 1 | 16 | 6 | 11 | 10 | 7 | 4 | 13 | |||
| χ2/t值 | -1.071 | 2.334 | 0.101 | 0.101 | 0.336 | 0.897 | |||||||
| P值 | 0.296 | 0.127 | 0.751 | 0.751 | 0.562 | 0.344 | |||||||
| 注 NSCLC:非小细胞肺癌(non-small-cell lung cancer);PD:疾病进展(progressive disease);CB:临床获益(clinical benefit) | |||||||||||||
在PET参数中,CB组和PD组仅在MTV-wb(P=0.044)和MTV-mt(P=0.021)方面比较,差异具有统计学意义,而在病灶数目及其他PET/CT代谢参数方面比较,差异均无统计学意义(均P > 0.05,表 2)。部分患者由于已切除原发病灶、未发现远处转移和(或)肺区域淋巴结转移,在相应统计中按实际例数计算。
| 显像参数 | PD组 | CB组 | t值 | P值 |
| 病灶总数(个) | 7.43±3.01(n=7) | 6.82±1.27(n=17) | 0.221 | 0.827 |
| 远处转移灶数(个) | 4.00±2.73(n=7) | 1.59±0.51(n=17) | 0.867 | 0.417 |
| SUVmax-H/ SUVmean-M | 6.99±1.32(n=7) | 6.94±0.77(n=17) | 0.038 | 0.970 |
| SUVmax-P/ SUVmean-M | 5.54±1.57(n=6) | 6.30±0.82(n=14) | -0.469 | 0.645 |
| MTV-P(cm3) | 27.07±8.45(n=6) | 41.93±12.48(n=14) | -0.740 | 0.469 |
| TLG-P(cm3) | 136.84±49.89(n=6) | 314.81±102.82(n=14) | -1.095 | 0.288 |
| MTV-wb(cm3) | 185.59±81.42(n=7) | 70.68±11.68(n=17) | 2.137 | 0.044 |
| TLG-wb(cm3) | 510.68±152.08(n=7) | 454.51±88.82(n=17) | 0.332 | 0.743 |
| MTV-mt(cm3) | 120.01±59.61(n=4) | 25.85±7.65(n=11) | 2.625 | 0.021 |
| TLG-mt(cm3) | 386.54±229.77(n=4) | 157.26±63.34(n=11) | 1.366 | 0.195 |
| MTV-LN(cm3) | 18.2±4.67(n=7) | 22.12±5.76(n=16) | -0.421 | 0.678 |
| TLG-LN(cm3) | 111.39±53.16(n=7) | 96.3±31.45(n=16) | 0.256 | 0.801 |
| 注 NSCLC:非小细胞肺癌(non-small-cell lung cancer);PD:疾病进展(progressive disease);CB:临床获益(clinical benefit);SUVmax:最大标准摄取值(maximum standardized uptake value);SUVmean:平均标准摄取值(mean standardized uptake value);MTV:肿瘤代谢体积(metabolic tumor volume);TLG:病灶糖酵解总量(total lesion glycolysis);H:全身最高浓聚转移灶处病灶(highest lesion);M:纵隔大血管(mediestinum);P:原发病灶(primary lesion);wb:全身病灶(whole body lesions);mt:远处转移灶(metastatic tumor);LN:肺癌区域淋巴结转移灶(lymph node metastasis) | ||||
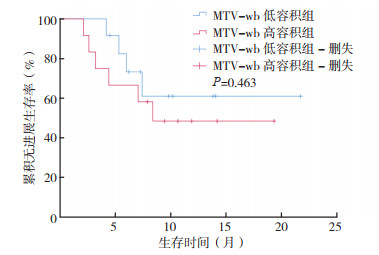
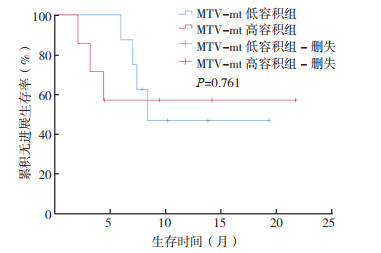
根据单因素分析结果,参考文献[8]方法,选取MTV-wb中位数(65.5 cm3)将患者分为MTV-wb高容积组和低容积组,选取MTV-mt中位数(17.8 cm3)将患者分为MTV-mt高容积组和低容积组。MTV-wb低容积组的PFS为(15.6±2.5)个月,高于MTV-wb高容积组的(11.8±2.2)个月,但差异无统计学意义(P > 0.05,图 1)。MTV-mt低容积组PFS为(12.9±2.2)个月,低于MTV-mt高容积组的(13.8±3.4)个月,差异亦无统计学意义(P > 0.05,图 2)。
|
| 图 1 MTV-wb高容积组(n=12)和低容积组(n=12)患者的无进展生存曲线 Fig.1 The PFS curves of patients with high MTV-wb (n=12) and low MTV-wb (n=12) |
|
| 图 2 MTV-mt高容积组(n=7)和低容积组(n=8)患者的无进展生存曲线 Fig.2 The PFS curves of patients with high MTV-mt (n=7) and low MTV-mt (n=8) |
免疫治疗通过对免疫系统的再激活,增强肿瘤微环境中免疫细胞识别和杀伤肿瘤细胞的能力,达到治疗肿瘤的目的,是一种新的治疗方法,主要包括使用免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、嵌合抗原受体T细胞疗法(chimeric antigen receptor T cell,CAR-T)和个性化肿瘤突变定制疫苗(cancer vaccine)等[9]。目前临床上应用最多的是免疫检查点抑制剂疗法,主要包括抗程序性细胞死亡因子-1(programmed cell death-1,PD-1)抗体和抗PD-L1抗体。为了筛选适合治疗的患者和预测预后,临床多采用免疫组织化学(immunohistochemistry,IHC)检查来测定肿瘤组织中PD-L1的表达水平[10]。由于肿瘤具有异质性,肿瘤组织样本中的PD-L1表达水平常常无法全面反映全身肿瘤负荷的情况,而且IHC检查需采集组织样本,操作具有侵入性,难以多次重复取材,限制其应用。18F-FDG PET/CT作为一种安全无创的影像学检查手段,可以通过评价葡萄糖代谢水平来全面反映全身肿瘤病灶的部位和活跃程度,已被广泛应用于NSCLC的分期和疗效评价[3]。目前在NSCLC中,使用PET/CT对免疫治疗预后进行预测的研究较少,报道结果也不尽相同。为明确PET/CT显像对NSCLC免疫治疗预后预测的价值,本文对24例于免疫治疗前接受18F-FDG PET/CT显像的NSCLC患者的临床及影像资料进行分析发现,PET/CT显像对免疫治疗的预后具有潜在的预测价值。
SUV是PET显像中应用最广泛的评价肿瘤代谢的参数之一,由于其容易测量,并且在同一个体治疗前后的可比性好,所以在疗效评价时常常使用SUV。有研究发现,SUVmax与肿瘤细胞增殖及不良预后相关,在NSCLC患者中可作为预后预测的指标[11]。但SUVmax无法反映全身其他病灶的代谢活性,其对预后预测价值仍存在争议[12]。本研究亦未发现SUVmax与预后之间存在关联,考虑可能与SUVmax仅反映肿瘤代谢活性的最高程度,不包含体积信息,无法代表全身肿瘤代谢负荷状态及肿瘤总体代谢活性有关。
作为一项全身性的检查手段,18F-FDG PET/CT能够灵敏地发现远处转移灶,有利于整体全面地评价病情。MTV-wb计算包括远处转移灶在内全部肿瘤病灶代谢体积的总和,可以反映全身总体肿瘤负荷状态。有研究对75例NSCLC患者免疫治疗前的PET/CT图像进行分析发现,MTV-wb是预测肺癌免疫治疗预后的有效指标[13]。研究发现,MTV-mt更高的患者,肿瘤的侵袭性强,全身的肿瘤代谢负荷高,接受免疫治疗后短期内出现疾病进展的可能性更高[14]。本研究获得相似结果,发现CB组的MTV-wb及MTV-mt均小于PD组。但进一步以MTV-wb及MTV-mt分组进行生存分析,却发现组间PFS差异均无统计学意义(均P > 0.05),考虑可能与本研究样本数量不足和随访时间较短有关。
本研究未发现肿瘤原发灶代谢参数与免疫治疗疗效之间存在关联。考虑仅仅使用原发灶在评价整体病情时作用相对局限,当肿瘤出现转移时,无法准确反映全身病情,此时采用全身肿瘤代谢参数则更有意义。另外,笔者也未发现肺癌区域淋巴结代谢指标与免疫治疗疗效之间存在关联,推测区域淋巴结的代谢水平可受多种因素的影响,在良恶性病变时均可出现淋巴结代谢水平增高[15],因而难以准确反映肿瘤的局部转移情况,可能对分析带来一定的偏差。
本研究中由于18F-FDG PET/CT显像在治疗前进行,因此只对基线图像进行分析。近期受到关注的PET影像组学作为一种新兴研究手段,可在传统的半定量分析如SUV、MTV和TLG等参数的基础上,对PET图像进行肿瘤直方图强度、肿瘤形状和纹理结构等高维特征提取,在肿瘤研究领域的价值日益受到重视。一项对57例NSCLC患者的PET图像进行的回顾性分析发现,对于具有肿瘤体积大、代谢“偏度”和“峰度”异质性强等特征的患者接受免疫治疗后失败的可能性更高,提示PET/CT显像分析中的放射组学参数在预测免疫治疗反应中具有潜力[14]。未来笔者将在增加病例数量和追踪观察长期疗效的基础之上,采用PET放射组学的方法对于患者PET图像的纹理参数进一步分析挖掘,探索有临床应用价值的影像特征。
本研究结果表明,在单独采用免疫治疗的NSCLC患者中,PET/CT显像对于短期预后具有潜在的预测价值,全身肿瘤病灶总量越小,疗效可能越好。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
章程燕, 王苹莉. 联合免疫治疗在晚期NSCLC中的疗效现状与前景[J]. 实用肿瘤杂志, 2019, 34(3): 191-197. |
| [3] |
李晶, 侯海峰, 孙达, 等. 乳腺癌18F-FDG PET/CT代谢参数与TNM分期及Ki-67表达的关系[J]. 实用肿瘤杂志, 2019, 34(5): 424-429. |
| [4] |
Hong IK, Lee JM, Hwang IK, et al. Diagnostic and predictive values of 18F-FDG PET/CT metabolic parameters in EGFR-mutated advanced lung adenocarcinoma[J]. Cancer Manag Res, 2020, 12: 6453-6465. DOI:10.2147/CMAR.S259055 |
| [5] |
Li X, Wang D, Yu L. Prognostic and predictive values of metabolic parameters of 18F-FDG PET/CT in patients with non-small cell lung cancer treated with chemotherapy[J]. Mol Imaging, 2019, 18: 1536012119846025. |
| [6] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for revision of the TNM Stage Groupings in the forthcoming (eighth) edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [7] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [8] |
王超雨, 吴凌, 孙成涛, 等. 18F-氟代脱氧葡萄糖PET/CT对初诊多发性骨髓瘤患者评估预后价值分析[J]. 中华医学杂志, 2019, 99(4): 301-306. |
| [9] |
胡静, 赵明芳. 驱动基因阴性晚期NSCLC一线免疫治疗精彩纷呈: 雾里看花[J]. 实用肿瘤杂志, 2020, 35(1): 19-24. |
| [10] |
Mielgo-Rubio X, Calvo V, Luna J, et al. Immunotherapy moves to the early-stage setting in non-small cell lung cancer: emerging evidence and the role of biomarkers[J]. Cancers (Basel), 2020, 12(11): 3459. DOI:10.3390/cancers12113459 |
| [11] |
Dooms C, van Baardwijk A, Verbeken E, et al. Association between 18F-fluoro-2-deoxy-D-glucose uptake values and tumor vitality: prognostic value of positron emission tomography in early-stage non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4(7): 822-828. DOI:10.1097/JTO.0b013e3181a97df7 |
| [12] |
Seban RD, Mezquita L, Berenbaum A, et al. Baseline metabolic tumor burden on FDG PET/CT scans predicts outcome in advanced NSCLC patients treated with immune checkpoint inhibitors[J]. Eur J Nucl Med Mol Imaging, 2020, 47(5): 1147-1157. DOI:10.1007/s00259-019-04615-x |
| [13] |
Chardin D, Paquet M, Schiappa R, et al. Baseline metabolic tumor volume as a strong predictive and prognostic biomarker in patients with non-small cell lung cancer treated with PD1 inhibitors: a prospective study[J]. J Immunother Cancer, 2020, 8(2): e000645. DOI:10.1136/jitc-2020-000645 |
| [14] |
Polverari G, Ceci F, Bertaglia V, et al. 18F-FDG PET parameters and radiomics features analysis in advanced NSCLC treated with immunotherapy as predictors of therapy response and survival[J]. Cancers (Basel), 2020, 12(5): 1163. DOI:10.3390/cancers12051163 |
| [15] |
张毓艺, 姚稚明, 薛倩倩, 等. 18F-FDG PET/CT鉴别诊断非小细胞肺癌患者不同密度肺门纵隔淋巴结良恶性的价值[J]. 中华核医学与分子影像杂志, 2020, 40(9): 513-517. DOI:10.3760/cma.j.cn321828-20190828-00183 |
 2021, Vol. 36
2021, Vol. 36


